干旱胁迫下甘肃野生草地早熟禾内源激素水平的动态变化
2014-09-10马晖玲
俞 玲,马晖玲
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
当今世界,水资源的匮乏是一个普遍性的问题,尤其在西北地区显得更加突出。干旱胁迫是限制草坪草生长的最重要的环境因子之一[1],不仅威胁其幼苗的生存,且对后期产量、越冬等都有一定影响[2,3]。因此,研究其抗旱性,对北方地区草坪的建植、植被恢复以及生态环境改善具有重要意义。
内源激素是植物体内重要的生长调节物质,与植物抗逆性有着密切的联系。逆境条件打破了植物体内激素产生和分配的平衡状况,导致代谢途径发生变化,使植物对逆境的适应性与抗性增强[4],很多学者研究发现,气孔是对植物激素变化最敏感的部位,并且认为脱落酸(ABA)[5]和细胞激动素(CTK)[6]的相互作用对气孔开闭产生影响进而增加其对干旱的适应性。Lu等[7]研究证明在干旱胁迫下,小麦叶片中ABA含量升高,并且抗旱品种积累的ABA较多。目前,对优良抗旱草坪草草地早熟禾的选育成为研究热点,有关干旱胁迫下草地早熟禾生理指标的变化报道的很多[8-10],而对草地早熟禾内源激素的动态变化研究还较少。因此,以甘肃省野生草地早熟禾为材料,采用高效液相色谱法,就不同草地早熟禾材料在干旱胁迫下ABA,IAA和ZT 3种内源激素的动态变化进行分析,探讨草地早熟禾对干旱胁迫的响应机制,以期为草地早熟禾抗旱性的深入研究提供理论依据。
1 材料和方法
1.1 供试材料和试验仪器
安定(AD)和西和(XH)野生草地早熟禾种子分别采自甘肃省定西市安定区、陇南市西和县。
试验采用Agilent 1100 Series液相色谱仪、旋转蒸发仪、VWD检测器、紫外分光光度计、0.22 μm有机系针头过滤器。ZT标样购自兰州中瑞实验耗材经营部国产分装产品;IAA和ABA标样购自兰州科迈实验耗材经营部国产分装产品;甲醇、石油醚为色谱纯;其他试剂均为分析纯,实验用水为超纯水。
1.2 试验方法
1.2.1 试验设计 试验在甘肃农业大学草业学院培养室进行,2013年4月5日将野生草地早熟禾成熟种子播于直径18 cm的花盆,种植基质为土壤、有机质、砂子按7∶2∶1组成。试验设置对照(CK)和成坪以后进行的干旱处理,即草地早熟禾充分灌水(即达到土壤最大持水量)后不再浇水,令其自然失水,干旱处理以土壤含水量占最大持水量的百分比分为5个梯度:无胁迫(CK,100%),轻度胁迫(75%~85%),中度胁迫(55%~65%),重度胁迫(35%~45%),严重胁迫(15%~25%),每份材料3个重复,当土壤含水量在设定的梯度范围时,采取叶片进行测量,每天早上8∶30补充前一天失去的水分,使各处理在采样时达到设定的含水量。
1.2.2 样品处理及HPLC分析 称取新鲜叶片1 g,加入10 mL预冷的80%甲醇,液氮研磨至匀浆。密封置冰箱4 ℃,浸提24 h,5 000 r/min离心15 min,取上清液,残渣再加入5 mL 80%的冷甲醇溶液避光数小时,相同条件离心10 min,合并上清液,用旋转蒸发仪35 ℃蒸至原体积的1/2。经C18胶柱分离纯化后,氮气吹干,流动相定容至1 mL,经0.22 μm有机系针头过滤,取20 μL进行色谱分析。
1.2.3 色谱条件 色谱柱:采用Eclipse XDB-C8柱(4.6 mm×150 mm,5 um);流速:1 mL/min;检测波长:254 nm;进样量:20 μL;流动相按甲醇∶0.6%冰乙酸(45∶55)为基准前后变化进行摸索,柱温设置25 ℃和35 ℃两个温度,进行比较。最后以激素彻底分离,峰形好来选择出最佳的流动相和柱温。
1.2.4 数据分析 利用Excel进行数据整理,Spass 19.0进行方差分析。
2 结果与分析
2.1 色谱条件的选择
2.1.1 流动相的选择 采用甲醇和水作为流动相时,3种激素分离不完全,且色谱图拖尾现象严重,峰形不好。冰乙酸可以抑制样品的电离、改善拖尾现象,因此,在流动相中加入0.6%冰乙酸。试验就流动相中甲醇和冰乙酸的体积比进行分析比较,结果表明,当甲醇与0.6%冰乙酸体积比>45∶55时,各激素能完全分开,但色谱峰分离度较小;当体积比<45∶55时,激素灵敏度下降、保留时间迅速增加,且易对色谱柱的填充物造成损害;当体积比为45∶55时,各个激素分离彻底、峰形好,无拖尾现象。故选择甲醇∶0.6%的冰乙酸为45∶55的流动相。
2.1.2 柱温的选择 柱温对不同激素色谱峰之间的分离有显著的影响。因此,设定25 ℃和35 ℃ 2个梯度,对不同柱温下IAA,ZT和ABA之间的分离效果进行了研究,试验表明在25 ℃柱温下分离效果最佳。
2.2 干旱胁迫下野生草地早熟禾叶片内源激素的动态变化
2.2.1 干旱胁迫下草地早熟禾叶片ZT含量变化 干旱胁迫促使草地早熟禾ZT含量显著下降,但变化幅度因种质材料的不同而不同。轻度(75%~85%)、中度(55%~65%)和重度胁迫(35%~45%)下,AD和XH叶片ZT含量较对照均显著下降。严重胁迫下(15%~25%),AD和XH叶片ZT含量继续下降至最低,分别为62.28、63.42 ng/g。干旱胁迫使AD叶片ZT的含量下降幅度最大,与对照相比,下降了62.45%(图1)。

图1 草地早熟禾叶片ZT含量Fig.1 Changes of ZT in leaves of indigenous
2.2.2 干旱胁迫下草地早熟禾叶片IAA含量变化 干旱胁迫下,草地早熟禾叶片IAA含量变化趋势相同,均先上升后下降。轻度胁迫(75%~85%)促进IAA含量的增加,其增加幅度存在差异,XH叶片IAA含量达到峰值,为690.84 ng/g,但明显低于AD;中度胁迫(55%~65%)下,XH叶片IAA含量下降而AD叶片IAA含量继续上升至峰值,为796.36 ng/g。随着胁迫程度的继续加大,AD和XH叶片的IAA含量均下降。胁迫末期,IAA含量均降至最低,分别为374.40、310.94 ng/g(图2)。
2.2.3 干旱胁迫下草地早熟禾叶片ABA含量变化 干旱胁迫促进ABA含量的积累。轻度胁迫下(75%~85%),ABA含量较对照显著增加;中度胁迫下(55%~65%),ABA含量变化存在明显差异,其中,XH叶片ABA含量显著降低,而AD叶片ABA含量继续增加并且达到峰值为443.98 ng/g;重度胁迫下(35%~45%),ABA含量均下降,其中,XH叶片ABA含量降至最低;严重胁迫下(15%~25%),AD叶片ABA含量下降,而XH叶片ABA含量略微上升,但均显著高于对照,干旱胁迫使AD叶片ABA含量增加幅度最大,为73.95%(图3)。

图2 草地早熟禾叶片IAA含量Fig.2 Changes of IAA in leaves of indigenous bluegrass
2.2.4 干旱胁迫下草地早熟禾叶片ZT/ABA,ZT/IAA和(ZT+IAA)/ABA变化 干旱胁迫下, ZT/ABA和(ZT+IAA)/ABA总体呈下降趋势,ZT/IAA先下降后上升,但较对照显著下降(表1)。其中ZT/ABA下降幅度最大,在70.69%~77.94%;其次为(ZT+IAA)/ABA,下降幅度为64.85%~70.29%;下降幅度最小的是ZT/IAA,在20.00%~29.17%。

图3 草地早熟禾叶片ABA含量Fig.3 Changes of ABA in leaves of indigenous bluegrass
胁迫期间,ZT/ABA、ZT/IAA和(ZT+IAA)/ABA变化幅度因胁迫程度的不同而不同。其中轻度(75%~85%)和中度(55%~65%)胁迫下,三者下降幅度最大,显著低于对照。重度胁迫(35%~45%)下,(ZT+IAA)/ABA和ZT/ABA继续下降,和中度胁迫相比,均差异显著。严重胁迫下,(ZT+IAA)/ABA和ZT/ABA继续下降至最低,与重度相比,前者差异显著,后者无显著性差异。整个胁迫期间,AD叶片ZT/ABA、ZT/IAA和(ZT+IAA)/ABA下降幅度最大。
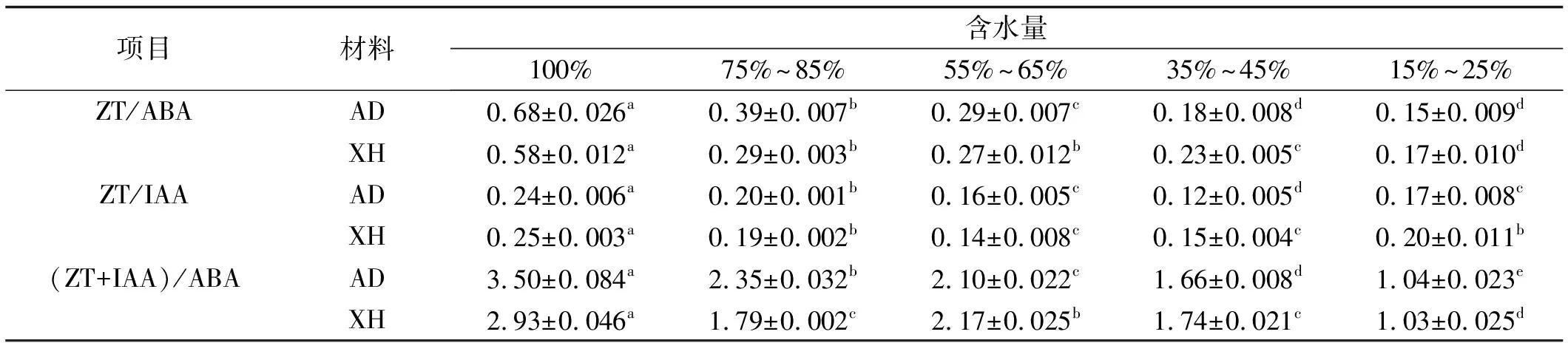
表1 草地早熟禾叶片ZT/ABA,ZT/IAA和(ZT+IAA)/ABATable 1 Changes of ZT/ABA,ZT/IAA and (ZT+IAA)/ABA in leaves of indigenous bluegrass
3 讨论与结论
3.1 干旱胁迫对草地早熟禾叶片内源激素含量的影响
3.1.1 干旱胁迫对叶片ZT含量的影响 ZT是植物体内最常见的细胞分裂素,其促进细胞分裂、扩大,侧芽发育,还促进营养物质移动和延迟衰老[11],与植物抗逆性密切相关。水分胁迫期间ZT含量的降低,有利于植物保持较高的水分,是一种保护性的生理反应[12]。胁迫期间叶片ZT含量降低,导致植株生长速率减慢,从而缓解了干旱造成的压力。抗旱能力越强,自身调节能力就越大,即水分胁迫下ZT的合成越少[4]。胁迫期间安定野生草地早熟禾叶片ZT含量下降最明显,胁迫末期ZT含量只有对照的37.55%,说明安定野生草地早熟禾对干旱的耐受性较强。
3.1.2 干旱胁迫对叶片IAA含量的影响 试验研究中水分胁迫初期,IAA含量呈上升趋势,表明轻度干旱不足以对草地早熟禾的生长构成威胁,此时植物仍在生长,随胁迫程度的继续增加,IAA含量下降,可能是因为重度胁迫下,IAA的合成部位受损,无法继续合成IAA,植物通过抑制自身的生长来抵御干旱,总体而言,干旱胁迫下IAA含量与对照相比显著下降,这与Wang等[13]的研究结果一致。然而,在茶树和棉花等[14-17]研究中,干旱胁迫促进了IAA的积累,有关水分状况和内源IAA水平之间的关系,迄今为止还有争议,其内在机制尚需深入研究[18]。
3.1.3 干旱胁迫对叶片ABA含量的影响 ABA作为一种信号传导因子,主要由根产生,能够促进休眠、抑制生长、还可以促进气孔关闭和促进根系水分吸收[18,19]。轻度和中度干旱胁迫下,ABA含量积累较多,说明其在逆境下对环境变化的潜在适应性较强,然而这种适应性是有限度的,随着胁迫程度的继续加重,这种自我保护的机制会遭到破坏,从而使ABA含量下降。总体分析,草地早熟禾叶片ABA含量,均随胁迫程度的增加,呈上升趋势,赵文魁等[19]研究也得到了相似的结论,ABA能够增加植物根部的水分吸收,促使叶片气孔开度受抑或关闭,水分蒸腾减少,最终植物的保水能力提高。
很多学者认为,品种的抗旱性与ABA的积累密切相关,抗旱性越强,ABA含量增加速度越快,积累能力越强[18,20],干旱胁迫下,安定野生草地早熟禾叶片ABA含量增加幅度最大,比对照增加了73.95%,初步推测安定野生草地早熟禾抗旱性强于西和野生草地早熟禾,然而ABA的积累又会引起叶片脱落,加速植株衰老。因此,干旱胁迫下植物体内积累的ABA并不是越多越好,此次试验ABA含量在胁迫后期下降正好说明这一点。
3.1.4 干旱胁迫对草地早熟禾叶片ZT/ABA,ZT/IAA,(ZT+IAA)/ABA的影响 随着干旱胁迫强度的增加,安定和西和野生草地早熟禾叶片的ZT/ABA、ZT/IAA和(ZT+IAA)/ABA呈下降趋势,这3种激素相互抑制,相互促进,共同参与了代谢平衡,干旱胁迫期间,IAA,ZT和ABA的变化总是向着促进气孔关闭,减缓生长发育,维持细胞膨压的方向代谢,以便植物最优化地利用有限水分,这在很多研究中得到了证明[21,22]。安定野生草地早熟禾叶片的ZT/ABA,ZT/IAA和(ZT+IAA)/ABA下降幅度大于西和野生草地早熟禾,表明其应对干旱胁迫的能力强于后者。
参考文献:
[1] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[2] 黎裕.作物抗旱鉴定方法与指标[J].干旱地区农业研究,1993,11(1):91-98.
[3] 李智念,王光明,曾之文.植物干旱胁迫中的ABA研究[J].干旱地区农业研究,2003,21(2):99-104.
[4] 孙志勇,季孔庶.干旱胁迫对杂交鹅掌楸无性系叶片内源激素含量的影响[J].安徽农业科学,2010,38(31):17362-17364.
[5] Davies P J.Hormones as regulators of water balance[M]∥Davies S T.plant hormones and their role in plant growth and development.Martinus Nijhoff Pubilishers,1987:411-430.
[6] Luke H H,Freeman T E.Stimulation of transpiration by cytokinins [J].Nature,1968,217:873-874.
[7] Lu D B,Paulsen G M.Increasing stress resistance by in vitro selection for abscisic acid insensitively in wheat[J].Crop science,1989,29(4):939-943.
[8] 温洋,孙吉雄,王代军.干旱胁迫对冷地型草坪草生理特性影响的研究[J].草原与草坪,2005(1):43-45.
[9] 段碧华,尹伟伦,韩宝平,等.模拟干旱胁迫下几种冷季型草坪草抗旱性比较研究[J].草原与草坪,2005(5):38-41.
[10] 李显利,米福贵,闫立军,等.草地早熟禾不同品种抗旱性的评价分析[J].草原与草坪,2010,30(3):43-46.
[11] 李源,王赞,刘贵波,等.干旱胁迫下胶质苜蓿内源激素及解剖结构的研究[J].华北农学报,2010,25(6):211-216.
[12] 潘根生,吴伯千,沈生荣,等.水分胁迫过程中茶树新稍内源激素水平的消长及其与耐旱性的关系[J].中国农业科学,1996,29(5):9-15.
[13] Wang C h R,Yang A F,Yin H Y.Influence of water stress on endogenous hormone concentrations and cell damage of maize seedlings[J].Integrative Plant Biology,2008,50:427-434.
[14] 潘根生,钱利生,吴伯千,等.茶树新梢生育的内源激素水平及其调控机理(第三报)干旱胁迫对茶树内源激素的影响[J].茶叶,2001,27(1):35-38.
[15] 李东晓,李存东,孙传范,等.干旱对棉花主茎叶片内源激素含量与平衡的影响[J].棉花学报,2010,22(3):231-235.
[16] 沈法富,喻树迅,范术丽,等.不同短季棉品种生育进程中主茎叶内源激素的变化动态[J].中国农业科学,2003,36(9):1014-1019.
[17] 田晓莉,杨培珠,何钟佩,等.棉花根冠关系的研究根系伤流液及叶片内源激素的变化[J].中国农业大学学报,1999,4(5):92-97.
[18] 何卫军,焦旭亮,张振文,等.不同干旱胁迫水平下赤霞珠和黑比诺幼苗内源激素水平比较[J].干旱地区农业研究,2008,26(3):142-145.
[19] 赵文魁,童建华,张雪芹,等.干旱胁迫下几种柑桔植物内源激素含量的变化规律[J].农业与技术,2007,27(4):55-59.
[20] 陈立松,刘星辉.水分胁迫对荔枝叶片内源激素含量的影响[J].热带作物学报,1999(9):31-35.
[21] Tawainga K.Tillage and rotation effects on soil physical characteristics [J].Agronomy Journal,2002,94:299-304.
[22] Monneveux P,Belhassen E.The diversity of drought adaptation in the wild[J].Plant Growth Regulation,1996,20:85-92.
