转化生长因子β3对椎间盘退变大鼠软骨终板的作用研究
2014-09-07余作冲熊敏吴靖平张新潮尹望平范卫史继明
余作冲 熊敏 吴靖平 张新潮 尹望平 范卫 史继明
(复旦大学附属金山医院骨科,上海 201508)
椎间盘退变(intervertebral disc degeneration,IVDD)是脊柱退行性疾病发生的病理基础[1]。目前,椎间盘退变的具体机制尚不明确。治疗椎间盘退变的药物或手段较多[2],目前对转化生长因子β(transforming growth factor-β, TGF-β)的研究是热点。TGF-β是一种多肽类细胞因子,具有调节细胞增殖和分化、促进细胞外基质形成和抑制免疫反应等作用。TGF-β3能促进骨髓基质干细胞和软骨的前体细胞向软骨细胞分化,并促进软骨细胞合成软骨基质。因此,TGF-β3具有较强的促进软骨修复的功能。本研究通过在椎间盘退变大鼠的软骨终板中注射TGF-β3,观察软骨终板细胞的凋亡情况,从而探讨TGF-β3在椎间盘退变中的作用。
1 资料与方法
1.1 椎间盘退变大鼠模型的建立 87只新生的SD大鼠为上海西普尔-必凯实验动物有限公司提供的15只预产期为同日的孕鼠的子代,于出生后24~48 h内截去双前肢,3周龄后移走母鼠停止哺乳。此后,根据大鼠的不同生长阶段采用相应的饲养条件,并使其养成只有依靠双后肢站立才能进食和饮水的生活习惯,以此训练大鼠的直立活动,使其发生椎间盘退变[3]。见图1。
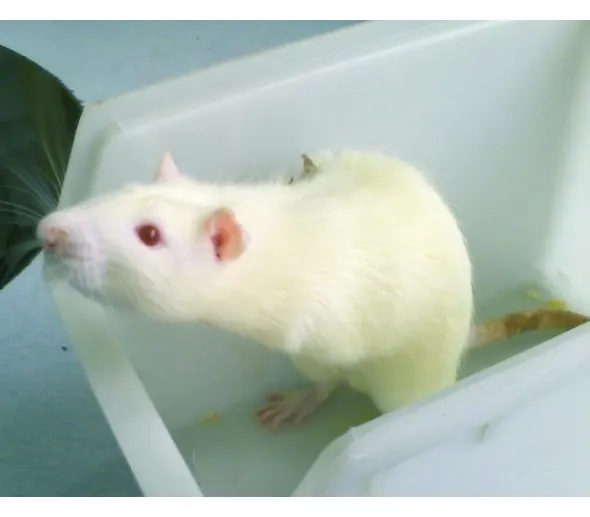
图1 双后肢站立大鼠模型
1.2 模型建立成功与否验证 SD大鼠饲养18个月后,随机选取5只,腹腔内注射戊巴比妥钠后处死,立即取腰段脊柱,剔除周围附着的肌肉等组织,将标本置入中性甲醛固定,然后置于10%乙二胺四乙酸-磷酸缓冲液脱钙,室温放置3周,切片,并用苏木素-伊红(HE)染色,在光学显微镜下观察腰段椎间盘髓核细胞及纤维环细胞形态,如髓核和纤维环退变,即可判断椎间盘退变大鼠模型建立成功(见图2)。
1.3 实验分组及TGF-β3注射 造模成功后,选取存活的SD大鼠中的60只,随机分成对照组、0.9%氯化钠组及TGF-β3组,每组20只。腹腔注射麻醉药物,消毒铺巾,背侧正中旁1.0 cm切开,上提大鼠棘突,肌间隙内分离暴露腰3、4节段椎体侧前方;用20 μ L的微量注射器在0.9%氯化钠液组和TGF-β3组大鼠软骨终板内及周边分别注射TGF-β3(100 ng/mL)和0.9%氯化钠液各160 μ L(上下终板各80 μ L,前、后、左、右各20 μ L),注射后于腰3、4椎体间缝线标记;每周注射1次,连续3次。
1.4 蜡块及切片制备 戊巴比妥钠腹腔内注射后处死60只模型鼠,立即整段截取腰3、4椎体及椎间盘(缝线标记处),剔除周围附着的肌肉等组织;将标本置入中性甲醛中固定24 h,制备蜡块并切片。
1.5 Tunel染色 将切片脱蜡至水,用20 μg/mL蛋白酶K透明处理,室温孵育25 min,3%H2O2甲醇溶液封闭,滴加Tunel染色反应液(设阴性对照组,用PBS替代反应液),漂洗后加底物3,3′-二氨基联苯胺(DAB)显色10 min,苏木素复染,脱水透明、封片(试剂盒由德国MERCK公司提供)。
1.6 细胞计数 200倍光镜下,每张切片中选取阳性细胞较多的数个视野,数500个细胞,计数凋亡细胞个数,以百分数表示细胞凋亡指数(AI)。
2 结 果
对各组软骨终板组织行Tunel染色(见图3)后,计算各组AI。对照组、0.9%氯化钠液组及TGF-β3组的终板软骨细胞AI分别为(26.60±4.98)%、(60.65±5.28)%、(44.25±5.85)%。0.9%氯化钠液组的AI高于对照组(P<0.05);TGF-β3组AI低于0.9%氯化钠液组(P<0.05),但高于对照组(P<0.05)。见图4。
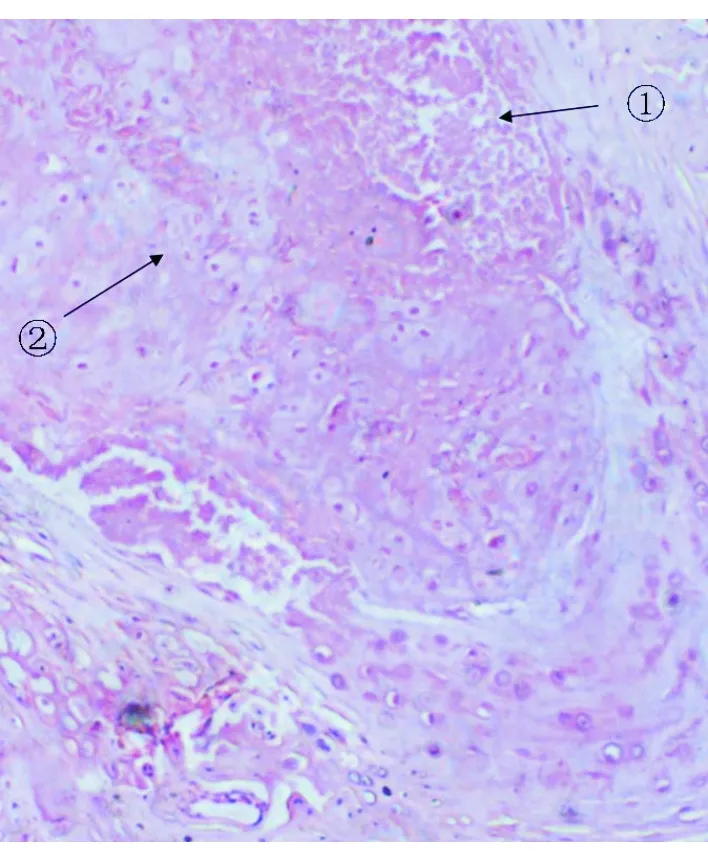
100倍光镜示髓核外形皱缩,体积变小,部分出现裂隙, 局部有片状变性坏死区域(见箭头①),髓核组织中出现大量软骨样细胞(见箭头②)
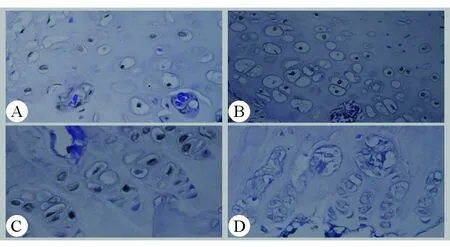
A.对照组凋亡的软骨终板细胞核呈棕褐色改变,散在分布;B.TGF-β3组棕褐色的细胞数较对照组多;C.0.9%氯化钠液组棕褐色的细胞数较TGF-β3组多;D.对照组。
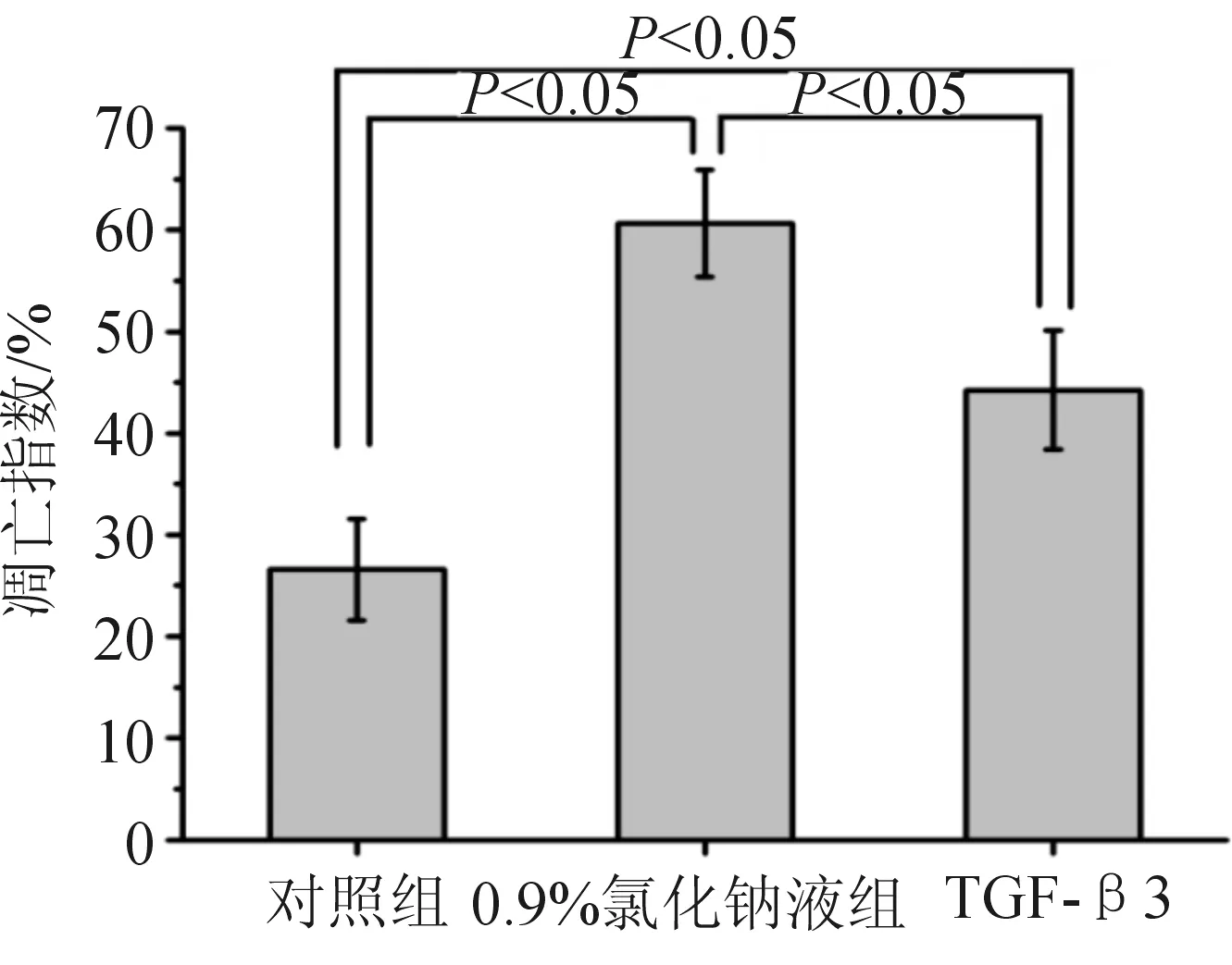
图4 软骨终板细胞的凋亡指数(AI)
3 讨 论
3.1 软骨终板退变对椎间盘退变的影响 椎间盘是由终板、髓核及纤维环三部分组成,纤维环包绕胶冻样髓核,二者上下方为软骨终板。软骨终板是是承担身体重力负荷的重要结构及髓核的主要营养来源,其硬化、钙化或增厚均可影响椎间盘的结构及营养物质的代谢,从而引发椎间盘退变[4]。软骨终板细胞是软骨细胞的一种,其表型与关节软骨细胞类似,均可表达Ⅱ型胶原及蛋白多糖[5]。
3.2 针刺创伤对软骨终板退变的影响 有研究[6]用针刺方法建立鼠椎间盘退变模型,发现大号针头可导致椎间盘高度丢失,髓核黏多糖减少,髓核胶原增加 。本研究中0.9%氯化钠液组和TGF-β3组软骨终板细胞AI较对照组高,这可能与针刺创伤可促进软骨终板的退变有关。
3.3 细胞调亡在椎间盘软骨终板退变中的作用 细胞凋亡可能参与椎间盘组织退变的病理生理过程,是退变椎间盘组织中细胞数量减少的主要原因[7]。其机制之一是:软骨终板细胞凋亡使椎间盘内Ⅱ型胶原蛋白生成减少,导致椎间盘退变[8]。本研究对造模成功大鼠的软骨终板组织行Tunel染色,镜下可见对照组有散在的终板凋亡细胞,证实了上述结论。
3.4 TGF-β3对椎间盘软骨终板细胞凋亡的抑制作用 研究[9]表明,TGF-β3具有很强的促进软骨生长及分化的作用。Bouffi等[10]的研究发现,TGF-β3能够诱导骨髓间充质干细胞(BMSCs)向软骨细胞分化。TGF-β3还可以通过调节TGF-β1/β2比例,抑制成纤维细胞的增殖,抑制组织纤维化的发生[11]。有研究[12]认为,TGF-β3能有效地促进软骨细胞分泌软骨基质等。
3.5 本研究的不足 TGF-β3在体内降解较快,如何延长TGF-β3体内作用时间是我们今后工作的重点。针刺创伤因素可能会加重椎间盘退变,在临床治疗中是否可以通过靶向给药避免此类创伤?需要我们进一步探索。
[1]黄宗强,刘尚礼,郑召民,等.椎间盘退变的分子生物学研究进展[J].中国矫形外科杂志, 2003, 11(1): 55-56.
[2]Kim KW, Lim TH, Kim JG, et al.The origin of chondrocytes in the nucleus pulposus and histologic findings associated with the transition of a notochordal nucleus pulposus to a fibrocartilaginous nucleus pulposus in intact rabbit inter-vertebral discs[J].Spine,2003,28(10):982-990.
[3]吴靖平,陈统一,陈中伟,等.双后肢大鼠椎间盘退变动物模型的建立[J].中华实验外科杂志, 2004, 21(1):105-107.
[4] Ariga K, Miyamoto S, Nakase T, et al.The relationship between apoptosis of endplate chondrocytes and aging and degeneration of the intervertebral disc [J].Spine, 2001, 26 (22) : 2414-2420.
[5]叶伟, 黄东生, 梁安靖,等.TNF -α对兔软骨终板细胞增殖、凋亡及基质形成的影响[J].中国病理生理学杂志.2008, 24 (9):1830-1834.
[6]Martin JT, Gorth DJ, Beattie EE, Harfe BD, Smith LJ, Elliott DM.Needle Puncture Injury Causes Acute and Long-Term Mechanical Deficiency in a Mouse Model of Intervertebral Disc Degeneration[J].J Orthop Res, 2013 Apr 1:0.doi: 10.1002/jor.22355.
[7]lotz JG, Chin JR.Intervertebral disc cell death is dependent on the magnitude and duration of spinal loading[J].Spine, 2000, 25(12): 1477-1483.
[8]Xu HG,Chen XW,Wang H,et al.Correlation between chondrocyte apoptosis of vertebral cartilage endplate and degeneration of intervertebral disc[J].Zhonghua Yi Xue Za Zhi, 2008,88(3):194-197.
[9]Lee CH, Cook JL, Mendelson A, et al.Regeneration of the articular surface of the rabbit synovial joint by cell homing: a proof of concept study[J].Lancet, 2010,376(9739):440-448.
[10]Bouffi C,Thomas O, Bony C, et al.The role of pharmacologically active microcarriers releasing TGF-b3 in cartilage formation in vivo by mesenchymal stem cells[J].Biomaterials, 2010, 31(25):6485-6493.
[11]Na K, Kim S, Woo DG, et al.Synergistic effect of TGF beta-3 on chondrogenic differentiation of rabbit chondrocytes in thermo reversible hydrogel constructs blended with hyaluronic acid by in vivo test[J].J Biotechnol , 2007, 128(2):412-422.
[12]Qureshi HY, Sylvester J, Mabrouk ME, et al.TGF-beta-induced expression of tissue inhibitor of metalloproteinascs-3 gene in chondrocytes is mediated by extracellular signal-regulated kinase pathway and Sp1 transcription lactor[J].J Cell Physiol.2005, 203(2):345-352.
