印记基因SLC22A18的表达与乳腺癌侵袭能力的关系
2014-09-07贺黉裕张宏伟
贺黉裕 张宏伟
(复旦大学附属中山医院 a重症监护室,b普外科,上海 200032)
SLC22A18(solute carrier family 22, member 18)是位于人类染色体11p15.5的父源印记基因,与细胞的代谢和生长有关[1]。SLC22A18的表达异常与胚胎性肿瘤及多种实体肿瘤(如肺癌、肝癌等)相关。多项研究[2-4]发现,乳腺癌中SLC22A18表达异常,SLC22A18可能作为抑癌基因影响乳腺癌的侵袭转移。本研究检测了SLC22A18在2种乳腺癌细胞株MDA-MB-231(恶性程度高)和MCF-7(恶性程度低)中的表达水平,并采用Transwell法研究这2种乳腺癌细胞株侵袭转移能力的差异。
1 资料与方法
1.1 主要试剂 兔抗人SLC22A18抗体购自美国Proteintech Group公司,Transwell小室(滤膜孔径:8.0 μm)购自美国Corning公司,Matrigel胶购自美国BD公司,RPMI-1640 培养基、10%胎牛血清(fetal bovine serum,FBS)、L15培养基购自美国Gibco公司,Giemsa染色液购自江苏省南京建成公司。
1.2 主要实验设备 PCR仪购自美国ABI公司,光学显微镜及摄像系统购自德国Leica公司。
1.3 细胞来源与培养 人乳腺癌细胞株MDA-MB-231和MCF-7均购于中国科学院上海分院。MDA-MB-231细胞株用含10% FBS的L15培养基培养,MCF-7细胞株培养用含10% FBS的RPMI-1640培养基培养,2种细胞的培养条件均为37 ℃、5%CO2以及饱和湿度。每1~2 d传代。
1.4 Transwell过程 预先准备4 ℃预冷的枪头、EP管、Transwell小室和24孔板,实验过程在冰上完成;将50 mg/L Matrigel与无血清培养液按1∶8体积混匀,用以包被Transwell小室底部膜的上室面,24孔板每孔用量为50 μL; 37 ℃放置约1 h ,使Matrigel聚合成凝胶;接种细胞, 培养60 h后观察结果;计数6个视野(200×),取平均值。
1.5 检测2种细胞株中SLC22A18的 mRNA和蛋白的表达情况 采用实时荧光定量逆转录聚合酶链反应(real-time fluorescence quantitative reverse transcriptase-polymerase chain reaction,RT-PCR)检测2种细胞株中SLC22A18 mRNA的表达情况:根据样品Ct值计算出MDA-MB-231细胞株和MCF-7细胞株中SLC22A18 mRNA的表达量。采用Western blotting法检测2种细胞株中SLC22A18蛋白的表达情况。
1.6 统计学处理 采用SPSS 16.0统计软件进行统计学处理,SLC22A18 的mRNA和蛋白的表达水平的比较采用t检验,Transwell结果的比较采用秩和检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 Transwell结果 MDA-MB-231和MCF-7细胞穿过Matrigel胶的细胞染色结果见图1,穿过Matrigel胶的MDA-MB-231细胞Giemsa染色呈蓝紫色、梭形;穿过Matrigel胶的MCF-7细胞Giemsa染色呈紫红色、圆形。MDA-MB-231和MCF-7穿过Matirgel胶的平均细胞数分别为59.333个和20.000个;2组数据样本呈偏态分布,秩和检验结果显示差异有统计学意义(P<0.01)。由此表明,MDA-MB-231和MCF-7的侵袭能力有差异,恶性程度高的MDA-MB-231细胞株侵袭能力强,恶性程度低的MCF-7细胞株侵袭能力弱。见图1。
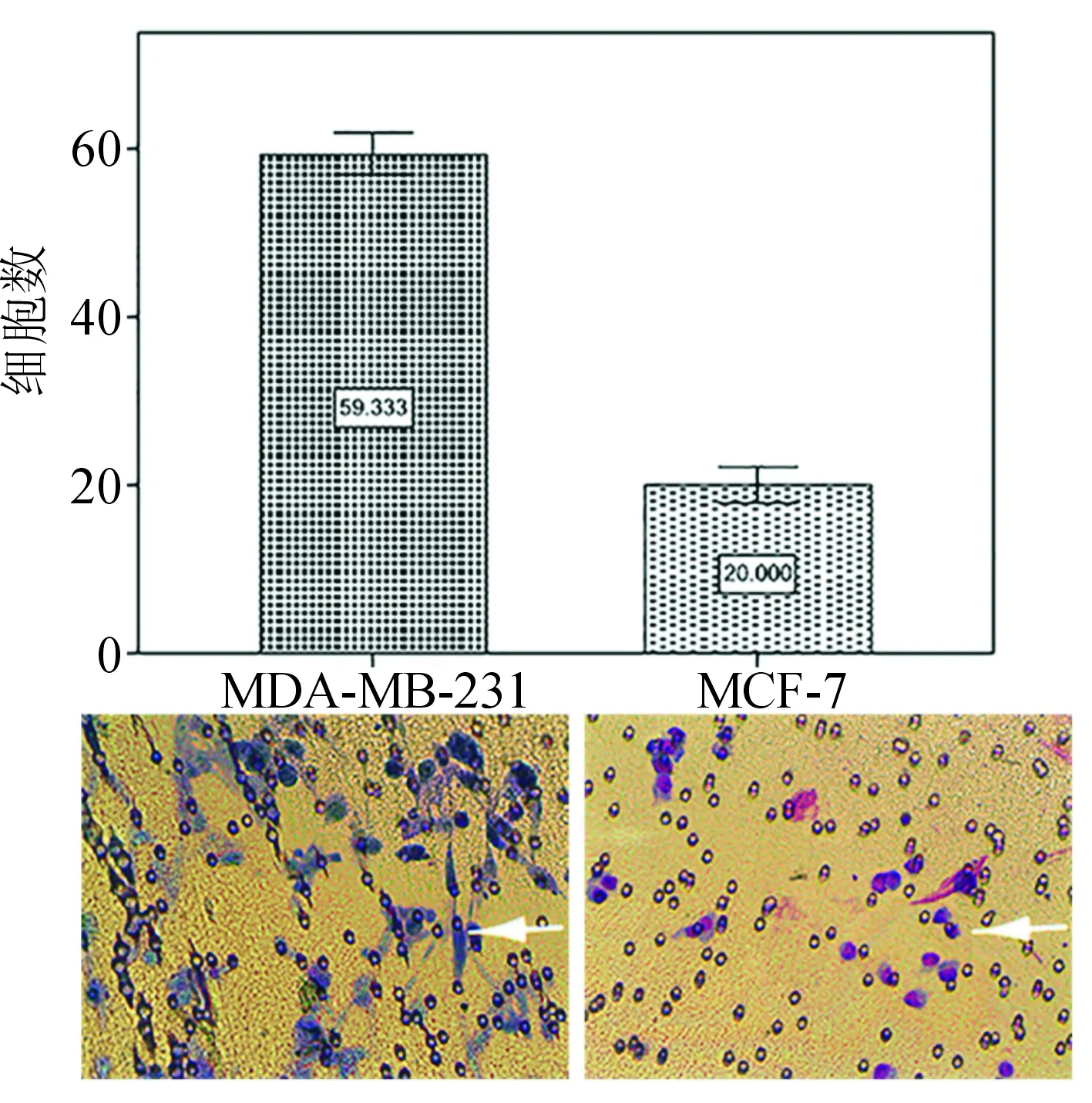
图1乳腺癌细胞株穿过Matrigel胶的细胞染色结果(×200),白色箭头为已穿透膜的细胞
2.2 SLC22A18的 mRNA和蛋白的表达 恶性程度高的MDA-MB-231细胞株中SLC22A18 的mRNA和蛋白表达水平较低,恶性程度低的MCF-7细胞株中SLC22A18 的mRNA和蛋白表达水平较高,差异有统计学意义(P<0.01)。见图2。
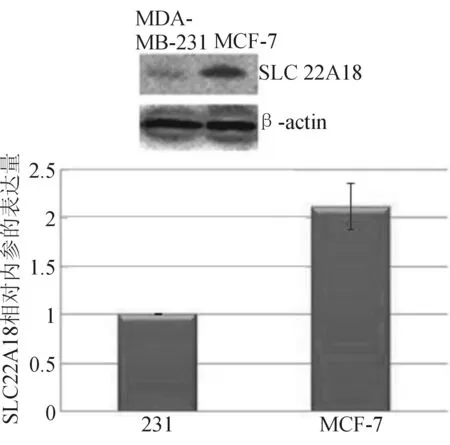
图2乳腺癌细胞株SLC22A18mRNA和蛋白质表达
3 讨 论
据统计,在全球范围内,每年有120万乳腺癌新发病例,危及10%~12%的女性人群,每年有50万女性死于乳腺癌[5]。乳腺癌严重威胁妇女的健康,是女性因肿瘤导致死亡的首要原因,而乳腺癌的侵袭转移则是导致患者死亡的首要原因。
以往关于肿瘤的的分子生物学研究多集中于基因的突变、序列的改变。然而,基因的表达除取决于DNA序列信息外,还取决于DNA甲基化、基因组印记等不涉及DNA序列的可遗传的表达调控方式,这是目前医学研究的热点。
基因组印记是指特定亲本的等位基因或其所在染色体在配子或受精卵中发生表观遗传学修饰,结果导致该基因的2个等位基因在其后代的子细胞中表达程度不同。基因组印记决定了性状的遗传不遵循孟德尔定律,而表现为单亲依赖性遗传。基因组印记在进化论意义上可能有防止单性生殖、维持遗传多样性的优势,但也增加了隐性突变转为显性的危险性。由于印记基因相当于功能上的单倍体,单次突变就可使该基因失活,故可能导致疾病或肿瘤[6-7]。
印记基因导致肿瘤的机制主要有以下几方面[8]:(1)印记获得。原本双表达的基因中有1个等位基因异常沉默,从而获得了印记的特征,相当于功能上的单倍体,在某种程度上与杂合性缺失和单亲二倍体相似,使罹患肿瘤的风险增加;(2) 失印记。促生长基因或癌基因的2个等位基因中的1个被印记沉寂,另1个正常表达,若印记的等位基因发生印记丢失(loss of imprinting,LOI),导致双等位基因表达,基因产物成倍增加,从而参与肿瘤的发生。如启动肿瘤细胞生长的印记基因发生LOI,被印记的等位基因重新激活,可导致该基因过度表达,利于肿瘤生长。
SLC22A18,或称TSSC5/IMPT1/BWR1A/ORCTL2,是位于人类染色体11p15.5的父源印记基因,与药物敏感性、细胞代谢和生长有关[1]。SLC22A18蛋白水平可能受泛素-蛋白酶体途径调节[9]。SLC22A18亦是成人肺肿瘤抑制基因和胎儿肾印记性肿瘤抑制基因[10]。研究[2-4]发现,人乳腺癌细胞中存在SLC22A18基因的突变,肝癌、乳腺癌中存在SLC22A18基因的印记获得。
本研究发现,恶性程度较高的乳腺癌细胞株MDA-MB-231侵袭能力强,细胞中SLC22A18表达量较少;恶性程度低的乳腺癌细胞株MCF-7侵袭能力弱,细胞中SLC22A18表达量较多;这说明,印记基因SLC22A18有可能作为抑癌基因影响乳腺癌的侵袭转移。SLC22A18在乳腺癌中表达下调的机制可能与基因发生突变或印记获得有关。
综上所述,SLC22A18的 mRNA和蛋白水平在恶性程度不同的乳腺癌细胞株MDA-MB-231和MCF-7中的差异有统计学意义。SLC22A18与乳腺癌细胞的侵袭能力有关,可能作为抑癌基因影响乳腺癌的侵袭转移。
[1]Dao D,Frank D, Qian N, et al.IMPT1,an imprinted gene similar to polyspecific transporter and multi-drug resistance genes[J].Hum Mol Genet,1998, 7(4):597-608.
[2]McPherson K, Steel CM, Dixon JM.ABC of breast diseases.Breast cancer-epidemiology, risk factors, and genetics [J].BMJ,2000, 321(7261):624-628.
[3]Schwienbacher C, Gramantieri L, Scelfo R, et al.Gain of imprinting at chromosome 11p15:A pathogenetic mechanism identified in human hepatocarcinomas [J].Proc Natl Acad Sci U S A,2000,97(10):5445-5449.
[4]Gallagher E, Mc Goldrick A, Chung WY, et al.Gain of imprinting of SLC22A18 sense and antisense transcripts in human breast cancer[J].Genomics,2006,88(1):12-17.
[5]Benson JR, Jatoi I, Keisch M, et al.Early breast cancer [J].Lancet, 2009, 373(9673):1463-1479.
[6]Barton SC, Surani MA, Norris ML.Role of paternal and maternal genomes in mouse development [J].Nature, 1984, 311(5984):374-376.
[7]Reik W, Dean W,Walter J.Epigenetic reprogramming in mammalian development[J].Science,2001,293(5532):1089-1093.
[8]Vogelstein B, Kinzler KW.The genetic basis of human cancer [M].New York: McGraw Hill, 1998: 95-107.
[9]Yamada HY, Gorbsky GJ.Tumor suppressor candidate TSSC5 is regulated by UbcH6 and a novel ubiquitin ligase RING105 [J].Oncogene, 2006, 25(9):1330-1339.
[10]Lee MP, Brandenburg S, Landes GM, et al.Two novel genes in the center of the 11p15 imprinted domain escape genomic imprinting [J].Hum Mol Genet,1999, 8(4):683-690.
