瑞芬太尼预处理对体外循环患者血管内皮细胞保护作用的研究
2014-09-04汤和青柯齐斌
陈 春,侯 炜,林 雷,杨 鹏,侯 俊,汤和青,方 为,柯齐斌
(1. 武汉大学基础医学院 医学病毒研究所,湖北 武汉,430071;2. 宜昌市中心人民医院 麻醉科,湖北 宜昌,443003)
体外循环中血液与体外循环机装置的接触、温度变化,血流方式改变(非搏动性灌注),血液中各种血细胞成分的激活和组织缺血/再灌注损伤过程均可导致内皮细胞的激活或损伤,并有学者认为内皮细胞激活或损伤是体外循环致全身炎症反应和多系统脏器功能损伤的重要环节[1]。血管内皮细胞(VEs)被认为是心血管疾病发生的始动因素[2],VEs从组织血管表面脱落至外周血液中,成为循环内皮细胞(CECs)。CECs是目前活体内可以特异地、直接地反映血管损伤的指标。减轻体外循环对内皮细胞的损伤,是促进体外循环后患者近期恢复和提高远期疗效的关键。瑞芬太尼与其他阿片受体激动剂的不同点在于其N酞基端存在酯键,使其更易被酯酶分解,代谢基本不受血浆胆碱酯酶和抗胆碱酯酶药物的影响,药物作用的消退主要是由于药物的快速清除而不是再分布所致,因此不会发生诸如芬太尼、阿芬太尼、舒芬太尼等较长时间静脉输注后产生的药物蓄积问题。瑞芬太尼作为镇痛型阿片为基础的麻醉将成为新的趋势,目前有关瑞芬太尼预处理对内皮细胞损伤的影响尚未见研究报道。
1 资料与方法
1.1 研究对象与分组方法
经三峡大学第一临床医学院伦理委员会批准,选择医院2010年8月—2012年8月择期在体外循环下行二尖瓣置换术患者40例,美国麻醉师协会(ASA)分级Ⅰ~Ⅱ,年龄37~62岁。患有恶性肿瘤、肝肾功能障碍、服用免疫抑制剂、细胞毒性药物、激素替代治疗的患者除外。患者在术前1周停用阿司匹林及华法林,无使用肝素者。将患者随机分组,分别于术中接受瑞芬太尼预处理组(Ⅰ组)和对照组(Ⅱ组)。患者均签署知情同意书,手术由心胸外科同一主任医师主刀完成。
1.2 麻醉及手术
在全麻低温心肺转流下手术。手术患者的麻醉诱导采用咪唑安定0.05 mg/kg,芬太尼0.01 mg/kg,依托咪酯0.3 mg/kg,维库溴铵0.15 mg/kg,术中持续输注芬太尼、丙泊酚和维库溴胺维持麻醉。Ⅰ组在CPB前4 μg/(kg·min)的速率静脉输注瑞芬太尼5 min,间隔5 min后重复给药,共3次;Ⅱ组输注等容量的生理盐水。所有患者均采用STOCKERT-Ⅲ型心肺转流机,西京膜式氧合器,无血预充,4∶1氧合血冷晶体停搏液间断灌注。体外循环(CPB)过程中所有患者肝素用量为3 mg/kg,预充液中10 mg/L,激活凝血时间(ACT)维持在480~600 s,转流完毕用鱼精蛋白中和体内残余肝素,比例为1∶1。
1.3 标本采集及检测
所有入选患者均于在CPB前(T1),CPB 30 min(T2),体外循环停机后0 h(T3)、6 h(T4),24 h(T5),72 h(T6)各采集中心静脉血5 mL。采用免疫磁珠法分离和计数循环内皮细胞,检测外周循环血内皮细胞数量的变化。生物试剂采用抗鼠IgG磁珠(Dynal M-450,Norway)和鼠抗人CD146单克隆抗体(Biocytex,Marseilles,France); 按厂家说明在磁架上进行磁珠清洗、重悬磁珠以及与抗CD146单克隆抗体混合,最终使用PBS/BSA将其终浓度为1.4×108个磁珠/mL。取1 mL全血,加入20 μL清洗过的抗-CD146磁珠抗体,4 ℃旋转轻摇孵育30 min。加入等体积的缓冲液,置于磁架上2 min,吸弃液体后剩下磁珠结合的细胞,按说明重复洗涤4次,再用100 μL缓冲液重悬磁珠结合的细胞,用吖啶橙染色,在倒置相差荧光显微镜下计数。另取3.6 mL中心静脉血,加入含有0.4 mL枸橼酸钠的塑料试管中混匀,4 ℃ 3 000 r/min离心10 min,吸取上层血浆储存于-20 ℃待测。vWF、TM采用双抗夹心法(ELISA法),操作按说明书进行。同时测定各时间点的Hct。NO试剂盒利用硝酸还原酶将特异性将NO3-还原为NO2-,用分光光度计测定其浓度。ET-1试剂盒用γ放射免疫计数器测内皮素含量。CPB期间血液稀释对测定值的影响用以下公式校正:校正值=测定值×转流前Hct/测定时Hct。
2 结 果
2.1 一般情况
本实验2组患者未出现各种原因退出实验的情况,术后无1例手术死亡。2组患者年龄、性别、体质量、主动脉阻断时间均无显著差异,见表1。

表1
2.2 CECs的测定
2组患者在CPB前比较,CECs无显著差异,但在T3、T4、T5、T6,Ⅱ组CECs数量明显高于Ⅰ组(P<0.05),见表2。

表2 围术期循环内皮细胞数量 cells/μL
2.3 TM、vWF比较
与术前比较,2组变化趋势一致,TM、vWF在CPB开始后30 min时已显著升高,至CPB结束时达到峰值,而后有下降趋势,直至停CPB后72 h恢复到CPB前水平。2组间比较,在CPB结束后的T3、T4、T5时间点,Ⅰ组的TM 、vWF浓度均较Ⅱ组低,差异有统计学意义(P<0.05)。见表3。

表3 2组患者不同时间点TM 、vWF检测结果
2.4 NO、ET-1比较
随着CPB开始,两组患者ET-1浓度显著升高,到CPB停机后的72 h恢复到术前水平。2组间比较,Ⅰ组ET-1浓度在T2、T3、T4、T5均较Ⅱ组低,差异有统计学意义(P<0.05)。NO的血浆浓度仅在Ⅱ组T3、T4两个时间点较CPB前有所降低,后又恢复正常。组间比较中,Ⅰ组NO浓度在T4、T5两个时间点明显高于Ⅱ组,差异有统计学意义(P<0.05)。见表4。
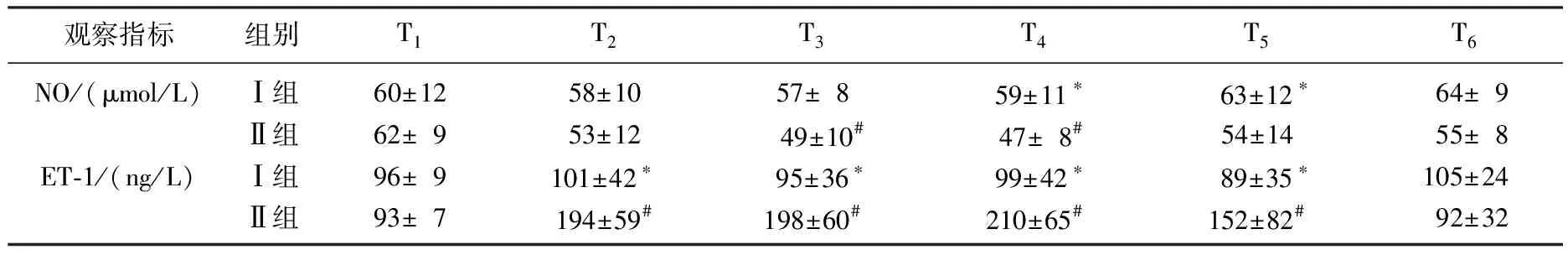
表4 2组患者不同时间点NO、ET-1检测结果
3 讨 论
3.1 CPB对内皮细胞的损害
内皮细胞在血液和组织表面是非常活跃,在正常血液分布、凝血、炎症反应和损伤方面具有决定性的作用[3]。体外循环中温度变化,血流方式改变,血液中各种血细胞成分的激活和组织缺血/再灌注损伤过程均可导致内皮细胞的激活或损伤。血栓调节蛋白(TM)是细胞表面的凝血酶受体,主要表达于血管内皮细胞的膜表面,当机体VEC损伤时,TM从VEC表面脱落入血,引起血浆TM水平的升高。因此,血浆TM的浓度增加是VEC损伤的可靠指标。VEC上的TM是维持血管表面抗凝特性的重要成分,由于CPB致VEC上的TM脱落入血,血管表面抗凝功能下降,导致凝血,消耗凝血因子。内皮细胞是血管性假血友病因子(vWF)的主要来源[4]。vWF的主要功能是促进血小板与血管壁的黏附,从而促进血栓的形成。在CPB中,当CPB所致的VEC损伤/活化,使vWF大量释放,与活化面的血小板表面vWF结合位点结合,使大量血小板相互黏附沉积于CPB管道、损伤的管壁中,导致血小板消耗。血中vWF水平可以反映血管内皮细胞激活或损伤的程度[5]。
3.2 瑞芬太尼预处理与VEC
阿片类受体种类很多,而分布于心血管系统的主要是μ、δ和κ三种受体,人体血管壁上主要是κ和μ受体占优势。瑞芬太尼是一种高度选择性μ受体激动剂,但同时对κ和δ受体也具有轻微的亲和力。国内外研究表明,瑞芬太尼预处理对体外循环期间的心肺脑等重要器官的缺血-再灌注损伤均有保护作用。本研究以生理盐水作为对照组,瑞芬太尼作为实验组发现,在体外循环结束的72 h内,实验组的CECs数目减少,反映血管内皮细胞自组织血管表面脱落进入外周血液中的较少,间接证实了实验组血管内皮细胞受损程度较对照组轻。CPB结束后的各时间点试验组TM 、vWF浓度均较对照组低,直至停CPB后72 h恢复到CPB前水平。TM 、vWF浓度的升高反映VEC受损程度的指标,更进一步证实了瑞芬太尼预处理对血管内皮细胞的保护作用。两个观察指标结果均在CPB开始后升高,CPB结束达到高峰,随着时间的推移后逐渐降低。两指标在时间点上的同步性,更进一步从侧面证实了两个指标反映VEC受损的一定程度的可行性和准确性。Hofbauer等经体外实验证实瑞芬太尼能够抑制中性粒细胞经单层内皮细胞移位、中性粒细胞与内皮细胞黏附以及细胞黏附分子-1(ICAM-1)在内皮细胞表达[6]。而且瑞芬太尼既可通过刺激血管内皮细胞释放一氧化氮(NO)和前列环素(PGI2)来舒张血管,又可通过抑制电压敏感性钙离子通道产生非内皮细胞依赖性血管舒张作用[7-10]。这些都可能是瑞芬太尼预处理体内发挥内皮细胞保护的作用机制。
3.3 CPB致VEC分泌NO、ET-1平衡失调
ET是目前所知的最强的缩血管物质。正常VEC表达内皮细胞型NO合酶(eNOS),其合成和释放的NO通过激活血管平滑肌细胞GTP转变为cGMP,发挥强有力的松弛血管效应。VEC损伤/活化可下调eNOS的基因表达,使NO合成减少[11],而CPB所致的炎症递质和内毒素可导致NO的释放增加。本研究证实瑞芬太尼预处理能够明显减少缩血管物质ET-1的产生,仅在T4、T5两个时间点明显增加NO舒张血管物质。这可能是该时间点内毒素和炎症介质表达达到高峰所致,也可能与eNOS表达下调和iNOS的激活不平衡有关。在CPB手术中,阻断升主动脉将不可避免出现缺血-再灌注损伤,推测在复跳后早期可能存在VEC损伤所致的NO合成和分泌下降的情况。本实验Ⅰ组NO浓度变化不明显,可能是存在瑞芬太尼预处理增加NO的合成所代偿。
[1] 顾春虎,王云雅,易定华,等. 体外循环对血管内皮细胞的急性损伤[J].心脏杂志,2007,19(1): 82.
[2] Lee H Z,Yeh F T,Wu CH. The effect of elevated extracellular glucose on adherens junction proteins in cultured rat heart endothelial cells[J]. Life Sci,2004,74(17): 2085.
[3] Santiago-Delpin E A. The Endothelium and Early Immune Activation:New Perspective and Interaction[J]. Transplant Proc,2004,36(6): 1709.
[4] Richards A M,Troughton R,Lainchbury J,et al. Guiding and monitoring of heart failure therapy with NT-ProBNP: concepts and clinical studies[J]. Card Fail,2005,11(5 Suppl): S34.
[5] 孙静,钱安斌. 小剂量倍他乐克治疗充血性心力衰竭对血浆BNP水平的影响[J]. 心脏杂志,2005,17(2): 140.
[6] Hofbauer R,Frass M,Gmeiner B,et al. Effects of remifentanil on neutrophil adhesion,transmigration,and intercellular adhesion molecule expression[J]. Acta Anaesthesiol Scand,2000,44: 1232.
[7] Duman A,Saide Sahin A,Esra Atalik K,et al. The in vitro effects of remifentanil and fentanyl on isolated human right atria and saphenous veins[J]. Cardiothorae Vase Anesth,2003,17: 465.
[8] Unlugeng H,Itegin M,Oeall,et al. Remifentanil produees vasorelaxation in isolated rat thoracic aorta strips[J]. Acta Anaesthesiol Scand,2003,47: 65.
[9] Unleqen H,Emre M,Demir C,et al. Remifentanil-induced mechanical responses and membrane potential changes in human umbilical arteries[J]. Acta Anesthesiol scand,2007,51(2): 244.
[10] Gursory S,Baqvivanl,Yildirim M K,et al. Vasorelaxant effect of opioid analgesics on the isolated human radial artery[J]. Eur Anaesthesiol,2006,23(6): 496.
[11] Boyle E M,Verrier E D,Spiess B D. Endothelial cell injury in cardiovascular surgery: the procoagulant response[J]. Ann Thorac Surg,1996,62(5): 1594.
