同时性结直肠癌肝转移患者的生存分析
2014-09-03朱德祥林奇钟芸诗韦烨任黎许剑民秦新裕
朱德祥 林奇 钟芸诗 韦烨 任黎 许剑民 秦新裕
同时性肝转移是指结直肠癌确诊时发现的或原发灶根治性切除术后6月内发生的肝转移,发生率达15~20%[1],是结直肠癌患者最主要的死亡原因之一[2]。2010年中国结直肠癌肝转移诊断和综合治疗指南中对同时性肝转移的治疗给出了一些全新的指导意见[3]:如I期切除肝转移灶和原发灶、新辅助化疗等。本文回顾性分析了复旦大学附属中山医院2000-2010年收治的同时性结直肠癌肝转移患者1 061例,以评估“指南”中相关指导意见的临床应用价值。
资料与方法
一、一般资料
选取2000年1月至2010年12月复旦大学附属中山医院收治的同时性结直肠癌肝转移患者1061例,其中男性691例(65.1%),女性370例(34.9%),中位年龄60(17~90)岁。
按肝转移灶最终治疗策略将患者分为以下几组:(1)手术组:301例(28.4%),包括直接手术(228例)、新辅助治疗后手术(35例)和最初不可切除经转化性治疗后手术(38例),术后接受辅助化疗,化疗方案包括5-氟脲嘧啶/亚叶酸钙+奥沙利铂(FOLFOX)、5-氟脲嘧啶/亚叶酸钙+依立替康(FOLFIRI)、或卡培他滨+奥沙利铂(XELOX),+/-靶向药物。(2)全身化疗组:102例(9.6%),指患者仅使用FOLFOX、FOLFIRI、或XELOX,+/-靶向药物进行全身化疗。(3)介入组:300例(28.3%),指患者仅采用经肝动脉碘油栓塞加化疗药物灌注(5-氟脲嘧啶+奥沙利铂)。(4)全身化疗+介入组:161例(15.2%),指患者经肝动脉碘油栓塞加化疗药物灌注,联合全身化疗。(5)局部治疗组:106例(10.0%),包括射频消融、无水酒精注射(PEI)或冰冻处理肝转移灶。(6)其他组:91例(8.6%),包括中医中药、无处理等。
二、随访
所有患者资料均登记收入中山医院结直肠癌数据库,由专业人员负责随访,每年随访1次,采用门诊、电话,结合书信形式,记录患者所有的治疗经过和生存状况。中位随访时间31.4个月。
三、统计学方法
应用SPSS 16.0统计软件进行分析,计数资料的比较采用χ2检验,计量资料的比较采用t检验。存活率采用寿命表法进行推算,存活率用Kaplan-Meier法绘制生存曲线,并采用Log-Rank法进行比较,多因素分析用Cox比例风险回归模型。P<0.050为差异有统计学意义。
结 果
一、临床特征
1061例患者中,直肠癌357例(33.6%),乙状结肠癌239例(22.5%),降结肠和脾曲癌83例(7.8%),横结肠癌46例(4.4%),盲升结肠和肝曲癌336例(31.7%)。肝转移灶仅累及左叶107例(10.1%),仅累及右叶330例(31.1%),而累及双侧肝叶624例(58.8%)。肝转移灶个数为1个的286例(27.0%)、2个的62例(5.8%)、3个的21例(2.0%)、4个及以上的692例(65.2%)。最大肝转移病灶直径的平均值为4.75 cm。治疗前中位血清CEA水平为39.94 ng/ml,治疗前中位血清CA19-9水平为116.4 U/ml。
二、不同肝转移灶手术指征与预后关系
2000年至2004年间肝转移灶切除适应症:肝转移累及单叶;肝转移灶<4个;肝转移灶最大直径<5 cm;肝转移灶手术切缘>1 cm。这期间共收治同时性肝转移患者160例,总体中位生存期为16.0月,5年存活率8%,肝转移灶手术切除率13.8%(22/160)。
2005至2010年扩大肝转移灶切除适应症:结直肠癌原发灶能够根治性切除;根据肝脏解剖学基础和病灶范围肝转移灶可完全(R0)切除,且要求保留足够的肝脏功能,肝脏残留容积≥30%~50%;患者全身状况允许,并没有不可切除的肝外转移病变。这期间共收治同时性肝转移患者901例,总体中位生存期为23.6月,5年存活率为27%,肝转移灶手术切除率为31.0%(279/901)。这期间患者的生存状况,比2000年至2004年期间收治患者的生存状况有明显改善(P<0.001)。
虽然肝转移灶手术患者比例在扩大手术适应症后明显升高,但是这些患者的生存无显著差异(43.8月 vs.56.1月,41% vs.49%,P>0.05)。而肝转移灶非手术患者的生存较前明显改善(13.9月 vs.19.1月,2% vs.17%,P=0.001)。
三、结直肠癌原发和肝转移灶同期和分阶段切除生存分析
同时性肝转移组中行结直肠癌原发和肝转移灶同期切除患者151例,分期切除83例,两组患者的年龄、性别、肿瘤原发灶分布和肝转移灶情况等无明显差别(见表1)。同期切除患者的平均住院费用较分期切除患者的费用降低约25%(25693元vs.34129元,P<0.050)。两组手术患者围手术期病死率(2.0% vs.2.4%)和并发症发生率(24.5% vs.20.5%)差异均无统计学意义。这两组患者的长期生存状况也没有明显差异,中位总生存期分别为48.5和47.0个月(P>0.050),5年存活率分别为44%和49%(P>0.050)。
四、肝转移灶无法切除患者,原发灶处理情况与预后的关系
肝转移灶无法切除患者共有681例,其中原发灶接受手术的患者529例,原发灶未切除的患者152例, 总体中位生存时间分别为19.0月和9.3月,1年存活率分别为70%和36%,3年存活率分别为15%和3%(P<0.001,图1)。
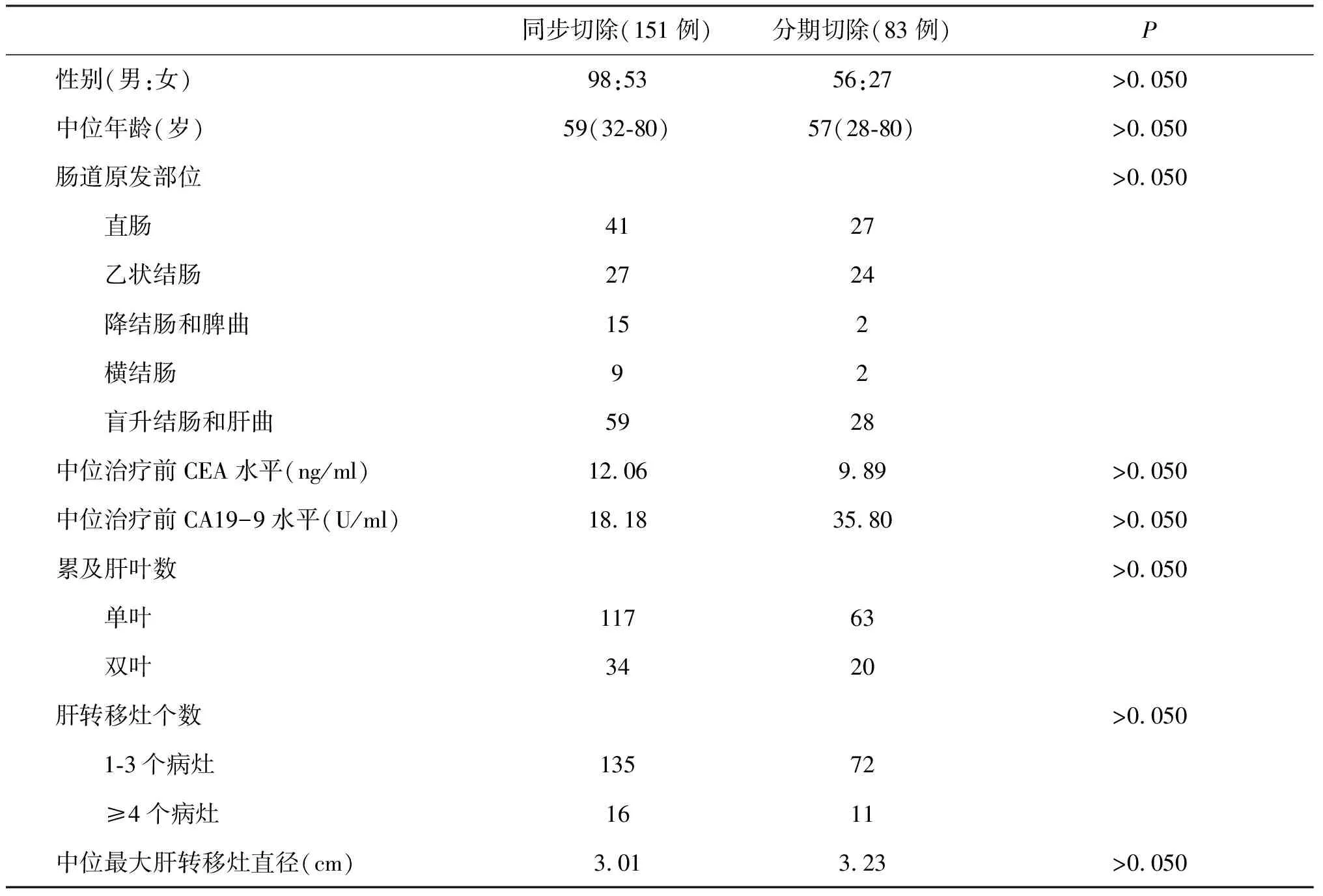
表1 结直肠癌原发灶和肝转移灶行同期和分期切除患者的临床信息情况表

图1 肝转移灶不可切除患者原发灶是否手术切除与预后关系曲线图
五、肝转移灶不同治疗策略与预后关系
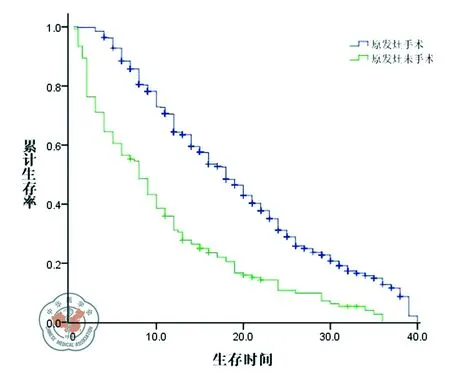
图2 肝转移灶不同治疗策略与预后关系曲线图
1061例同时性结直肠癌肝转移患者的总体中位生存期为21.2月,5年存活率19%。其中手术组患者的中位生存期为47.3月,5年存活率46%,显著优于全身化疗组(21.6月和18%)、介入组(17.7月和9%)、全身化疗+介入组(23.3月和13%)和局部治疗组患者(26.6月和0%)(P<0.001)。其他治疗组患者中位生存期和5年存活率(9.7月和0%)显著低于上述各组。此外,全身化疗+介入组患者的生存情况显著优于单纯介入组患者(P=0.001,图2)。
六、结直肠癌肝转移临床病理特征与预后的关系
将所有患者按照性别、年龄、肠道原发灶的病理分化程度、浸润深度、淋巴结转移情况、肝转移灶累及叶数、肝转移灶数目、最大肝转移灶直径、有无肝外转移、诊断肝转移时血清CEA水平、肠道原发灶是否手术、肝转移灶不同治疗策略等因素先做单因素分析。结果发现肠道原发灶分化Ⅲ-Ⅳ级、原发灶淋巴结转移阳性、肝转移累及双叶、肝转移灶≥4个、最大肝转移灶直径≥5 cm、肝外转移、诊断肝转移时血清CEA水平≥5 ng/ml、肠道原发灶未手术切除、肝转移灶未接受手术处理的患者生存状况较差。然后把这些有统计差异的单因素纳入Cox回归模型进行多因素分析,得出肠道原发灶分化Ⅲ-Ⅳ级、肝转移灶≥4个、最大肝转移灶直径≥5 cm、肝外转移、肠道原发灶未手术切除、肝转移灶非手术治疗这6个因素是影响患者预后的独立危险因素(表2)。将这6个危险因素各设定为1分,所有患者分为低风险组(0~1分)、中风险组(2~3分)和高风险组(4~6分),各组的5年存活率分别为51%、16%和0%,各组的中位生存时间为60.0月、21.4月和10.6月(P<0.001,图3)。
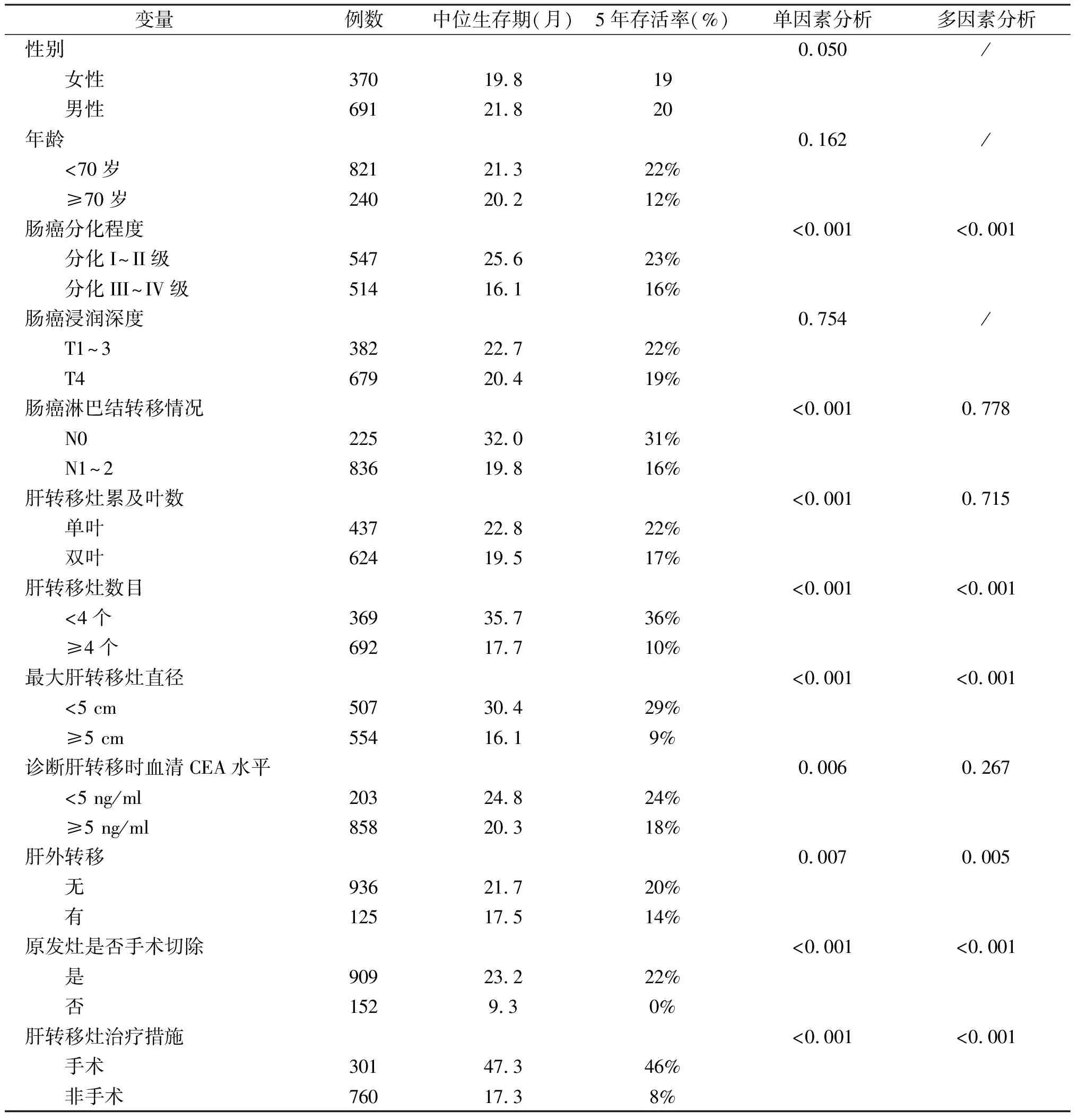
表2 影响同时性肝转移患者临床病理因素表
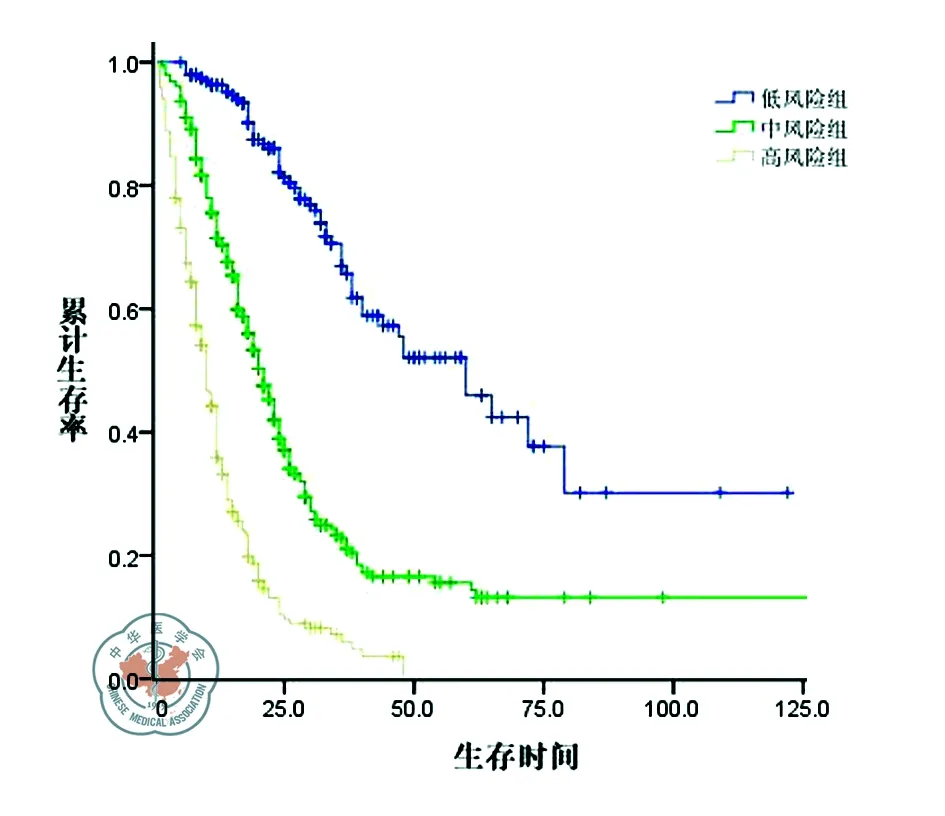
图3 不同风险组别患者的生存比较曲线图
讨 论
肝转移是结直肠癌的一种特殊的状态,与其他肿瘤的肝转移不同,结直肠癌肝转移可发生在疾病的早期,且可仅局限于肝脏,肝转移灶获得手术切除患者的5年生存率可达到甚至超过IIIb期患者。近年来,肠癌肝转移患者的总体生存状况随着肝转移灶手术切除率的增加和新型化疗药物的应用而得到明显改善[4-5]。美国一项回顾性研究发现,2470例肠癌肝转移患者的中位总体生存时间从1990年至1997年的14.2月到2004-2006年的29.2月,5年存活率从1990-1997年的9.1%到2001-2003年的19.2%[6]。其中接受肝转移灶手术的患者5年存活率可达55.2%,中位总体生存时间为56.3月。而且,一个专门登记接受手术的结直肠癌肝转移患者信息的国际注册机构LiverMetSurvey网站统计了多中心超过一万例肠癌肝转移手术患者,发现术后5年总体生存率可达到40%左右[7]。我们中心的数据也显示随着肝转移灶手术切除率的升高和新型化疗药物的使用,2005年至2010年收治患者的总体生存情况,较2000年至2004年期间收治患者有明显改善,主要得益于肝转移灶手术患者比例明显增加和非手术患者生存明显改善。
与异时性肝转移患者不同的是,同时性肝转移患者还存在着同时处理原发灶的问题。根据肝转移灶是否可切除,我们将同时性肝转移患者分为两类:肝转移灶可切除和肝转移灶不可切除。对于肝转移灶可切除的同时性结直肠癌肝转移患者的最佳治疗方案究竟是同期切除结直肠癌和肝转移灶,还是分期手术,目前临床上仍存在争议。一项包括7个病例对照研究共1390例患者的综述发现,同期手术的围手术期死亡率高于分期手术(2.4% vs.1.1%,P=0.01),但是两组手术并发症发生率无明显差异[8]。Haas等[9]回顾分析228例患者,发现同期手术组和分期手术组死亡率无差异,但同期手术组伴有更低的累计并发症发生率(11% vs.25.4%,P=0.015)。虽然两组的3年总体生存率无差异,但同期手术组3年无进展存活率也较低(8% vs.26.1%,P=0.005),同期手术组患者3年内有更高的复发率(85% vs.63.6%,P=0.002),且同期手术被认为是术后复发的独立预测因子。因此,他们认为同期手术对患者无进展生存有负面影响。但是,也有多项研究不赞同上述观点。最新一篇包括14个研究共2204例同时性肝转移患者的综述发现,同期切除肝转移灶的患者比分期切除的患者住院天数明显缩短,术后并发症发生率明显降低,而且术后1年、3年和5年的生存率无明显差异[10]。同期手术可以避免二次手术打击,防止肝转移灶因原发灶切除后迅速生长,并且降低医疗费用,可在有选择的患者中实施[11]。我们中心的数据也显示同期切除和分期切除,在短期围手术期死亡和并发症发生方面和长期生存方面,均无明显差异,而同期手术的患者医疗总费用可降低近1/4。
对于肝转移灶不可切除的患者,若结直肠癌原发灶伴有出血或梗阻等症状,可选择姑息性切除原发灶或放置支架缓解梗阻。而对于结直肠癌原发灶没有任何症状的患者,是直接化疗还是姑息手术切除原发灶,目前仍存在争议。Poultsides等[12]前瞻性研究233位原发灶不可切除的结直肠癌同时性肝转移患者,接受奥沙利铂或伊立替康为基础的化疗方案作为一线治疗,结果只有16位患者(7%)因原发肿瘤梗阻或者穿孔需要行急诊手术,10位患者(4%)因原发肿瘤相关的症状需要非手术干预(比如支架或者放疗)。最终有47人实施择期原发灶和转移灶根治性切除手术,8人在放置肝动脉灌注泵前先行切除原发灶,患者中位生存期为18月。笔者认为对于原发灶既无梗阻也无出血的转移性结直肠癌患者最合适的标准治疗方式是使用化疗,而无需切除原发病灶。Damjanov等[13]综述认为随着化疗药物和靶向药物的联合使用将可以很好地控制肠道原发灶,因而不会因为原发灶出现症状而需要手术切除。
但是最近一些大宗病例研究则显示了不同的结果。2010年Aslam等[14]报道了一组920例IV期结直肠癌患者的10年随访研究报道,原发灶切除组患者中位总生存期14.5月,明显高于原发灶未切除患者的5.83月(P<0.005)。多因素分析也显示原发灶接受手术切除是影响总体生存的独立预测因素,而高龄、原发灶固定和伴有淋巴结转移也是预后不佳的因素。2011年一项包括208名转移灶无法切除的IV期结肠癌患者的回顾性研究报道,85例原发灶接受切除的患者预后明显优于123例仅接受化疗而原发灶未接受手术的患者,而且原发灶接受手术是影响生存的独立预后因素[15]。Lin等[16]在2011年ASCO年会上分析了1989至2008年间美国加州癌症注册中心登记的12239例IV期结直肠癌患者,9373例(76.6%)接受了原发灶切除,2866例(23.4%)未切除原发灶,原发灶切除组患者的中位肠癌特异性生存时间(18月 vs.9月,P<0.0001)和中位总体生存时间(17月 vs.8月,P<0.0001)均明显高于未切除原发灶组患者,而且原发灶手术切除是改善生存状况的独立预后因素。而且,一项包括8个回顾性研究共1062名患者的荟萃分析表明对于无症状或轻度症状的肝转移灶不可切除的结直肠癌患者,切除原发灶可以延长患者生存时间6.0个月(P<0.001),而单纯化疗患者有7.3倍的可能性发生源于原发灶的并发症(P=0.008)[17]。另有多项荟萃分析也显示患者可以从原发灶手术中获得生存获益[18-20]。我们研究也显示原发灶接受手术的患者总体中位生存时间为19.0月,明显高于原发灶未接受手术的患者。但是,上述研究均为回顾性分析,且接受手术的为一般状态较好的患者,所以对结果的解释要慎重,我们仍需要前瞻性、随机对照研究评估原发灶手术的价值。
对于肝转移灶不可切除的患者,还需要经过多学科团队讨论,采用全身化疗、肝动脉灌注化疗、射频消融等方法改善患者预后[21]。但是,首选哪种治疗手段,目前临床上还无定论。Mocellin等[22]汇总了10个比较肝动脉灌注氟尿嘧啶和全身化疗在不可切除的结直肠癌肝转移患者中疗效的随机对照试验,结果发现单独使用肝动脉灌注化疗有更高的肿瘤反应率(42.9% vs.18.4%,P<0.0001),但是在中位生存时间方面无明显优势,因此他们认为目前临床数据不支持在该类患者中单独使用氟尿嘧啶进行肝动脉灌注化疗。Kulaylat等[23]综述也认为肝动脉灌注化疗合并/不合并全身化疗,与全身化疗相比,在不可切除的转移性结直肠癌患者中伴有更高的肿瘤反应率,而且肝转移灶无进展时间延长,但是在总体生存方面有无优势也没有明确定论。而我们的研究发现仅有肝动脉介入化疗联合全身化疗的患者生存明显好于单纯使用肝动脉介入化疗的患者。当然,这还需要进一步临床随机对照试验来验证。
对于结直肠癌肝转移患者,目前临床上缺乏一个理想的预后评分体系用来指导制定最佳的治疗策略。Rees等[24]对929例患者的研究表明将肝转移灶多于1个、原发灶淋巴结阳性、原发灶低分化、肝外转移、肝转移灶大于等于5 cm、CEA>60 ng/ml、肝切缘阳性设为高危因素,5年生存率从低风险组的64%至高风险组的2%。Welsh等[25]收集5个超过500名肠癌肝转移手术患者临床信息的预测生存模型研究,发现其中有4个研究指出淋巴结转移情况、肝转移灶大小和肝转移灶数目是影响生存的独立因素,3个研究指出术前CEA水平、肝转移灶手术切缘情况和肝外转移是影响生存的独立因素,2个研究指出同时性肝转移是影响生存的独立因素,仅有1个研究指出原发灶分化程度是影响生存的独立因素,而且这5个研究都认为肝转移灶累及双叶不是影响生存的独立因素。通过分析,他们指出基于Rees等研究制定的Basingstoke预测指数准确度较高,且经过内部验证,可用于临床上术前和术后评估患者,从而制定治疗方案。而我们研究发现肠道原发灶分化Ⅲ-Ⅳ级、肝转移灶≥4个、最大肝转移灶直径≥5 cm、肝外转移、肠道原发灶未手术切除、肝转移灶非手术处理,这6个因素是结直肠癌同时性肝转移的独立预后因素。根据这六项因素分组,5年生存率也从低风险组的51%至高风险组的0%,也可用于评估患者的预后。但是,目前广泛认可的用于预测的模型仍然缺乏。因此,对于肠癌同时性肝转移患者,我们需要通过多学科团队讨论,评估患者上述高危因素情况,从而制定综合治疗的方式。
对于肝转移灶可切除患者,同期切除肠道原发灶和肝转移灶相对分期切除,可减少住院费用,而在短期并发症和长期生存方面无显著差异。对于肝转移灶不可切除且原发灶无症状的患者,手术切除原发灶似乎可以获得生存收益。肠道原发灶分化Ⅲ-Ⅳ级、肝转移灶≥4个、最大肝转移灶直径≥5 cm、肝外转移、肠道原发灶未手术切除和肝转移灶非手术处理是影响肠癌同时性肝转移患者预后的独立危险因素,根据这6个独立预后因素建立的预测模型可以指导临床采取合适的治疗方案。
[1] Adam R.Colorectal cancer with synchronous liver metastases.Br J Surg,2007,94(2):129-131.
[2] Sharma S,Camci C,Jabbour N.Management of hepatic metastasis from colorectal cancers:an update.J Hepatobiliary Pancreat Surg,2008,15(6):570-580.
[3] Xu J,Qin X,Wang J,et al.Chinese guidelines for the diagnosis and comprehensive treatment of hepatic metastasis of colorectal cancer.J Cancer Res Clin Oncol,2011,137(9):1379-1396.
[4] Pawlik TM,Choti MA.Surgical therapy for colorectal metastases to the liver.J Gastrointest Surg,2007,11(8):1057-1077.
[5] Robinson S,Manas DM,Pedley I,et al.Systemic chemotherapy and its implications for resection of colorectal liver metastasis.Surg Oncol,2011,20(2):57-72.
[6] Kopetz S,Chang GJ,Overman MJ,et al.Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy.J Clin Oncol,2009,27(22):3677-3683.
[7] International registry of liver metastases of colorectal cancer.http://www.livermetsurvey.org,2014-03-05.
[8] Chen GQ,Li J,Ding KF.A meta-analysis of the safety of simultaneous versus staged resection for synchronous liver metastasis from colorectal cancer.Zhonghua Wei Chang Wai Ke Za Zhi,2010,13(5):337-341.
[9] de Haas RJ,Adam R,Wicherts DA,et al.Comparison of simultaneous or delayed liver surgery for limited synchronous colorectal metastases.Br J Surg,2010,97(8):1279-1289.
[10] Chen J,Li Q,Wang C,et al.Simultaneous vs.staged resection for synchronous colorectal liver metastases:a metaanalysis.Int J Colorectal Dis,2011,26(2):191-199.
[11] Moug SJ,Horgan PG.The role of synchronous procedures in the treatment of colorectal liver metastases.Surg Oncol,2007,16(1):53-58.
[12] Poultsides GA,Servais EL,Saltz LB,et al.Outcome of primary tumor in patients with synchronous stage IV colorectal cancer receiving combination chemotherapy without surgery as initial treatment.J Clin Oncol,2009,27(20):3379-3384.
[13] Damjanov N,Weiss J,Haller DG.Resection of the primary colorectal cancer is not necessary in nonobstructed patients with metastatic disease.Oncologist,2009,14(10):963-969.
[14] Aslam MI,Kelkar A,Sharpe D,et al.Ten years experience of managing the primary tumours in patients with stage IV colorectal cancers.Int J Surg,2010,8(4):305-313.
[15] Karoui M,Roudot-Thoraval F,Mesli F,et al.Primary colectomy in patients with stage IV colon cancer and unresectable distant metastases improves overall survival:results of a multicentric study.Dis Colon Rectum,2011,54(8):930-938.
[16] Bs L,AZ,Te S,et al.Role of surgical resection among chemotherapy-treated patients with colorectal cancer stage IV disease:a survival analysis.Chicago:McCormick Place,2011.
[17] Stillwell A P,Buettner PG,Ho YH.Meta-analysis of survival of patients with stage IV colorectal cancer managed with surgical resection versus chemotherapy alone.World J Surg,2010,34(4):797-807.
[18] Verhoef C,de Wilt JH,Burger JW,et al.Surgery of the primary in stage IV colorectal cancer with unresectable metastases.Eur J Cancer,2011,47(3):61-66.
[19] Anwar S,Peter MB,Dent J,et al.Palliative excisional surgery for primary colorectal cancer in patients with incurable metastatic disease.Is there a survival benefit? A systematic review.Colorectal Dis,2012,14(8):920-930.
[20] Stillwell AP,Ho YH,Veitch C.Systematic review of prognostic factors related to overall survival in patients with stage IV colorectal cancer and unresectable metastases.World J Surg,2011,35(3):684-692.
[21] Gallagher DJ,Kemeny N.Metastatic colorectal cancer:from improved survival to potential cure.Oncology,2010,78(3-4):237-248.
[22] Mocellin S,Pasquali S,Nitti D.Fluoropyrimidine-HAI(hepatic arterial infusion)versus systemic chemotherapy(SCT)for unresectable liver metastases from colorectal cancer.Cochrane Database Syst Rev,2009(3):D7823.
[23] Kulaylat MN,Gibbs JF.Regional treatment of colorectal liver metastasis.J Surg Oncol,2010,101(8):693-698.
[24] Rees M,Tekkis PP,Welsh FK,et al.Evaluation of long-term survival after hepatic resection for metastatic colorectal cancer:a multifactorial model of 929 patients.Ann Surg,2008,247(1):125-135.
[25] Welsh FK,Tekkis PP,John TG,et al.Predictive models in colorectal liver metastases-can we personalize treatment and outcome? Dig Surg,2008,25(6):406-412.
