香蕉线条病毒MP功能域基因的克隆、原核表达及抗血清制备
2014-08-31饶雪琴阮小蕾李华平
陈 秀,饶雪琴,阮小蕾,李华平
(1 博罗县农业科学研究所,广东 惠州 516100; 2 华南农业大学 资源环境学院,广东 广州 510642)
香蕉线条病毒MP功能域基因的克隆、原核表达及抗血清制备
陈 秀1,2,饶雪琴2,阮小蕾2,李华平2
(1 博罗县农业科学研究所,广东 惠州 516100; 2 华南农业大学 资源环境学院,广东 广州 510642)
【目的】制备香蕉线条病毒广东分离物(BSV-GD)MP功能域基因编码蛋白的多克隆抗血清,为BSV基因编码蛋白功能的研究提供条件.【方法】对BSV-GD ORF3基因氨基酸序列进行生物信息学分析,得出MP功能域基因序列,克隆该基因并插入载体pET- 28b(+)构建原核表达载体,经IPTG诱导表达后,采用超声波裂解法进行蛋白可溶性分析,利用组氨酸标签纯化试剂盒对目的融合蛋白进行纯化和回收,然后以纯化的目的蛋白为抗原免疫健康家兔制备其多克隆抗血清;通过Western-blot分析该抗血清的特异性,间接ELISA法检测该抗血清的效价.【结果和结论】MP功能域基因在ORF3中的序列为61~311 aa处,核酸序列长753 bp.试验克隆了该基因并成功构建了其原核表达载体pET28b-MP,经IPTG诱导1 h后表达了相对分子质量约为30 800的融合蛋白6His·MP.可溶性分析表明该融合蛋白以包涵体形式存在,纯化获得了高纯度的目的融合蛋白,以其为抗原成功制备了BSV-GD MP功能域基因编码蛋白的多克隆抗血清;分析表明该抗血清具有很强的特异性,其效价高达204 800倍以上.
香蕉线条病毒; MP功能域基因; 原核表达; 抗血清
香蕉线条病毒Bananastreakvirus(BSV)是香蕉上的一种dsDNA拟反转录病毒,属于花椰菜花叶病毒科Caulimoviridae杆状DNA病毒属Badnavirus[1].BSV引起的香蕉线条病是香蕉生产上的主要病毒病之一,发病初期叶片产生连续或不连续的褪绿条斑,随病情发展,条斑逐渐变褐坏死,假茎、叶柄和果穗有时也会出现条纹症状,不同基因型香蕉植株表现的症状存在差异[2].
BSV在世界各香蕉产区分布广泛,造成了一定的经济损失,严重制约了香蕉种质资源的调运[3],进而制约了香蕉生产的健康发展.香蕉线条病在我国台湾、广东、云南、海南等地的香蕉产区已有发生[4],基于该病害在其他国家香蕉产区已造成较严重的生产危害[5],因此非常有必要展开这一病害的研究工作.
BSV具有杆状DNA病毒的典型分子特征,基因组包含3个ORF,ORF1和ORF2编码2个小蛋白,ORF3编码1个大的多聚蛋白,根据同属病毒基因组特征推测此多聚蛋白在蛋白水解酶的作用下分解为运动蛋白(Movement protein, MP)、外壳蛋白(Coat protein, CP)、天冬氨酸蛋白酶(Asepartic protease, AP)、反转录酶(Reverse transcriptase, RT)和RNA酶H(RNase H, RH)[6-7].编码这些蛋白的基因的确切位置、蛋白的大小目前还不清楚.
目前,对BSV的研究主要还是集中在病毒检测[8-11]、病毒核酸与寄主基因组整合[12-14]和遗传多样性[15]等方面,而对BSV编码蛋白的生物学功能、BSV的致病机制等方面还知之甚少,除BSV凯文迪斯株系BananastreakvirusCaverdish strain(BSV-CaV) ORF3和ORF1基因间隔区存在启动子序列[16]的报道外,鲜见其他关于BSV基因功能的研究报道.
蛋白抗体在蛋白功能的研究中发挥着重要的作用.BSV抗血清的制备是相关研究工作开展的重要基础.前期已对BSV广东分离物(BSV-GD)的ORF1和ORF2基因进行了原核表达并获得了其高效价的多克隆抗血清[17-18].本研究拟对BSV-GD(GenBank登陆号为DQ451009)ORF3中的MP功能域基因进行原核表达并制备其编码蛋白的多克隆抗血清,为进一步研究BSV ORF3编码蛋白的功能奠定基础,进而为弄清BSV的复制、侵染、致病机制等提供依据.
1 材料与方法
1.1 试验材料
大肠埃希菌EscherichiacoliJM109、DH5α、Rosseta(DE3)菌株、原核表达载体pET- 28b(+)、pCAMBIA-BSV质粒[19]和香蕉植物组织材料由华南农业大学病毒研究室保存.pMD18-T载体、各种酶购自TAKARA公司;DNA回收试剂盒购自杭州维特洁生物技术有限公司;多聚组氨酸蛋白纯化试剂盒购自德国MERCK公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG、His·Bind树脂、10 K超滤管为美国Novagen公司产品,购自广州英伟创津生物技术有限公司.
1.2 基因功能域的生物信息学分析
利用蛋白功能域分析软件PROSITE(http:∥www.expasy.ch/prosite/)对BSV-GD ORF3的氨基酸序列进行分析;利用DNAStar软件对BSV-GD ORF3氨基酸序列与BSV其他分离物及同属其他成员的ORF3氨基酸序列进行比对分析,推测BSV-GD MP功能域基因的序列.
1.3 BSV-GD MP功能域基因的克隆和原核表达
根据BSV-GD MP功能域基因的序列设计引物petMP-FP:5′-GTCGACCATACACTATCTATGGTGGT-3′;petMP-RP:5′-AAGCTTTTAACCAAATCGTATACTCC-GTG-3′.上游引物引入SalⅠ酶切位点,下游引物引入Hind Ⅲ酶切位点.以pCAMBIA-BSV质粒[19]为模板,PCR扩增目的基因,产物回收后连接到pMD18-T载体中,对重组质粒进行测序鉴定.利用SalⅠ和Hind Ⅲ酶切位点将测序正确的MP片段连接到pET- 28b(+)中,获得目的基因的原核表达载体pET28b-MP.
将原核表达载体pET28b-MP转化到表达菌株E.coliRosseta(DE3)中.挑取阳性单克隆接种到LB液体培养基中,培养至D600 nm≈0.6,加入IPTG至终浓度为1 mmol·L-1,于37 ℃下诱导表达.分别取诱导时间为1、3、5、7 h的菌液1 mL,12 000 r·min-1离心 1 min,收集细菌,用100 μL灭菌蒸馏水重悬,并加入100 μL 2×SDS的凝胶上样缓冲液,沸水中煮5 min,分别取15 μL上样,进行SDS-PAGE,检测目的蛋白是否表达.
1.4 His融合蛋白的纯化和浓缩
离心收集诱导菌体,冰浴超声波破碎后4 000 r·min-1离心10 min,吸出上清,沉淀溶解在1/8体积的灭菌蒸馏水中,分别取上清、沉淀溶解液进行SDS-PAGE.同时,将超声波破碎的表达产物按MERCK公司组氨酸标签纯化试剂盒操作说明书进行蛋白纯化,将纯化后的蛋白洗脱液加入到4 mL的10K超滤管中,7 500 r·min-1离心10 min,收集超滤管底部的蛋白进行SDS-PAGE.
1.5 His融合蛋白抗血清的制备
抗原制备:第1次注射前取约100 μg·mL-1纯化浓缩的融合蛋白1 mL,混合等体积福氏完全佐剂,乳化后作为抗原.第2次、第3次、第4次注射前取约100 μg·mL-1纯化浓缩的融合蛋白0.5 mL,混合等体积福氏不完全佐剂,乳化后作为抗原.第5次注射前取约100 μg·mL-1纯化浓缩的融合蛋白0.5 mL直接作为抗原,不加佐剂.
抗体分离和保存:取2 kg左右雄性健康新西兰大白兔,作标记.注射抗原前取兔耳静脉血作空白血清对照.参考何云蔚等[19]的方法分别进行皮下多点和肌肉混合注射,共免疫5次.每次各注射1~2 mL乳化抗原溶液.第1次免疫后每隔7 d免疫1次,最后一次免疫采用耳静脉注射,抗原不加佐剂,免疫7 d后,耳静脉采血,测定抗血清效价,效价达到要求(5 000倍以上)则心脏采血,效价不达要求则继续加强注射1次,7 d后测效价,心脏采血.将所采血样室温放置约2 h,自然凝固后,置于4 ℃过夜待凝块收缩,吸取上清液,3 000 r·min-1离心15 min,取上清,加入1 g·L-1的叠氮化钠,-20 ℃条件保存.
1.6 抗血清的Western-blot分析
取经IPTG诱导的转化了pET28b-MP质粒的E.coliRosseta(DE3)菌体裂解液进行SDS-PAGE,以经IPTG诱导的未转化重组质粒的E.coliRosseta(DE3)菌体裂解液和未经IPTG诱导的转化了pET28b-MP质粒的E.coliRosseta(DE3)菌体裂解液为对照.取SDS-PAGE后的凝胶,直接用DYY-7型转移电泳仪将其转印于硝酸纤维素膜上,将硝酸纤维素膜放入可加热封接的塑料袋中用封闭液封闭,按0.10~0.15 mL·cm-2的量加入经TBST稀释的一抗血清(制备的抗血清),排除气泡后密闭袋口,37 ℃摇床温育1 h,然后利用TBST洗涤3次,将充分洗涤后的膜转入新塑料袋中,加入经TBST稀释的酶标二抗(HRP标记的羊抗兔IgG),37 ℃摇床温育0.5~1.0 h,TBST洗涤3次,再用TBS洗涤2次.将膜转移到小平皿中,加入新配制的底物液室温作用3 min,立即用X射线胶片压片,曝光适当时间后,定影、显影、冲洗照片.
1.7 抗血清的效价测定
参考邓从良等[20]的方法,用间接ELISA法进行检测,抗原浓度为免疫注射时的1/20,抗血清用0.01%BSA的PBST缓冲液稀释,稀释度为1∶4~1∶204 800,设置机械零孔和空白对照,以免疫前的血清稀释相同倍数作为阴性对照.
2 结果与分析
2.1 BSV-GD ORF3基因功能域的生物信息学分析
利用蛋白结构域分析软件PROSITE结合序列比对对BSV-GD 的ORF3核苷酸序列推导的氨基酸序列进行分析,推测出MP功能域在ORF3推导的氨基酸序列中位于61~311 aa处,长为251 aa,核酸序列长为753 bp.MP保守结构域氨基酸序列比对结果如图1所示.

图1 BSV-GD与其他Badnavirus ORF3基因序列推导的氨基酸序列中的MP保守结构域氨基酸序列比对Fig.1 Alignment of BSV-GD and other Badnavirus movement protein domain concensus sequences in ORF3
2.2 BSV-GD MP功能域基因的原核表达
将PCR扩增到的BSV-GD MP功能域基因克隆到pMD18-T载体中,重组质粒测序结果表明目的基因序列与原序列完全一致.SalⅠ和Hind Ⅲ双酶切质粒,将目的基因连接到原核表达载体pET- 28b(+)中,构建目的基因的原核表达载体pET28b-MP,并转化表达菌株E.coliRosseta(DE3),于37 ℃经IPTG诱导表达.BSV-GD MP功能域基因的编码部分含有251个氨基酸,载体上的His标签部分为17个氨基酸,预期可表达相对分子质量大小为30 800的蛋白产物.收集经IPTG诱导若干小时的含有重组质粒的菌体,以经诱导5 h的未转化重组质粒的E.coliRosseta (DE3)菌体及未经诱导的含重组质粒的E.coliRosseta (DE3)菌体为阴性对照,以菌体裂解产物为上样样品进行SDS-PAGE,结果表明含pET28b-MP重组质粒的菌株经1~ 7 h诱导后均可特异性地表达出与预期相当大小的目的蛋白,目的蛋白的表达量在5 h内趋于恒定,5 h后表达产量迅速降低(图2).
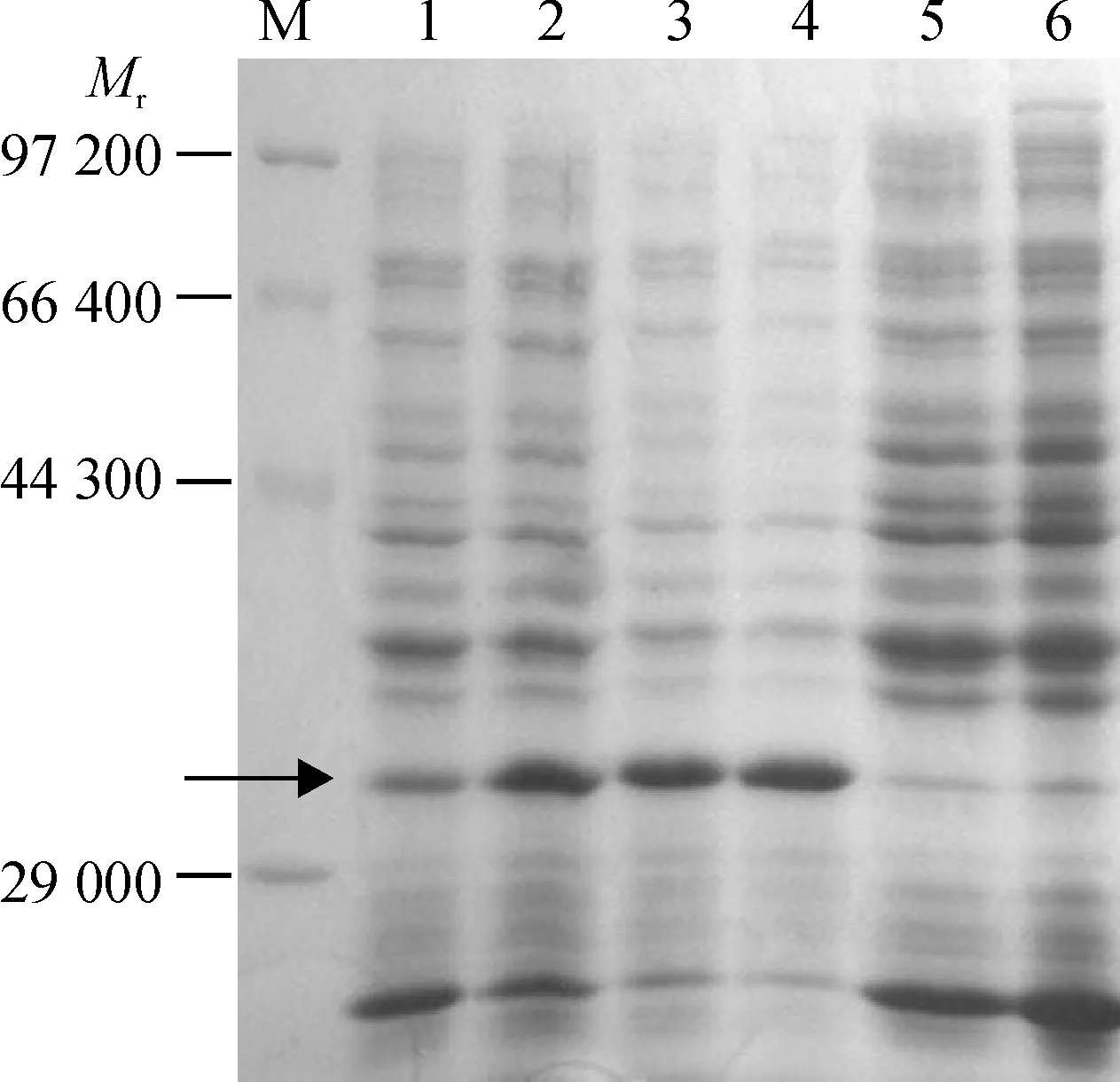
M:低相对分子质量蛋白Marker;1~4:含重组质粒pET28b-MP的E.coliRosseta (DE3)分别诱导7、5、3、1 h的裂解产物; 箭头示表达的目的蛋白;5:未经诱导的含重组质粒的E.coliRosseta (DE3) 裂解产物;6:经诱导的未转化重组质粒的E.coliRosseta (DE3)裂解产物
图2 含pET28b-MP的E.coliRosseta(DE3)表达产物
Fig.2 Analysis of prokaryotic expression products of His-MP gene by SDS-PAGE
2.3 融合蛋白6His·MP的纯化
将表达菌菌液经超声波处理,分别收集上清和沉淀进行SDS-PAGE,结果表明融合蛋白主要以包涵体的形式存在于菌体沉淀物中,上清中几乎没有目的蛋白(图3).利用His·Bind树脂对6×His 融合蛋白进行分离、纯化.纯化的融合蛋白经SDS-PAGE分析,结果显示单一的目的条带(图4),表明获得了较纯的目的蛋白.
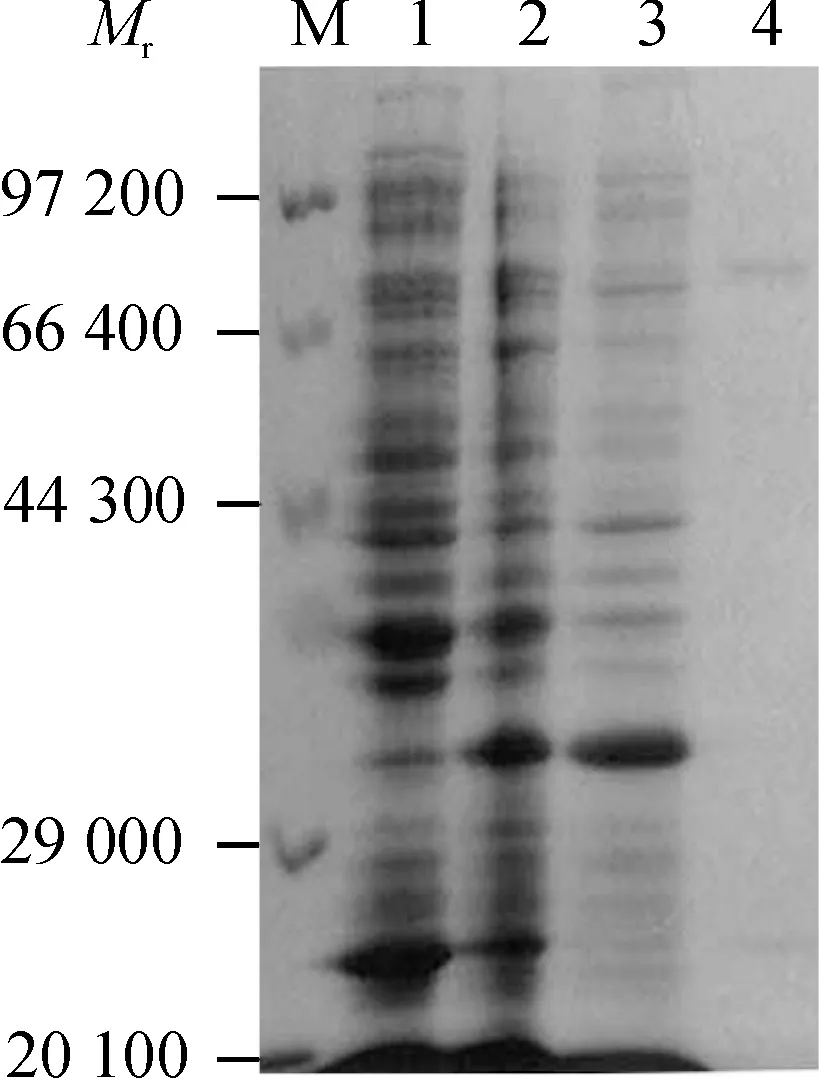
M:低相对分子质量蛋白Marker;1:未诱导的转化菌全蛋白;2:诱导的转化菌全蛋白;3:诱导菌液经超声裂解后的沉淀物;4:诱导菌液经超声裂解后的上清液.
图3 SDS-PAGE进行融合蛋白6His·MP的可溶性分析
Fig.3 Soluble analysis of fusion protein 6His·MP by SDS-PAGE
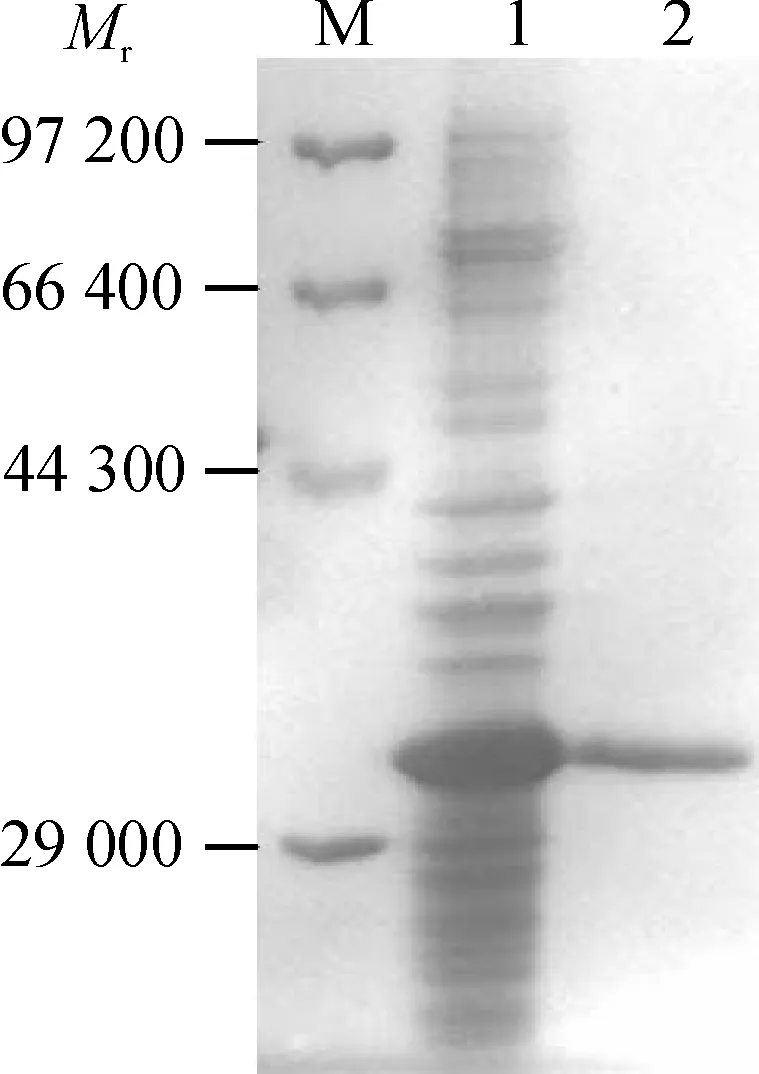
M:低相对分子质量蛋白Marker;1:未纯化的蛋白(诱导菌液经超声裂解后的沉淀物);2:纯化的His融合蛋白.
图4 纯化融合蛋白6His·MP 的SDS-PAGE分析
Fig.4 Analysis of the purified fusion protein 6His·MP by SDS-PAGE
2.4 融合蛋白6His·MP抗血清的制备、特异性检测及效价测定
以纯化的融合蛋白6His·MP为抗原免疫新西兰大白兔,获得了含多克隆抗体的血清. 将所制备的多克隆抗血清按1∶4 000稀释,对诱导培养的含重组质粒的E.coliRosseta(DE3)全蛋白进行Western-blot检测,结果显示在目的蛋白的位置有明显杂交带(图5),说明制备的抗血清能够与目的蛋白发生抗原-抗体识别反应,且特异性很强,为专化性抗血清.
用间接ELISA法测定抗血清效价,将抗血清按稀释至1∶204 800时,仍具有明显的阳性反应(表1),说明融合蛋白6His·MP在大白兔体内具有良好的免疫性,所制备的抗血清效价在204 800倍以上.
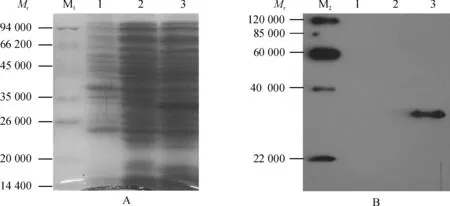
M1:低相对分子质量蛋白Marker,M2:EasyWestern 蛋白Marker;1:IPTG诱导的E.coliRosseta (DE3) 全蛋白;2:未诱导的转化pET28b-MP的E.coliRosseta (DE3) 全蛋白;3:IPTG诱导的转化pET28b-MP的E.coliRosseta (DE3) 全蛋白.
A:SDS-PAGE对照,B:Western-blot分析.
图5 6His·MP融合蛋白抗血清的Western-blot分析
Fig.5 Analysis of anti-fusion protein 6His·MP by Western-blot
表1间接ELISA法测定融合蛋白6His·MP抗血清的效价
Tab.1Determinationoftiterofanti-fusionprotein6His·MPbyindirectELISA
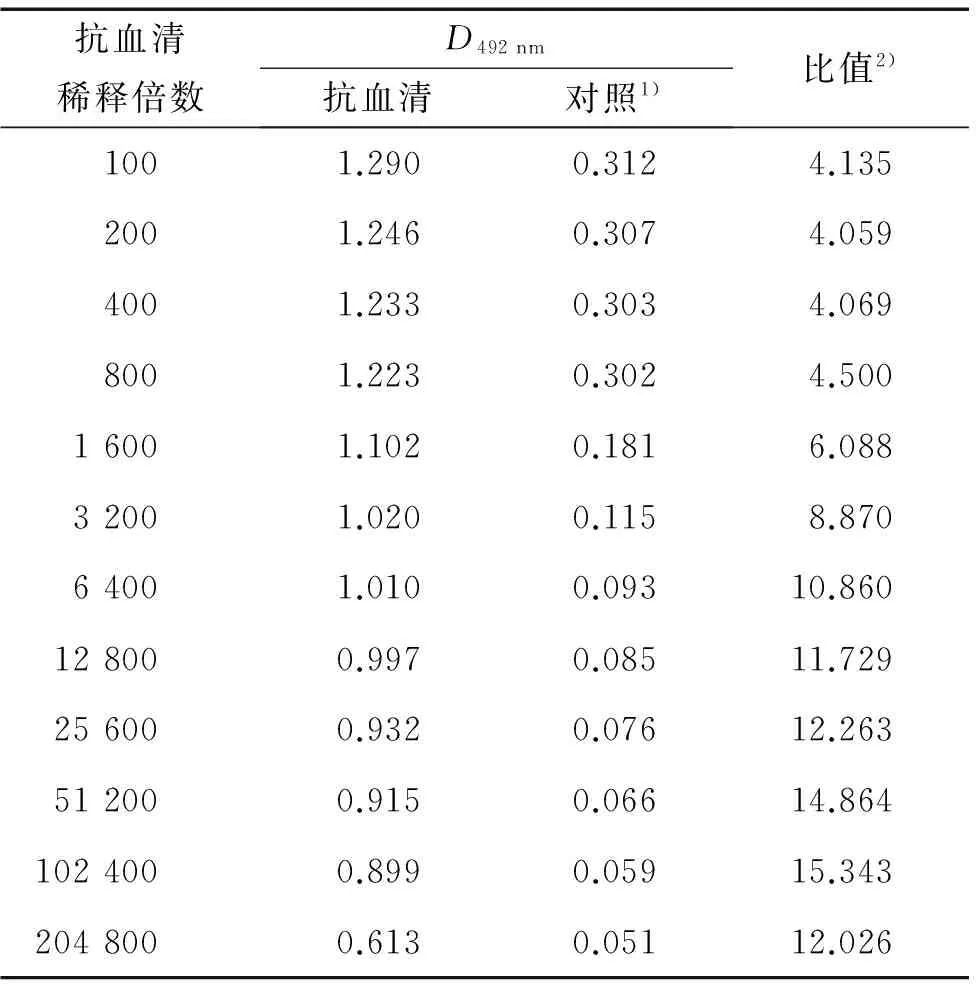
抗血清稀释倍数D492nm抗血清对照1)比值2)1001.2900.3124.1352001.2460.3074.0594001.2330.3034.0698001.2230.3024.50016001.1020.1816.08832001.0200.1158.87064001.0100.09310.860128000.9970.08511.729256000.9320.07612.263512000.9150.06614.8641024000.8990.05915.3432048000.6130.05112.026
1) 对照为未免疫血清;2) 抗血清和对照的D492 nm的比值.
3 讨论与结论
利用体外表达蛋白为抗原制备病毒的抗血清这一技术已被广泛应用,但是抗原的制备方法要根据具体情况确定.目前用体外表达产物制备抗原通常有2种方法:一是利用Ni2+树脂亲和层析法纯化带标签的融合蛋白,该法的优点是得到的目的蛋白纯度高,利于制备特异性强的抗血清,该法的缺点是Ni2+树脂价格相对昂贵,另外纯化蛋白比较耗时;二是直接从聚丙烯酰胺凝胶上切下表达产物制备抗血清,该法的优点是简便、经济,缺点是回收得到的表达产物中可能含有宿主菌的蛋白成分而降低抗血清的特异性,另外胶块如果研磨不够细,则会损害兔子的健康.本研究采用的是第1种方法,目的是为了得到目的蛋白的特异性抗血清,同时获得纯度高的目的蛋白,可进一步用于后续蛋白功能的研究.如果只是为了快速获得蛋白抗血清,则建议采用第2种方法.
抗血清的制备是相关蛋白生物学功能研究工作开展的重要基础.前期已对BSV-GD的ORF1和ORF2基因进行了原核表达并制备了其编码蛋白的高效价多克隆抗血清,为ORF1和ORF2编码蛋白的功能研究奠定了基础[17-18],而ORF3编码蛋白在BSV的侵染和复制中起着更复杂、更重要的作用,所以研究BSV ORF3基因编码蛋白的功能显得尤为重要.本研究制备了BSV ORF3中MP功能域基因编码蛋白的高效价抗血清,为进一步研究BSV ORF3编码蛋白的功能奠定了基础.MP功能域基因编码蛋白的抗血清可用于BSV编码的MP蛋白的亚细胞定位、MP蛋白在寄主细胞和组织的定位、病毒运动方式、运动机理和寄主抗病性等多方面的研究.本研究已着手利用制备的MP功能域蛋白抗血清开展感病香蕉组织蛋白提取物的检测、BSV-GD编码的MP蛋白的亚细胞定位及其在寄主细胞和组织的定位等方面的研究,这对BSV运动机理的了解将会是一个突破性进展.
BSV-GD基因组测序结果表明基因组全长6 950 bp,共含有3个开放阅读框,ORF3全长为5 130 bp,编码1 709个 aa[21].本研究对ORF3氨基酸序列的生物信息学分析表明其氨基酸序列含有5个功能位点,依次是植物病毒运动蛋白保守序列、运动锌指环结构(典型的病毒外壳蛋白结构)、天冬氨酸蛋白酶位点、反转录酶功能域位点、RNA酶H功能域位点,得出了BSV-GD 编码MP的基因的较确切的位置,克隆了含MP功能域的基因,构建了该基因的原核表达载体,将该载体转化大肠杆菌并诱导表达了N-端带His标签的目的蛋白,回收得到了高纯度的目的蛋白,以纯化的目的蛋白为抗原免疫健康家兔制备了高效价、专化性的多克隆抗血清,为BSV ORF3编码蛋白的功能研究和BSV运动机理的研究奠定了基础.
[1] GAYRAL P, ISKRA-CARUANA M L. Phylogeny ofBananastreakvirusreveals recent and repetitive endogenization in the genome of its banana host (Musasp.)[J]. J Mol Evol,2009, 69(1): 65- 80.
[2] WAMBULWA M C, WACHIRA F N, KARANJA L S, et al. The influence of host and pathogen genotypes on symptom severity in banana streak disease[J]. Afr J Biotech-nol, 2013, 2(1): 27-31.
[3] LHEUREUX F, LABOUREAU N, MULLER E, et al. Molecular characterization of banana streak acuminata Vietnam virus isolated fromMusaacuminatasiamea(banana cultivar)[J]. Arch Virol, 2007, 152(7): 1409-1416.
[4] ZHUANG Jun, WANG Jianhua, ZHANG Xin, et al. Molecular characterization ofBananastreakvirusisolate fromMusaacuminatain China[J]. Viro Sin, 2011, 26(6): 393- 402.
[5] DANIELLS J W, GEERING A D W, BRYDE N J, et al. The effect ofBananastreakviruson the growth and yield of dessert bananas in tropical Australia[J]. Ann Appl Biol, 2001, 139(1):51- 60.
[6] HOHN T, FUTTERER J. The proteins and functions of plant pararetroviruses: Knowns and unknowns[J]. Crit Rev Plant Sci, 1997,16(1): 133-161.
[7] VERMA R, MUNGEKAR D, GAIKWAD P, et al. Molecular characterization ofBananastreakvirusisolate from banana cultivar Kanchi kela of ABB genotype[J]. J Mycol Plant Pathol, 2012, 42(1): 124-127.
[8] SHARMAN M, THOMAS J E, DIETZGEN R G. Development of a multiplex immunocapture PCR with colourimetric detection for viruses of banana[J]. J Virol Methods, 2000, 89(1/2): 75- 88.
[9] GREGOIRE L P, MARIE-LINE I C, ISABELLE A. Improved detection of episomalBananastreakvirusby multiplex immumocaptrue PCR[J]. J Virol Methods, 2006,137(1): 7-13.
[10]JAMES A P, GEIJSKES R J, DALE J L, et al. Development of a novel rolling-circle amplification technique to detectBananastreakvirusthat also discriminates between integrated and episomal virus sequences[J]. Plant Dis, 2011,95(1): 57- 62.
[11]PENG Jun, FAN Zaifeng, HUANG Junsheng. Rapid detection ofBananastreakvirusby loop-mediated isothermal amplification assay in South China[J]. J Phytopathol, 2012, 160(5): 248- 250.
[12]HARPER G, HULL R, LOCKHART B, et al. Viral sequences integrated into plant genomes[J]. Annu Rev Phytopathol, 2002,40: 119-136.
[13]GEERING A D W, POOGGIN M M, OLSZEWSKI N E, et al. Characterisation of Banana streak Mysore virus and evidence that its DAN is integrated in the B genome of cultivatedMusa[J]. Arch Virol, 2005,150(4): 787-796.
[14]GAYRAL P, NOA-CARRAZANA J, LESCOT M, et al. A singleBananastreakvirusintegration event in the banana genome as the origin of infectious endogenous pararetrovirus[J]. J Virol, 2008, 82(13): 6697- 6710.
[15]HARPER G, HART D, MOULT S, et al.Bananastreakvirusis very diverse in Uganda[J]. Virus Res, 2004,100(1): 51-56.
[16]REMANS T, GROF C P L, EBERT P R, et al. Identification of functional sequences in the pregenomic RNA promoter of theBananastreakvirusCavendish strain (BSV-CaV)[J]. Virus Res, 2005, 108(1/2): 177-186.
[17]何云蔚,陈秀,阮小蕾,等.香蕉线条病毒ORFⅠ基因的原核表达及抗体制备[J].华南农业大学学报,2009,30(3):89-91.
[18]何云蔚,陈秀,阮小蕾,等.香蕉线条病毒ORFⅡ基因的原核表达及抗体制备[J].植物病理学报,2009,39(1):100-103.
[19]何云蔚,阮小蕾,陈秀,等.香蕉线条病毒侵染性克隆的构建[C]∥彭友良,朱有勇.中国植物病理学会2009年学术年会论文集.北京:中国农业科学技术出版社,2009:351-352.
[20]邓丛良,韩丽娟,燕照玲,等.白草花叶病毒CP基因在大肠杆菌中的表达及抗血清的制备[J].植物病理学报,2005,35(5):442- 445.
[21]谢丽君,何云蔚,陈秀,等.香蕉线条病毒广东分离物基因组序列测定和特征分析[C]∥彭友良,康振生.中国植物病理学会2007年学术年会论文集.杨凌:西北农林科技大学出版社,2007:267- 269.
【责任编辑霍 欢】
ProkaryoticexpressionandantiserumpreparationforfunctionaldomainofBananastreakvirusmovementproteingene
CHEN Xiu1,2,RAO Xueqin2, RUAN Xiaolei2, LI Huaping2
(1 Boluo County Institute of Agricultural Sciences, Huizhou 516100, China; 2 College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China)
【Objective】 To provide antibody ofBananastreakvirusGuangdong isolate (BSV-GD) and to provide references for the function research of proteins encoded by BSV ORF3 further. 【Method】 The MP functional gene sequence was obtained through bioinformatics analysis. The gene was cloned and inserted into the plasmid pET- 28b(+) to construct the prokaryotic expression recombinant plasmid. The recombinant vector was induced by IPTG to express the fusion protein 6His·MP. Soluble analysis of the fusion protein was carried out by ultrasonic lysis method. The highly purified protein was obtained by His-tag purification kit. The special polyclonal antibody was generated by immunizing healthy rabbit using the purified protein as antigen. The specificity of antiserum was detected by Western-blot. The antibody titer was determined by indirect enzyme immunoassay. 【Result and conclusion】The analysis showed that the MP functional gene was 61-311 aa of the ORF3 sequence and the nucleotide sequence length was 753 bp. The prokaryotic expression recombinant plasmid pET28b-MP was constructed, and the expressed fusion protein 6His·MP was about 30 800 in size. Soluble analysis of the fusion protein indicated that it was an inclusion body. The highly purified target protein was obtained. The special polyclonal antiserum was generated according to the purified protein. The assay suggested that the antiserum had very strong specificity, and the antibody titer was higher than 1∶204 800.
Bananastreakvirus; movement protein domain; prokaryotic expression; antiserum
2013- 04- 16优先出版时间2014- 01- 03
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20140103.0828.011.html
陈 秀(1983—),女,博士,农艺师,E-mail:63753448@qq.com;通信作者:李华平(1961—),男,教授,博士,E-mail: huaping@scau.edu.cn
国家自然科学基金(30671358);广东省自然科学基金(C036845)
陈 秀,饶雪琴,阮小蕾,等.香蕉线条病毒MP功能域基因的克隆、原核表达及抗血清制备[J].华南农业大学学报,2014,35(2):47- 52.
S432.4+1
A
1001- 411X(2014)02- 0047- 06
