印刷电子技术在生物传感器中的应用
2014-08-29李祥高王世荣
李祥高,吴 宪,王世荣
(天津大学化工学院,天津300072)
1 前 言
IUPAC (国际纯粹与应用化学联合会)对生物传感器的定义是:生物传感器是一个独立的集成器件,能够使用生物识别元素(生化受体)在空间上与传感器直接接触,从而提供定量或半定量的分析信息[1]。化学分析法由于其操作复杂、周期长,不能满足各种实际应用需要。20世纪60年代,由于酶分析法的专一性强、灵敏度高、操作方便等优点开始取代一些化学分析方法。1962年Clark教授首次提出了酶传感器的概念,1975年Springs Instruments 制作了第一批商业化的生物传感器[2]。传统酶电极的制作方法繁琐、成本昂贵、不适宜大规模商业化生产。1984年,英国学者Cass 等人[3]建立了介体酶电极方法,以戊二醛为化学介体取代分子氧作为酶促反应的电子受体,以此为基础,1987年美国MediSene公司开发出印刷酶电极,用于血糖检测。这标志着电子印刷技术应用于规模生产生物传感器成为可能。
生物传感器逐步应用于我们生活的许多领域,包括发酵工程、医学诊断、制药工程、食品工程、环境监测等。对生物传感器的制作工艺也进行了更为广泛的探索,其中印刷电子技术被认为是工业化规模生产生物传感器的优选技术路线之一。目前,约50%的一次性葡萄糖传感器采用丝网印刷技术生产[4]。表1列出了葡萄糖传感器的几种不同制备工艺。由表1可见喷墨和丝网印刷技术都可用于制备灵敏度高、检测限低、线性范围宽的传感器。
图1是近20年来有关研究印刷电子技术制作生物传感器发表的SCI收录论文数量。在2005年以后,尤其是丝网印刷技术应用于生物传感器制备的研究呈快速发展态势,而喷墨印刷技术的应用则相对缓慢,这是由于喷墨印刷技术对功能油墨的性能要求很高,其技术特点更适于个性、现场和小批量的制作。

表1 不同工艺制作的葡萄糖生物传感器
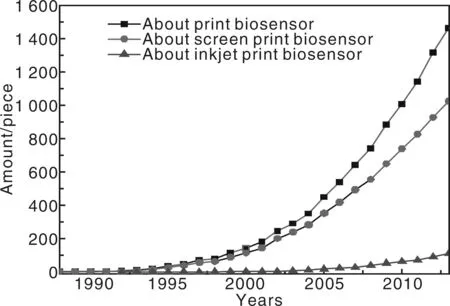
图1 SCI收录的有关电子印刷制作生物传感器的论文数量与年份的关系曲线Fig.1 Relationship curves between electrically printed biosensor article number included in SCI and years
2 生物传感器的结构及工作原理
生物传感器由3部分组成:能与目标分析物形成敏感和特定交互作用的受体;用于检测和量化目标分析物和受体特殊相互作用的换能器;用于连接受体和换能器的界面层[9]。依据不同的技术方法可以对生物传感器进行不同分类。依据生物传感器的结构不同,可以将生物传感器主要分为电化学生物传感器和半导体生物传感器。用于检测H2O2的电化学生物传感器通过将酶固定在金属电极上制作而成,结构示意如图2[10]。用于检测蛋白质的半导体生物传感器的结构示意和实物照片如图3[11]。电化学生物传感器和半导体生物传感器的区别是,前者通过在导电电极基底上进行生物识别组分的修饰制作而成,后者则是通过在场效应晶体管基底上修饰生物识别组分制作而成。
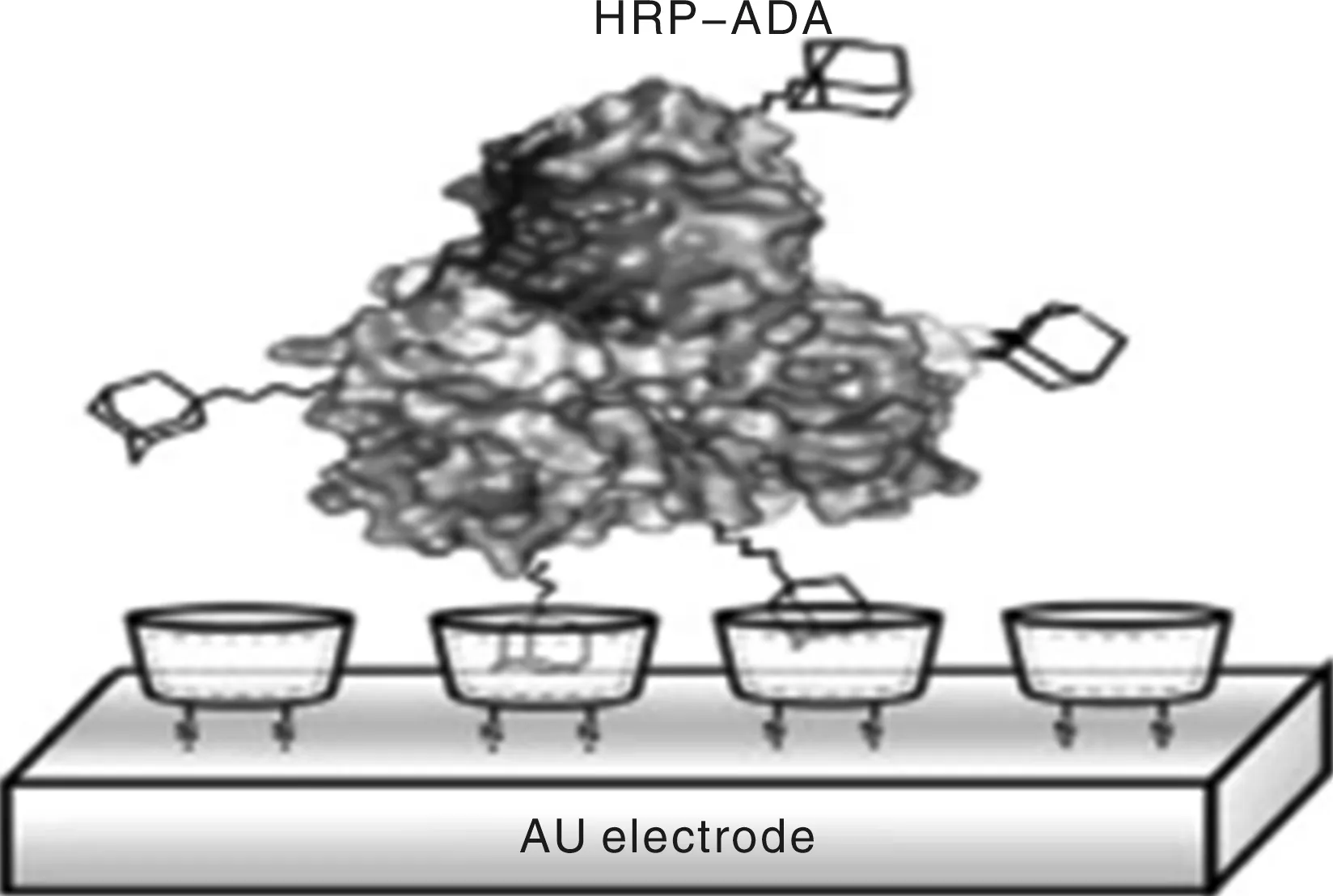
图2 电化学生物传感器结构示意图Fig.2 Schematic diagram of electrochemical biosensor
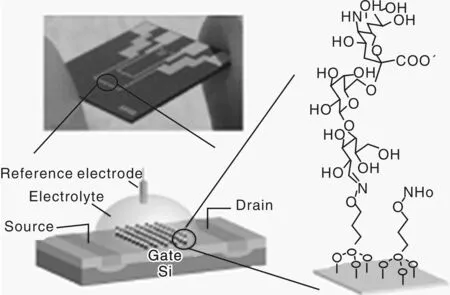
图3 半导体生物传感器结构示意图和实物照片Fig.3 Structural schematic diagram and object photos for semiconductor biosensor
生物传感器的传感机理是基于生物识别组分和目标分子之间相互作用时电荷转移实现的。转移的电荷会通过导电介质传输到换能器并被转换为可以识别的信号,从而进行定量或半定量的检测。通过不同浓度目标分子和所对应的信息的关系,计算模拟出浓度和输出信息(如电流、电压、电阻等)之间的代数关系式,从而实现对未知浓度目标分子的检测。
3 印刷电子制作生物传感器使用的油墨
利用印刷技术制作生物传感器的一个重要内容是研究导电油墨,以便在基底上通过印刷形成电极,进而生成具有信号响应性的功能层。油墨的组成也是决定传感器性能的一个重要因素,如油墨复合材料的种类(如石墨纳米粒子、碳纳米管、金纳米粒子)、装载方式,印刷工艺和固化条件等,都会强烈地影响电子转移反应和电极整体分析的结果和性能[12]。介体物质的加入,如铁蓝[12-13]、铁氰化物[14]、绿脓菌素[15]、酞菁钴[16]、甲基紫罗碱[17]等能在生物活性材料和目标分子作用的过程中起到类似放大器的作用,从而提高生物传感器的性能,其作用原理如图4[18]。用酶作为生物活性材料时,如脱氢酶会需要辅酶或辅基,若从酶蛋白中移除辅助成分,则酶会失去催化活性。
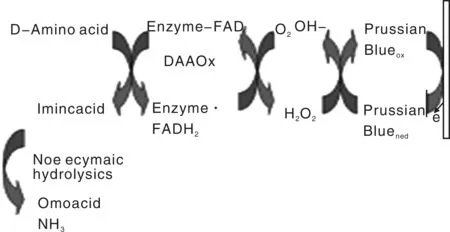
图4 Prussian Blue(铁蓝)作为中介物生物传感器传感机理Fig.4 Sensing mechanism of prussian Blueas as mediator in biosensor
含碳油墨由导电性优异的碳黑或石墨(碳纳米管)、反应活性物质、分散介质及其添加剂组成,目前主要是研究适合丝网印刷的油墨。制作丝网印刷石墨电极(SPCE)时,需要在油墨中加入聚合物胶黏剂提高成膜性和附着力;用溶剂调节粘度以适应印刷和控制电极厚度等。目前多使用含碳导电性油墨印刷制作工作电极和对电极。表2是一些典型的SPCE电极用作生物传感器的例子。

表2 SPCE用作生物传感器实例
纳米粒子复合油墨纳米粒子常作为电极的修饰材料,用于生物传感器中形成良好的固-固界面接触。基于纳米材料修饰的传感技术可以提高响应灵敏度,通过在场效应晶体管上的集成,实现非破坏方式的无标记、实时检测[22]。粒子的性质依赖于粒子的大小、粒子的间距、有机保护壳的性质、粒子的形状等[23]。
表3给出了以Cu、碳纳米管、聚合物等修饰的生物传感器的典型例子。最近几年研究的热点之一是利用导电聚合物PEDOT(聚3,4-二氧乙撑噻吩)制备电极。通过在聚合物中掺杂如石墨烯[30]、金纳米粒子[31]等能显著地提高电极的灵敏度。这是由于PEDOT本身具有良好的导电性,再与这些导电粒子形成复合物后进一步改善了导电能力,等效于扩大了电极的有效表面积,增加了与目标分子接触的机会。Michal Wagner等人[32]将乙二醇、季铵盐、PEDOT和聚苯乙烯磺酸盐(PSS)组成的油墨用喷墨印刷的方式覆盖在玻碳电极表面,在水中浸泡60 d后,电极表面仍能保持良好的吸附性。另外,磁性纳米粒子也是近年研究的热门领域。通过多种磁性纳米粒子的同时修饰还可以实现一种电极对多种物质的检测。Longinotti等人将有催化活性的酶固定在超顺磁的氧化铁纳米粒子上,通过磁场的作用实现将活性酶吸附或移出电极表面,实现了一个工作电极对多种物质的检测[33]。Bettazzi等人通过将包覆酶的磁性粒子吸附在丝网印刷的电极阵列表面,实现了同时检测8个样品,可以显著降低分析时间[34]。
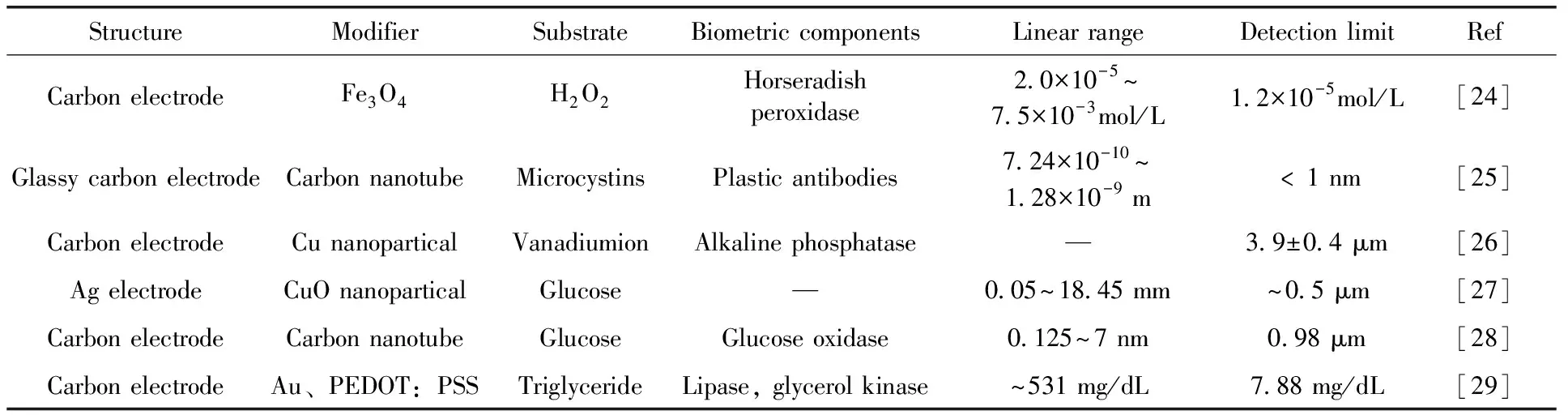
表3 纳米粒子修饰的生物传感器
Ag/AgCl油墨常用作参比电极的有Ag/AgC电极、饱和甘汞电极和标准氢电极。只有Ag/AgCI电极适于丝网印刷制作。因此,Ag/AgCI油墨常作为三电极体系中参比电极的印刷油墨。
4 印刷电子技术在生物传感器方面的应用
丝网印刷是印刷电子技术制作生物传感器的成功范例,是商业化大规模生产一次性电极的最主要技术。丝网印刷电极(SPEs)具有制作成本低、操作简单、生产速度快等特点[35]。根据丝网印刷机结构的不同,分平床型、间歇滚筒型和旋转型,决定一个传感器性能的通常是使用的油墨,不同结构的传感器使用的油墨有很大的区别。
4.1 丝网印刷设备的结构及工作原理
丝网印刷的工艺过程如图5所示[36]。将加载在图形化的网版上的油墨用刮板刮过,油墨就会被涂覆到基底上没有被丝网覆盖的部分,然后对已涂在基底上的油墨进行热处理固化,就完成了一次丝网印刷的过程。丝网是决定印刷电极的形状、厚度的主要因素,油墨品质会影响印刷薄膜的均匀性,从而对传感器性能产生影响。由于生物识别组分通常是酶、抗体、DNA等具有生物活性的物质,对温度比较敏感,在较高的温度下会失去活性,所以热处理的温度和生物识别组分的耐热性决定了生物识别组分连接到导电物上的温度要合适。

图5 丝网印刷过程示意图Fig.5 Schematic diagram of screen printing process
4.2 丝网印刷技术在生物传感器方面的应用
4.2.1 电化学生物传感器
电化学生物传感器是以电化学传感器作为基础电极与生物活性材料作用组成的生物传感器,简称生物电极。通常是用导电油墨采用丝网印刷技术制得基础电极,然后再与生物活性材料如酶、抗体、DNA、RNA等结合制成生物传感器。也可以用直接混合生物活性材料与油墨的方式、通过丝网印刷制备传感器,用于环境和食品分析[37]。
常见的电化学生物传感器包括工作电极、对电极和参比电极三电极体系。三电极体系的器件成本较低,且设计过程简单,但是电流会改变所包含的化学物质的活性而改变参比电极电压[38]。
4.2.2 半导体生物传感器
半导体生物传感器又称作生物场效应晶体管。丝网印刷制作的生物场效应晶体管具有高灵敏性、优异的生物相容性和灵活性等优点,是理想的高性能一次性生物传感器[39]。但是其结构尺寸通常较小,印刷难度较大,目前印刷电子技术在这种生物传感器制作方面的研究报道较少,但这是一类很有发展前景的传感器。
4.3 喷墨印刷技术在生物传感器方面的应用
喷墨印刷是一种非接触印刷,对基底材料的要求相对较低。喷墨印刷的优点是电极制作过程无需制版,可以通过计算机精确控制来印刷复杂图案的电极,具有成本低、制作简便、分辨率高、快速、重现性好、灵活、无触点、废墨量少等优点[40]。与丝网印刷技术相比,喷墨印刷可以精确地控制电极涂层的厚度、选择电极构型的自由度大、更可以制作个性化图案的印刷电极。缺点是制作大面积电极没有优势。Petri Ihalainen等[41]研究了喷墨印刷技术在普通纸上印刷Au电极,在电极表面形成生物组分识别层,成功制备了纸基生物传感器。Weng等人[42]通过喷墨印刷在电极表面沉积PPy(聚吡咯)纳米粒子和选择透过性乙基纤维素薄膜保护层对电极进一步优化,在4 ℃下干燥贮藏30 d后仍能保持初始灵敏度的90%以上。
喷墨印刷最突出的优点是油墨的利用率高。因此,在传感器的基础研究和原型器件制作阶段,采用喷墨印刷技术是合适的,尤其是油墨成本高时喷墨印刷技术制备传感器就更具有优势。
4.4 其他电子印刷技术在生物传感器方面的应用
其他可用于生物传感器制作的印刷技术还包括微接触印刷(Micro-Contact Printing)和卷对卷印刷技术(Roll-to-Roll Printing)。微接触印刷快速简单且操作条件要求不苛刻,但是印刷的尺寸较小,油墨的扩散对印刷电极的质量影响很大。卷对卷印刷包括柔性版印刷、凹版印刷和纳米压印。
4.4.1 微接触印刷技术
微接触印刷技术是先通过光学或电子束光刻得到电极模板,压模材料的化学前体在模板中固化,聚合成型后从模板中脱离,便得到了微接触印刷所要求的压模,常用材料是PDMS(聚二甲基硅氧烷)。微接触印刷是制作微型生物传感器的一种有效印刷技术,工作原理如图6所示[43]。Volcke等人[44]在生物传感器的制作过程中采用微接触印刷技术可方便的将蛋白质从Si表面转移到玻璃或聚合物的表面。
图6 使用PDMS印章功能化纳米机电系统的过程Fig.6 Process of functionalized with PDMS stamp nano-electromechanical systems
4.4.2 卷对卷印刷技术
卷对卷印刷技术是将滚轮圆周表面上的特征形状直接压印在软板的表面。其优点是将微电极直接在软板上压印成型,因此不会造成油墨的浪费。但是在压印滚轮的圆周表面加工微特征形状的电极模板非常困难,因此不适合制作具有很复杂形状的电极。
RoieYerushalmi 等人[45]报道了适用于刚性或柔性基底的纳米线的大面积印刷技术,并开发了以此技术在柔性基底上制作纳米线晶体管的方法。Reddy等人[46]采用凹版印刷技术在PET基底上印刷含Ag纳米粒子油墨制得了线宽200 μm的电极,并制作了相应的生物传感器。
图7[47]是卷对卷式的凹版印刷(Gravure)、柔性版印刷(Flexographic)、纳米压印(Nanoimprint)的印刷过程示意图。
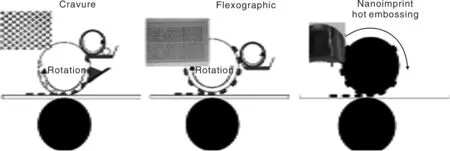
图7 卷对卷式的凹版印刷、柔性版印刷、纳米压印过程示意图Fig.7 Schematic diagram of gravure printing, flexographic printing, nanoimprint process for roll-to-roll type
5 结 语
随着人们对生活质量和生命健康的日益关注,环境、卫生、食品等安全问题越来越受到重视。生物传感器将在这些领域得到更广泛的应用,具有良好的市场前景[48]。生物传感器正快速向微型化、多功能化和低成本化的方向发展,因此,全丝网印刷制作生物传感器的实现为生物传感器的自动化生产开辟了新的途径。同时,无线传感器和无线网络工程的提出为生物传感器的发展开拓了新的方向。
参考文献 References
[1] Ahmet K, Esma A, Yeliz K.BiosensorsandTheirPrinciples[EB/OL]. (2008)[2014].www.intechopen.com.
[2] Iqbal M A, Gupta S G, Hussaini S S. A Review on Electrochemical Biosensors: Principles and Applications[J].AdvancesinBioresearch,2012, 3(4):158-164.
[3] Cass A E G, Davis G, Francis G D,etal. Ferrocene-mediated enzyme electrode for amperometric determination of glucose [J] . Analytical Chemistry,1984,56(4): 667-671.
[4] Anthony P F T. Biosensors: Sense and Sensibility [J].ChemicalSocietyReviews, 2013,42:3 184-3 196.
[5] Setti L, Fraleoni-Morgera A, Ballarin B,etal. An Amperometric Glucose Biosensor Prototype Fabricated by Thermal Inkjet Printing [J].BiosensorsandBioelectronics, 2005, 20(10): 2 019-2 026.
[6] Liu H C, Tsai C C, Wang G J. Glucose Biosensors Based on a Gold Nanodendrite Modified Screen-Printed Electrode [J].Nanotechnology, 2013, 24(21): 215 101.
[7] Nasri Z, Shams E. A Glucose Biosensor Based on Direct Electron Transfer of Glucose Oxidase Immobilized onto Glassy Carbon Electrode Modified with Nitrophenyl Diazonium Salt [J].ElectrochimicaActa, 2013, 112: 640-647.
[8] Tang H, Yan F, Lin P,etal. Highly Sensitive Glucose Biosensors Based on Organic Electrochemical Transistors Using Platinum Gate Electrodes Modified with Enzyme and Nanomaterials [J].AdvancedFunctionalMaterials, 2011, 21(12): 2 264-2 272.
[9] Chappell P H. Making Sense of Artificial Hands [J].JMedEngTechnol, 2011, 35(1): 1-18.
[10] Camacho C, Matías J C, Chico B,etal. Amperometric Biosensor for Hydrogen Peroxide, Using Supramolecularly Immobilized Horseradish Peroxidase on theβ-Cyclodextrin-Coated Gold Electrode [J].Electroanalysis, 2007, 19(24): 2 538-2 542.
[11] Hideshima S, Hinou H, Ebihara D,etal. Attomolar Detection of Influenza A Virus Hemagglutinin Human H1 and Avian H5 Using Glycan-Blotted Field Effect Transistor Biosensor [J].AnalyticalChemistry, 2013, 85(12): 5 641-5 644.
[12] Keow C M, Bakar F A, Salleh A B,etal. Screen-Printed Histamine Biosensors Fabricated from the Entrapment of Diamine Oxidase in a Photocured Poly (HEMA) Film [J].IntJElectrochemSci, 2012, 7: 4 702-4 715.
[13] Piermarini S, Volpe G, Esti M,etal. Real Time Monitoring of Alcoholic Fermentation with Low-Cost Amperometric Biosensors [J].FoodChemistry, 2011, 127(2): 749-754.
[14] Lee S, Fang H, Chen W. Amperometric Glucose Biosensor Based on Screen-Printed Carbon Electrodes Mediated with Hexacyanoferrate-Chitosan Oligomers Mixture [J].SensorsandActuatorsB:Chemical, 2006, 117(1): 236-243.
[15] Ohfuji K, Sato N, Hamada-Sato N,etal. Construction of a Glucose Sensor Based on a Screen-Printed Electrode and a Novel Mediator Pyocyanin from Pseudomonas Aeruginosa [J].BiosensorsandBioelectronics, 2004, 19(10): 1 237-1 244.
[16] Pemberton R M, Cox T, Tuffin R,etal. Microfabricated Glucose Biosensor for Culture Well Operation [J].BiosensorsandBioelectronics, 2013, 42: 668-677.
[17] Albanese D, Matteo D M, Alessio C. Screen Printed Biosensors for Detection of Nitrates in Drinking Water [J].ComputerAidedChemicalEngineering, 2010, 28: 283-288.
[18] Wcis1/o M, Compagnone D, Trojanowicz M. Enantioselective Screen-Printed Amperometric Biosensor for the Determination of d-Amino Acids[J].Bioelectrochemistry, 2007, 71(1): 91-98.
[19] Román L D T, Alonso-Lomillo M A, Domínguez-Renedo O,etal. GADH Screen-Printed Biosensor for Gluconic Acid Determination in Wine Samples [J].SensorsandActuatorsB:Chemical, 2014, 192: 56-59.
[20] Hirst N A, Hazelwood L D, Jayne D G,etal. An Amperometric Lactate Biosensor Using H2O2Reduction via a Prussian Blue Impregnated Poly(Ethyleneimine) Surface on Screen Printed Carbon Electrodes to Detect Anastomotic Leak and Sepsis [J].SensorsandActuatorsB:Chemical, 2013, 186: 674-680.
[21] Chen P, Peng Y, He M,etal. Sensitive Electrochemical Detection of Creatinine at Disposable Screen-Printed Carbon Electrode Mixed with Ferrocenemethanol [J].InternationalJournalofElectrochemicalScience, 2013(8):8 931-8 939.
[22] Liu S, Guo X. Carbon Nanomaterials Field-Effect-Transistor-Based Biosensors [J].NPGAsiaMaterials, 2012, 4(8): e23.
[23] Ilkhani H, Arvand M, Ganjali M R,etal. Nanostructured Screen Printed Graphite Electrode for the Development of a Novel Electrochemical Genosensor [J].Electroanalysis, 2013, 25(2): 507-514.
[24] Yang X, Xiao F B, Lin H W,etal. A Novel H2O2Biosensor Based on Fe3O4-Au Magnetic Nanoparticles Coated Horseradish Peroxidase and Graphene Sheets-Nafion Film Modified Screen-Printed Carbon Electrode [J].ElectrochimicaActa, 2013, 109: 750-755.
[25] Queirós R B, Guedes A, Marques P V S,etal. Recycling Old Screen-Printed Electrodes with Newly Designed Plastic Antibodies on the Wall of Carbon Nanotubes as Sensory Element for in situ Detection of Bacterial Toxins in Water [J].SensorsandActuatorsB:Chemical, 2013, 189: 21-29.
[26] Alvarado-Gámez A L, Alonso-Lomillo M A, Domínguez-Renedo O,etal. Vanadium Determination in Water Using Alkaline Phosphatase Based Screen-Printed Carbon Electrodes Modified with Gold Nanoparticles [J].JournalofElectroanalyticalChemistry, 2013, 693: 51-55.
[27] Ahmad R, Vaseem M, Tripathy N,etal. Wide Linear-Range Detecting Nonenzymatic Glucose Biosensor Based on CuO Nanoparticles Inkjet-Printed on Electrodes [J].AnalyticalChemistry, 2013, 85(21): 10 448-10 454.
[28] Ekabutr P, Chailapakul O, Supaphol P. Modification of Disposable Screen-Printed Carbon Electrode Surfaces with Conductive Electrospun Nanofibers for Biosensor Applications [J].JournalofAppliedPolymerScience, 2013,3 885-3 893.
[29] Phongphut A, Sriprachuabwong C, Wisitsoraat A,etal. A Disposable Amperometric Biosensor Based on Inkjet-Printed Au/PEDOT-PSS Nanocomposite for Triglyceride Determination [J].SensorsandActuatorsB:Chemical, 2013, 178: 501-507.
[30] Karuwan C, Sriprachuabwong C, Wisitsoraat A,etal. Inkjet-Printed Graphene-Poly(3,4-Ethylenedioxythiophene):Poly(Styrene-Sulfonate) Modified on Screen Printed Carbon Electrode for Electrochemical Sensing of Salbutamol [J].SensorsandActuatorsB:Chemical, 2012, 161(1): 549-555.
[31] Phongphut A, Sriprachuabwong C, Wisitsoraat A,etal. A Disposable Amperometric Biosensor Based on Inkjet-Printed Au/PEDOT-PSS Nanocomposite for Triglyceride Determination [J].SensorsandActuatorsB:Chemical, 2013, 178: 501-507.
[32] Wagner M, Lisak G, Ivaska A,etal. Durable PEDOT:PSS Films Obtained from Modified Water-Based Inks for Electrochemical Sensors[J].SensorsandActuatorsB:Chemical, 2013, 181: 694-701.
[33] Longinotti G, Lloret P, Ybarra G,etal.Screen-PrintedElectrochemicalBiosensorsBasedonMagneticCore-ShellNanoparticles[EB/OL].(2008)[2014].www.google.com.
[34] Bettazzi F, Enayati L, Sánchez I C,etal. Electrochemical Bioassay for the Detection of TNF-αUsing Magnetic Beads and Disposable Screen-Printed Array of Electrodes [J].Bioanalysis, 2013, 5(1): 11-19.
[35] Ricci F, Amine A, Palleschi G,etal. Prussian Blue Based Screen Printed Biosensors with Improved Characteristics of Long-Term Lifetime and pH Stability [J].BiosensBioelectron, 2003, 18(2-3): 165-74.
[36] Lee D H, Choi J S, Chae H,etal. Screen-Printed White OLED Based on Polystyrene as a Host Polymer [J].CurrentAppliedPhysics, 2009, 9(1): 161-164.
[37] Tudorache M, Bala C. Biosensors Based on Screen-Printing Technology, and Their Applications in Environmental and Food Analysis [J].AnalyticalandBioanalyticalChemistry, 2007, 388(3): 565-578.
[38] Mónica H C, Carlos A G V, Giaan A A R,etal. Behavior of Two and Three Electrode Configuration and Different Mediators in Working Electrode on Development of Disposable Screen-Printing Biosensors for Determination of Free Cholesterol[J].ChemSoc, 2013,57(1):47-53.
[39] Liao C, Yan F. Organic Semiconductors in Organic Thin-Film Transistor-Based Chemical and Biological Sensors [J].PolymerReviews, 2013, 53(3): 352-406.
[40] Komuro N, Takaki S, Suzuki K,etal. Inkjet Printed (Bio)Chemical Sensing Devices [J].AnalyticalandBioanalyticalChemistry, 2013, 405(17): 5 785-5 805.
[41] Ihalainen P, Majumdar H, Viitala T,etal. Application of Paper-Supported Printed Gold Electrodes for Impedimetric Immunosensor Development [J].Biosensors, 2013, 3(1): 1-17.
[42] Weng B, Morrin A, Shepherd R,etal. Wholly Printed Polypyrrole Nanoparticle-Based Biosensors on Flexible Substrate [J].JournalofMaterialsChemistryB, 2014, 2(7): 793.
[43] Gonzalez-Macia L, Morrin A, Smyth M R,etal. Advanced Printing and Deposition Methodologies for the Fabrication of Biosensors and Biodevices [J].Analyst, 2010, 135(5): 845-867.
[44] Volcke C, Gandhiraman R P, Basabe-Desmonts L,etal. Protein Pattern Transfer for Biosensor Applications [J].BiosensorsandBioelectronics, 2010, 25(6):1 295-1 300.
[45] Yerushalmi R, Jacobson Z A, Ho J C,etal. Large Scale, Highly Ordered Assembly of Nanowire Parallel Arrays by Differential Roll Printing [J].AppliedPhysicsLetters, 2007, 91(20): 1-4.
[46] Reddy A S G, Narakathu B B, Atashbar M Z,etal. Gravure Printed Electrochemical Biosensor [J].ProcediaEngineering, 2011, 25: 956-959.
[47] Salomon S, Leichle T, Dezest D,etal. Arrays of Nanoelectromechanical Biosensors Functionalized by Microcontact Printing [J].Nanotechnology, 2012, 23(49): 1-8.
[48] Chappell P H. Making Sense of Artificial Hands [J].JMedEngTechnol, 2011, 35(1): 1-18.
