手足口病患儿免疫球蛋白及补体检测临床分析
2014-08-28蒙江梅
蒙江梅
·论著·
手足口病患儿免疫球蛋白及补体检测临床分析
蒙江梅
目的探讨手足口病患儿免疫球蛋白和补体的变化情况,为临床疾病的诊治提供有价值的信息。方法选取儿科收治的200例手足口病患儿为观察组,另外选取同期在我院行健康体检的健康儿童30例为健康对照组。对比2组患儿的免疫球蛋白[免疫球蛋白A(IgA)、免疫球蛋白G(IgG)以及免疫球蛋白M(IgM)]以及补体(C3、C4)的浓度变化情况。结果观察组患儿IgA以及IgG水平均显著低于健康对照组(t=8.39、14.96,均P<0.05),而2组受试者IgM水平的对比,其差异无统计学意义(P>0.05);观察组C3以及C4水平均显著低于健康对照组(t=12.97、6.52,均P<0.05)。结论检测手足口病患儿的免疫球蛋白和补体等相关指标对手足口病的诊断以及治疗方案的制定有一定的指导意义。
手足口病;免疫球蛋白;补体
手足口病是由肠道病毒引起的儿童传染性疾病,其中以柯萨奇病毒A16型(Cox A16)以及肠道病毒71型(EV 71)的感染最为常见[1]。本病是儿科临床上的常见疾病,具有较强的传染性,常群体性发病。大多数患儿感染后仅表现为发热,手、足、口腔黏膜处出现疱疹以及咳嗽、流涕等上呼吸道感染的症状,经过适当抗感染、营养支持治疗后,病情可痊愈。但是有少数重症手足口病的患儿可并发心肌炎,脑炎、心力衰竭而死亡[2]。因此,手足口病患儿随着其病情变化的不同,疾病的预后可出现巨大差异。致病微生物入侵人体后,激活人体的免疫系统做出免疫应答[3],因此,本研究探讨手足口病患儿的免疫球蛋白以及补体的变化情况,以期为临床诊治手足口病提供有价值的信息,报道如下。
1 资料与方法
1.1 一般资料 选取我院自2011年7月到2012年7月期间儿科收治的手足口病患儿共计200例为观察组。其中男125例,女75例;年龄5个月~10岁,平均年龄(2.82±0.71)岁,同时选取同期在我院体检中心行健康体检的健康儿童30例为健康对照组。其中,男19例,女11例;年龄6个月~12岁,平均年龄(2.91±0.81)岁,2组患儿性别比、年龄差异无统计学意义(P>0.05),具有可比性。本研究的实施均获得所纳入2组患儿家长的知情同意,并得到医院伦理委员会批准。
1.2 诊断标准 手足口病参照中华人民共和国卫生部制定的《手足口病诊疗指南(2010年版)》[4]中的相关标准进行诊断。所有手足口病患儿均出现手、足以及口腔黏膜处的疱疹,其中168例出现不同程度的发热症状。同时结合患儿的临床症状、体征以及相关的辅助检查结果,排除患有水痘、麻疹、风疹等出疹性疾病的患儿。
1.3 研究方法 所有患儿均在收治入院后,接受治疗之前,抽取外周静脉血送至检验科检测。免疫球蛋白的检测包括免疫球蛋白A(IgA)、免疫球蛋白G(IgG)以及免疫球蛋白M(IgM)。IgA、IgG以及IgM的检测采用美国雅培Ci16200全自动生化分析仪进行检测,免疫球蛋白检测试剂盒(免疫比浊法)由长春迪瑞医疗科技股份有限公司提供。补体检测指标包括C3以及C4,补体的检测采用免疫比浊法,补体检测试剂盒由宁波美康生物科技股份有限公司提供。本研究所有的检测步骤和方法均严格按照《全国临床检验操作规程》[5]以及相关的仪器和试剂说明书中的相关步骤进行操作。
1.4 观察指标 对比2组患儿的的免疫球蛋白(IgA、IgG以及IgM)以及补体(C3以及C4)的浓度水平。
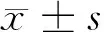
2 结果
2.1 2组患儿免疫球蛋白浓度的对比情况 观察组患儿IgA以及IgG水平均显著低于健康对照组(t=8.39、14.96,均P<0.05),而两组受试者IgM水平的对比,差异无统计学意义(P>0.05)。见表1。
表1 2组患儿免疫球蛋白浓度的对比情况

表1 2组患儿免疫球蛋白浓度的对比情况
组别IgAIgGIgM健康对照组(n=30)1.48±0.299.90±1.111.35±0.30观察组(n=200)0.91±0.33*7.81±1.79*1.37±0.19
注:与健康对照组比较,*P<0.05
2.2 2组患儿补体水平的对比情况 观察组C3以及C4水平显著低于健康对照组(t=12.97、6.52,均P<0.05)。见表2。
表2 2组患儿补体水平的对比情况

表2 2组患儿补体水平的对比情况
组别C3C4健康对照组(n=30)1.28±0.190.35±0.09观察组(n=200)1.01±1.66*0.25±0.17*
注:与健康对照组比较,*P<0.05
3 讨论
V肠道病毒感染是引起手足口病的原因,手足口病的高发人群以3岁以下的小儿为主,且发病年龄越小,病情相对越重[6]。随着儿童的生长发育,免疫功能的逐渐完善,对肠道病毒的抵抗能力逐渐增强,手足口病的威胁逐渐变小[7]。不同年龄段的人群,感染肠道病毒的临床症状不同,成年人感染后,常常没有临床症状或者仅表现出轻微的类似于上呼吸道感染的症状。而婴幼儿感染则可表现出典型的手、足以及口腔黏膜处的疱疹,一般经过相应的对症处理后,疱疹消退,疾病痊愈。但是有少数重症患儿可并发心肌炎、脑炎等,此类患儿的预后很差,常有重症手足口病患儿抢救无效死亡的报道[8]。
对于手足口病患儿的不同转归,姜涛等[9]的研究认为,免疫应答是导致不同临床结局的重要原因之一。体液免疫是机体抵抗病毒感染的重要防线,IgM和IgG对病毒感染的扩散起到抑制作用,同时,机体接触病毒后,IgG可对该病毒免疫,同种病毒再次入侵时,可迅速清除,对机体起到保护作用[10]。在本研究中,观察组患儿的IgA、IgG、C3以及C4水平均显著低于健康对照组,而IgM的水平和健康对照组对比,其差异没有统计学意义,这和胡淑琴等[11]的相关研究结果基本一致。
免疫球蛋白IgM是病原体初次入侵后,机体发生体液免疫应答时产生的免疫球蛋白,是机体免疫应答早期产生的抗体,而免疫球蛋白IgG则是再次发生体液免疫应答时产生的抗体,具有吞噬病原体、中和细菌毒素等作用,在机体的体液免疫应答中发挥了重要的作用[12]。检测IgM水平能够有助于手足口病早期感染的诊断,而检测IgG水平则有助于判断患儿机体的免疫功能的强弱[13]。在本研究中,手足口病患者的IgG水平显著低于健康对照组,这说明手足口病患者机体对致病病毒的免疫功能较弱。而2组受试者的IgM水平没有显著的统计学差异,这可能和患儿的免疫系统尚未发育完善有关[14]。手足口病患儿IgA是由于病毒对其机体免疫功能的刺激而产生的免疫球蛋白。IgA在黏膜处发挥重要的抗病原微生物、抗细菌毒素的作用,是黏膜屏障的重要组成部位,对机体防御病原体入侵起到重要的作用[15]。本研究中,观察组患儿的IgA水平显著低于健康对照组,这说明观察组患者的粘膜屏障功能较差,这就为病原体的入侵创造了有利条件。补体是一种活化后具有酶活性的蛋白质,能够调节机体的免疫功能,协助抗体发挥免疫应答[16]。在本研究中,观察组患儿的C3、C4水平均显著低于对照组,这不利于抗体发挥免疫应答,对病毒的清除,病情的康复不利。因此,在临床诊治手足口病的过程中,要注意检测患儿免疫球蛋白、补体水平的变化情况,并注意调节,提高患儿机体的免疫功能,以提高临床疗效,促进病情的康复,防止发生重症。
综上所述,检测手足口病患儿的免疫球蛋白和补体等相关指标对手足口病的诊断以及治疗方案的制定有一定的指导意义。
1 王利花,李军.手足口病的流行病学及病原学研究进展.中国卫生事业管理,2010,27:419-421.
2 吴亦栋,尚世强,陈志敏,等.手足口病病原体流行特征分析及临床意义.中华儿科杂志,2010,48:535-539.
3 杨晓泉,叶晓明,农少云,等.手足口病患儿的免疫功能.实用儿科临床杂志,2011,26:1764,1768.
4 中华人民共和国卫生部.手足口病诊疗指南(2010年版).国际呼吸杂志,2010,30:1473-1475.
5 中华人民共和国卫生部医政司主编.全国临床检验操作规程.第3版.南京:东南大学出版社,2006.619.
6 刘民,刘闯.手足口病的流行病学特征及预防.中国皮肤性病学杂志,2010,24:591-594.
7 周涛,马力忠,付四毛,等.手足口病患者体液免疫与病情转归的相关性分析.广东医学,2010,31:2434-2435.
8 孙建伟,许汴利,郭万申,等.手足口病重症病例危险因素探索与死亡病例特征分析.现代预防医学,2010,37:213-215.
9 姜涛,李双杰,于四景,等.危重型和重型手足口病患儿免疫功能的变化.医学临床研究,2012,29:511-513.
10 陈大宇,黄献文.小儿手足口病免疫球蛋白与超敏C反应蛋白的检测分析.中国全科医学,2011,14:476-477.
11 胡淑琴,李娜,王绪韶,等.手足口病患儿免疫球蛋白及补体检测的临床意义.中国中西医结合儿科学,2012,19:433-434.
12 周海兰,李华东.EV71感染的手足口病患儿体液免疫临床分析.中华实验和临床感染病杂志(电子版),2011,27:208-211.
13 陈瑾,汪祝萍.EV71型手足口病患儿体液免疫功能分析.全科医学临床与教育,2013,11:44-45,49.
14 陈依平,魏寿忠.手足口病患儿体液免疫检测分析.中国医学创新,2011,20:134-135.
15 颜君.肠黏膜生物屏障的研究进展.医学综述,2011,17:3246-3247.
16 方跃华,王安平,陈如花,等.免疫球蛋白及补体检测在感染肠道病毒71手足口病患儿中的临床意义.齐齐哈尔医学院学报,2013,34:329-330.
10.3969/j.issn.1002-7386.2014.07.021
533600 广西壮族自治区田阳县人民医院儿科
R 725.125.7
A
1002-7386(2014)07-1015-02
2013-11-17)
