双层膜结构对MBR中膜过滤性能与污染物去除的影响
2014-08-28张秋云张泽锋
江 峰, 李 腾, 张秋云, 张泽锋
(华南师范大学化学与环境学院,广州 510006)
近年来,具有处理效率高、出水水质好、占地面积小、泥水易分离等特点[1-2]的膜生物反应器(简称MBR)在污水处理领域成为研究热点.然而,当前制约MBR发展的核心问题是膜污染问题[3-4].膜污染机理尚未明确,研究学者普遍认为,导致膜污染的是不可逆的膜孔堵塞,其污染物是胞外多聚糖(简称EPS)[3,5-6].EPS是微生物的代谢产物,LEE等[7-8]发现EPS分泌过程存在“群体感应”,即细胞密度越大EPS分泌速度越快.在MBR的膜上,即使有曝气冲刷也会存在一层泥饼层(cake layer).泥饼层主要由微生物在膜上堆积而成,其一方面起到降解污染物的作用[9],另一方面其紧密的细胞结构也导致EPS加速分泌并直接附着在膜表面,从而造成严重的膜污染[10].曝气冲刷只能控制泥饼层形成速度,却不能有效去除EPS,因此一旦形成膜污染必须要进行化学或物理清洗,这严重影响了膜的有效工作时长和寿命.
为了控制和减缓膜污染并提高MBR的处理效率,笔者设计了一种双层膜元件,在MBR小试反应器中,其可以分隔超滤膜和泥饼层,一方面增厚泥饼层形成生物膜以提高MBR中的有机物和氨氮去除能力,同时避免泥饼层分泌的EPS直接附着在超滤膜上,减少膜上EPS累积以实现控制膜污染、提高膜工作寿命.
1 材料与方法
1.1 双层膜元件制作
制作一个300 mm×200 mm的双层平板膜元件(图1),内层是300 mm×200 mm的聚偏氟乙烯(PVDF)超滤膜(上海斯纳普公司出品,膜孔径0.1 μm);外层是300 mm×200 mm×10 mm的海绵层,外层可以隔离、截留活性污泥颗粒实现分级过滤,减轻超滤膜上的微生物直接沉积和EPS分泌,减缓膜污染的发生;海绵层为微生物生长提供了载体,有利于生物膜的形成,提高有机物和氨氮的降解速率.
膜元件内置塑料导流板和导流布,超滤膜和海绵以防水粘合剂沿四周固定并密封.此膜元件有双面,双面均为双层膜结构.膜元件上方有抽吸口(抽吸口的直径为8 mm),以抽吸泵连接进行抽滤.
作为对比,制作了一个不具有外层海绵膜的传统单层平板膜元件,其结构与双层膜元件一致.
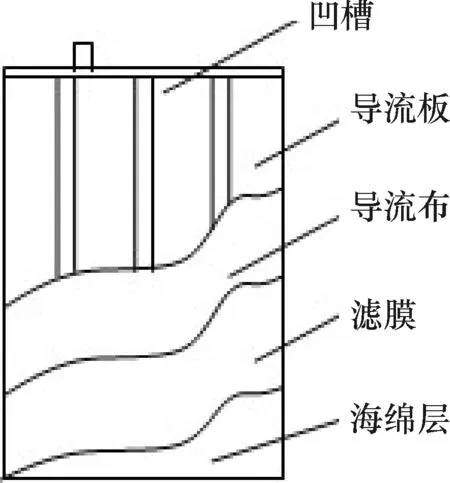
图1 双层膜结构示意图
Figure 1 Schematic diagram of the double layer membrane module unit
1.2 实验装置及膜元件性能分析
为测试双层膜元件的性能与效果,建立了一个30 L的内置式MBR反应器(图2).将传统膜与双层膜元件先后放入MBR反应器运行,测定进出水的各项指标.前后2次对比实验的各项条件保持一致,混合液悬浮固体浓度(MLSS)维持在4 000 mg/L,水力停留时间24 h,曝气通量为4 mL/min.由于膜生物反应器水力停留时间(SRT)一般比较长,这有利硝化菌生长,提高处理效果[11-14],因此本实验中污泥停留时间为31 d.进水采用人工生活污水,其储液成分如表1,经5倍稀释后作为进水,进水COD平均值为386.1 mg/L,进水氨氮45.6 mg/L.每次实验持续时间为336 h,期间膜元件不进行物理或化学清洗.实验过程中,每日取水样测出水CODCr、氨氮浓度,并监测过膜通量(TMP)的变化以评估膜工作性能,作为膜污染判断指标.实验结束时,通过荧光染色并用荧光显微镜进行观测膜污染情况,同时测定2种膜表面的SS(悬浮固体浓度)、VSS(挥发性悬浮固体浓度)、EPS(胞外聚合物)含量.荧光染色方法如下:在每次实验结束时,截取传统单层膜、新型双层膜外层、内层膜上的样本各3块(0.1 cm×0.1 cm),分别以The LIVE/DEAD BacLight试剂染色,避光15 min,在荧光显微镜(Nikon eclipse 50i)观察活、死细胞在膜表面的分布情况.同时把剩余膜表面的泥饼层刮下到聚乙烯瓶,然后分别取样测膜面SS、VSS以及EPS.
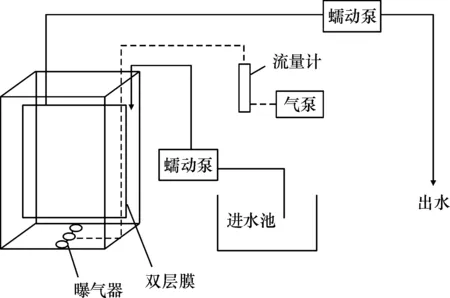
图2 MBR反应器系统示意图
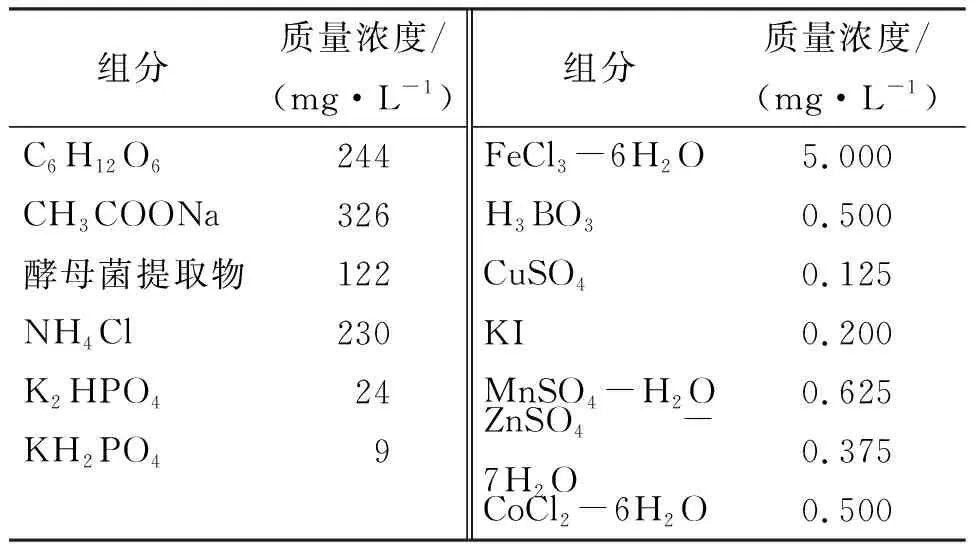
组分质量浓度/(mg·L-1)组分质量浓度/(mg·L-1)C6H12O6244FeCl3-6H2O5.000CH3COONa326H3BO30.500酵母菌提取物122CuSO40.125NH4Cl230KI0.200K2HPO424MnSO4-H2O0.625KH2PO49ZnSO4-7H2O0.375CoCl2-6H2O0.500
1.3 污染指标分析方法
依据文献[15],采用重铬酸钾法(GB 11914-1989)测化学需氧量(CODCr),混合液悬浮固体浓度(MLSS) 与混合液挥发性悬浮固体浓度(MLVSS)采用重量法(GB 11901-1987),NH4-N采用纳氏试剂分光光度法(HJ 535-2009),总氮采用碱性过硫酸钾消解紫外分光光度法(HJ 636-2012),EPS提取用NaOH-甲醛法[16],EPS测定用蒽酮比色法[17],活、死细菌比例图用The LIVE/DEAD BacLight试剂染色和荧光测定法[18]. 过膜压差(TMP)采用真空压力表获取.采用的仪器有V-5000上海精密科技有限公司的分光光度计,UV-3100PC型上海美谱达仪器有限公司的紫外可见光分光光度计,2021型余姚市恒温箱厂的烘箱,KSW-5-12S沪越科学仪器厂的马弗炉,尼康Eclipse 50i显微镜.
2 结果与讨论
2.1 双层膜对污染物处理能力
制备的双层膜结构比传统的单层膜结构具有更好的污染物降解/阻隔能力.装备双层膜的MBR反应器中,有机物、氨氮、总氮去除率都高于装备传统单层膜的MBR(图3).在CODCr去除率方面,超滤膜对有机物的去除效率非常高,海绵膜的存在对于CODCr去除率影响不大,2种膜对CODCr的去除/阻隔率都达到了98%以上.其中双层膜为98.6%±0.9%,略高于传统单层膜的98.4%±0.6%.氨氮去除率方面,装备双层平板膜的MBR出水氨氮去除率达到78.3%±9.1%,而传统单层平板膜的平均出水氨氮去除率只有65.4%±9.4%.装备双层平板膜的MBR出水总氮去除率达到41.08%±8.2%,而传统单层平板膜的平均出水总氮去除率只有28.26%±7.8%.表明双层膜元件外层的海绵层为生物膜生长提供了适宜环境,有利于硝化菌的生长,使污水在穿透填料层时进一步得到了硝化处理.
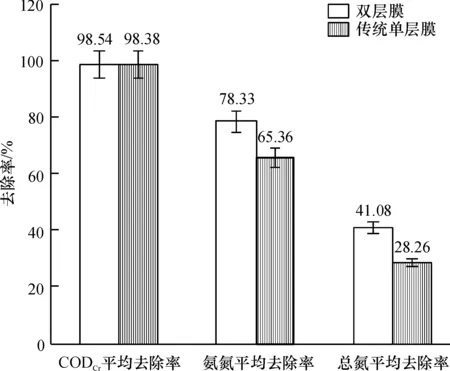
图3 装备2种膜组件的MBR反应器对CODCr和氨氮、总氮处理效率
Figure 3 CODCr, ammonia and TN removal efficiencies of MBR with two types of membrane module units
2.2 双层膜控制污染效果
在反应器运行过程中(图4),双层膜元件的TMP在336 h的运行过程中增长平缓,而传统单层膜元件在运行200 h之后即出现TMP跃升现象.按照Cho[19]和Zhang等[20]提出的理论,MBR的膜污染过程大致用过膜压差(TMP)跃升阶段表示:第一阶段,TMP短时间快速上升期,此时膜上泥饼层逐渐形成;第二阶段,TMP平缓上升,此阶段泥饼层基本稳定,EPS开始不断积累;阶段三,TMP快速跃升期,此时EPS累积超过临界值,膜污染正式形成,必须采取化学或物理手段进行清洗.在此3阶段中,第2阶段是膜工作的主要阶段,而EPS累积速率直接影响了TMP上升速度,即影响了第二阶段的时长.
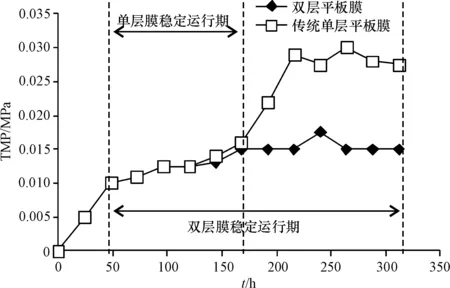
图4 装备2种膜元件的MBR运行过程中的TMP变化
Figure 4 TMP variations during MBR operations with two types of membrane module units
图4显示,2种膜元件在运行50 h时完成了第一阶段.此后的第二阶段是MBR稳定运行的阶段,TMP缓慢上升.对于传统单层膜元件,这个阶段仅仅维持了120 h,随即出现TMP跃升,表明膜污染已经发生,此时过滤性能大幅下降.而本研究制作的双层膜元件则显示出较强的抗污染能力,其第二阶段长达264 h,到实验结束时MBR仍处于稳定运行状态.从这一点上看,双层膜元件的稳定工作时长比传统单层膜元件延长了120%.
在传统单层膜的TMP出现跃升时,膜通量比初始通量衰减了约70%,实验结束时共衰减了80%.平均来看,单层膜上的平均通量衰减速率是双层膜的通量衰减速率的1.3倍. 双层膜结构确实有效延缓膜污染的发生,延长膜的有效工作时长,这应归因于双层结构对于活性污泥的阻隔,减少了EPS在超滤膜上的直接附着.
图5表明,双层膜结构下,大多数的SS、VSS沉积在外层海绵层中,有助于形成生物膜以提高脱氮效率.这就是为何使用双层结构膜元件的MBR具有更好的脱氮效果的原因.双层膜的内层PVDF膜面上泥饼层的EPS质量浓度为(1.03±0.012)g/m2比传统膜(1.28±0.014) g/m2低20%.同时,双层膜内层膜面SS和VSS分别为(0.82±0.08)g/L,(0.6±0.05)g/L都显著低于传统单层膜面的(1.96±0.18)g/L和(1.13±0.13)g/L,也有效表明双层膜结构能减少PVDF膜面的泥饼层沉积和EPS累积.
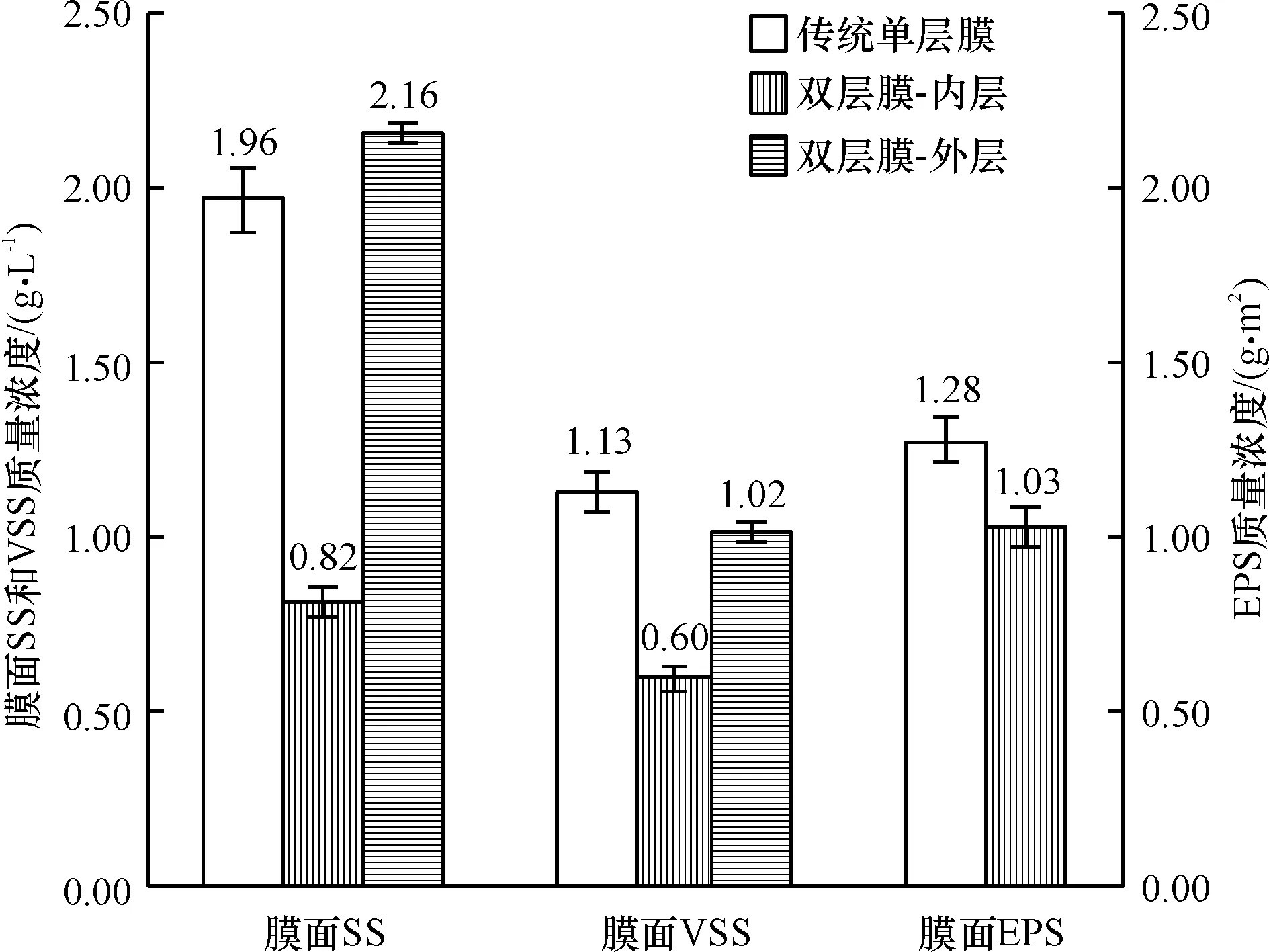
图5 运行336 h后2种膜元件表面的SS、VSS、EPS质量浓度
Figure 5 SS, VSS, EPS on membrane surfaces of two types of membrane module units after 336 hours operation
在膜污染过程中,膜面污染可分为可逆和不可逆2种类型,可逆的主要由泥饼层导致,这可以通过反冲、曝气的方式进行去除;不可逆的膜污染主要是EPS对膜孔的堵塞导致,这以物理方法无法去除,只能以酸洗、碱洗等方式进行部分恢复[3].因此,在膜污染过程中,关键是要控制EPS在膜上的累积,延缓不可逆污染的过程.图5已表明,双层结构可以有效地降低超滤膜表面的 SS、VSS和EPS累积,表明可逆和不可逆的膜污染都得到了控制.
Live&Dead试剂可以对所有活细胞和死细胞分别染色,其结果在荧光显微镜下会显示为绿色和红色.当双图重叠,就可以看出活细胞、死细胞在膜上的分布.分别用Baclight Live & Dead试剂对2种膜的表面进行平面和剖面进行荧光原位染色、并使用荧光显微镜进行成像.图6可见,传统膜的红色更深,表明死细胞更多.由于细胞死亡过程会释放EPS,因此一般认为死细胞和EPS、膜污染有密切关系[21].而且,剖面图显示,双层膜内层的生物膜层厚度较小,这与膜面SS、VSS测定结果相符.结果表明,双层膜结构不但阻挡了活性污泥在聚偏氟乙烯(PVDF)膜表面的直接沉积,而且能减少PVDF膜面的细胞衰亡速率和EPS累积速率.这可能是因为,生物膜厚度越大则溶解氧传输阻力越高[1],生物膜底层细胞更容易死亡从而释放EPS.因此,当大多数活性污泥被阻挡在外层海绵中时,内层的PVDF膜表明生物膜更薄,有利于控制EPS累积,减慢不可逆膜污染的发展速度.
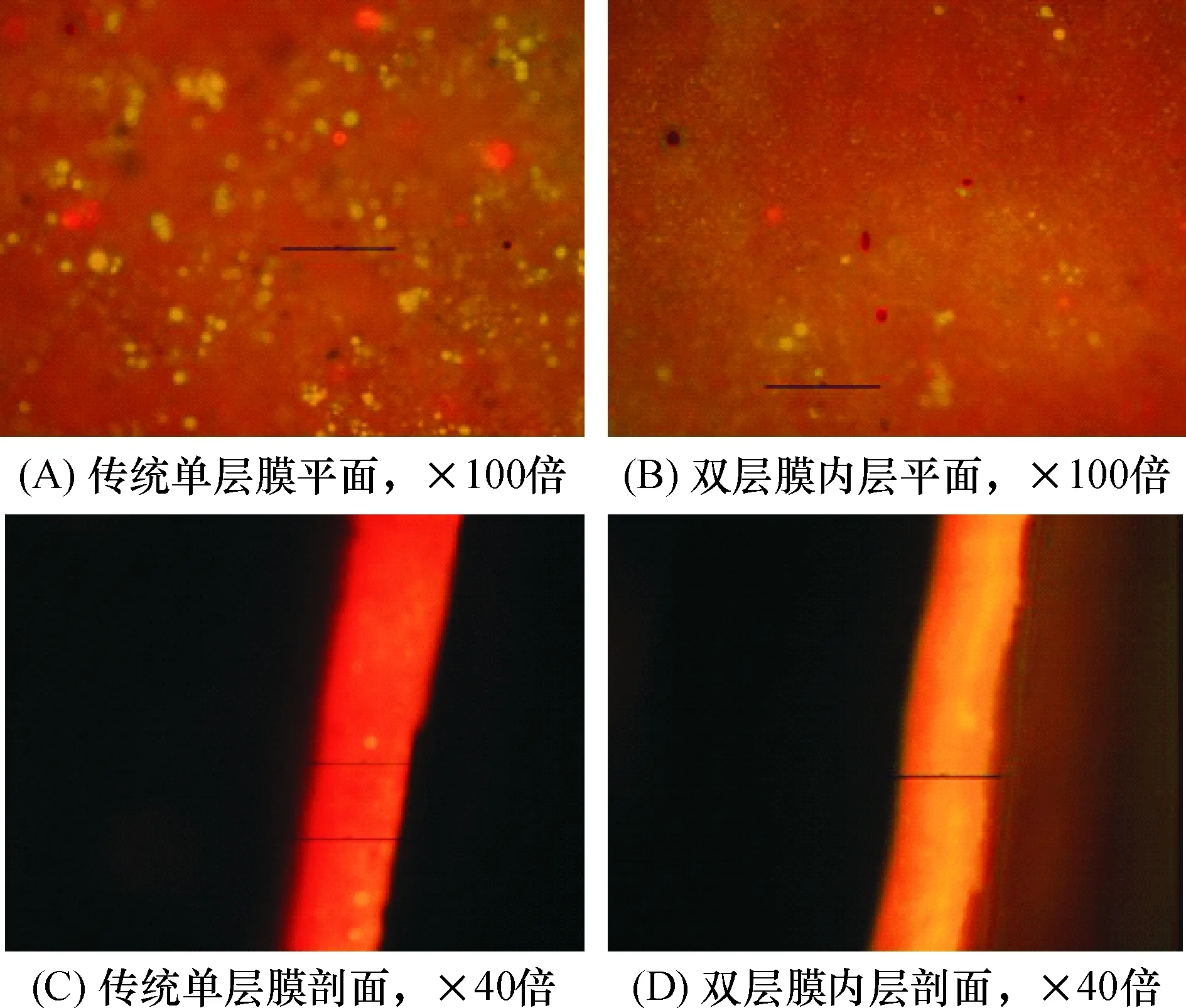
图6 2种膜元件的PVDF膜面的细胞FISH染色结果对比
Figure 6 Microscope images after FISH for the PVDF membrane of two membrane modules
上述结果表明,双层膜结构无论对可逆还是不可逆的膜污染都能控制效果,但双层膜结构也存在弊端.首先,海绵膜给生物膜提供了良好的附着生长环境,同时也限制了曝气冲刷对生物膜生长的控制作用.因此,当生物膜不断发展,最终的膜阻力仍会快速提升.其次,曝气冲刷无法直接作用于超滤膜表面,因此双层膜元件的内层超滤膜上仍有泥饼层形成并累积EPS.这些都意味着,双层膜元件仍需改进.在未来的研究中,我们将进一步改进其结构以继续提高膜污染控制效果.
3 结论
为了控制MBR的膜污染,本研究制作了一种双层膜元件.经过实验研究结果表明,双层膜元件在提高氨氮、总氮去除率方面对比传统单层超滤膜有明显提升,是在双层膜外层海绵层附着生长的生物膜的贡献.而且,装备双层膜元件的MBR与装备传统单层膜元件的MBR相比, TMP增长放缓,TMP跃升点显著后移,稳定运行时间延长了120%.同时,长期运行后,双层膜内层比传统单层PVDF膜面SS累积量减少58%,VSS累积量减少47%,EPS累积量降低20%,表明双层结构对于可逆和不可逆膜污染都有控制效果,荧光染色成像的结果上得到证实.这是由于双层膜组件的海绵层对MBR中有机颗粒物和活性污泥颗粒的阻隔,降低了超滤膜表面的泥饼层沉积,减少了活性污泥和EPS在膜上的直接附着,同时减缓了膜面生物膜中EPS的产生速率.以上研究表明,双层结构的膜元件对于控制膜污染、提高出水水质有积极作用.
参考文献:
[1] Miura Y, Watanabe Y, Okabe S. Significance of chloroflexi in performance of submerged membrane bioreactors (MBR) treating municipal wastewater[J]. Environmental Science & Technology, 2007, 41(22):7787-7794.
[2] Ng A, Kim A S. A mini-review of modeling studies on membrane bioreactor (MBR) treatment for municipal wastewaters[J]. Desalination, 2007, 212:261-281.
[3] Meng F G, Chae S R, Drewa A. Recent advances in membrane bioreactors (MBRs): Membrane fouling and membrane material[J]. Water Research,2009,43(6): 1489-1512.
[4] Le C P, Chen V, Fane T A G. Fouling in membrane bioreactors used in wastewater treatment[J]. Journal of Membrane Science,2006,284(1):17-53.
[5] Meng F G, Zhang H M, Yang F L, et al. Identification of activated sludge properties affecting membrane fouling in submerged membrane bioreactors[J]. Separation and Purification Technology,2006,51(1):95-103.
[6] Meng F G, Zhang H M, Yang F L et al. Effect of filamentous bacteria on membrane fouling in submerged membrane bioreactor[J]. Journal of Membrane Science,2006,272(1):161-168.
[7] Yeon K M,Cheong W S, OH H S, et al.Quorum sensing: A new biofouling control paradigm in a membrane bioreactor for advanced wastewater treatment[J]. Environmental Science & Technology,2009,43(2):380-385.
[8] Jiang W, Xia S, Liang J, et al. Effect of quorum quenching on the reactor performance, biofouling and biomass characteristics in membrane bioreactors[J]. Water Research,2012,47(1):187-196.
[9] Jiang F, Leung D H, Li S, et al. A biofilm model for prediction of pollutant transformation in sewers[J]. Water Research, 2009,43(13):3187-3198.
[10] Meng F G, Zhang H M, Yang F L, et al. Characterization of cake layer in submerged membrane bioreactor[J]. Environmental Science & Technology, 2007,41(11):4065-4070.
[11] Chaize S, Huyard A. Membrane bioreactor on domestic wastewater treatment sludge production and modeling approach[J]. Water Science & Technology, 1991, 23(7-9): 1591-1600.
[12] Muller E B, Stouthamerah, Van V H W, et al. Aerobic domestic waste water treatment in a pilot plant with complete sludge retention by cross-flow filtration[J]. Water Research, 1995, 29(4): 1179-1189.
[13] 黄霞,桂萍,范晓军,等.膜生物反应器废水处理工艺的研究进展[J]. 环境科学研究, 1998, 11(1): 40-44.
Huang X, Gui P, Fan X J, et al. Study on the progress of membrane bioreactor technology for wastewater treatment[J]. Research of Environmental Sciences, 1998, 11(1):40-44.
[14] 樊耀波, 王菊思. 水与废水处理中的膜生物反应器技术[J]. 环境科学, 1995, 16(5): 79-81.
Fan Y P, Wang J S. Membrane bio-reactor technology for the treatment of water and wastewater[J]. Environmental Science,1995,16(5):79-81.
[15] 国家环境保护总局.水和废水水和废水监测分析方法[M].4版.北京: 中国环境科学出版社,2002:210-284.
[16] Frølund B, Palmgren R, Keiding K, et al. Extraction of extracellular polymers from activated sludge using a cation exchange resin[J]. Water Research, 1996, 30(8): 1749-1758.
[17] Liu H, Fang H P. Extraction of extracellular polymeric substances (EPS) of sludges[J]. Journal of Biotechnology, 2002, 95(3): 249-256.
[18] Ziglio G, Andreottola G, Barbestis, et al. Assessment of activated sludge viability with flow cytometry[J]. Water Research, 2002, 36(2): 460-468.
[19] Cho B D, Fane A G. Fouling transients in nominally sub-critical flux operation of a membrane bioreactor[J]. Journal of Membrane Science, 2002, 209(2):391-403.
[20] Zhang J, Chua H C, Zhou J, et al. Factors affecting the membrane performance in submerged membrane bioreactors[J]. Journal of Membrane Science,2006,284(1):54-66.
[21] Hwang B K, Lee W N, Yeon K M, et al. Correlating TMP increases with microbial characteristics in the bio-cake on the membrane surface in a membrane bioreactor[J]. Environmental Science & Technology, 2008, 42(11): 3963-3968.
