树状聚合物功能化碳纳米管/钯纳米复合物的制备及其非酶葡萄糖传感应用
2014-08-24侯代红赖国松张海丽
侯代红,赖国松,张海丽
(湖北师范学院 化学化工学院, 湖北 黄石 435002)
树状聚合物功能化碳纳米管/钯纳米复合物的制备及其非酶葡萄糖传感应用
侯代红,赖国松,张海丽
(湖北师范学院 化学化工学院, 湖北 黄石 435002)
将树状聚合物(PAMAM) 通过共价反应嫁接在羧基化碳纳米管(CNTs)表面后用于钯纳米粒子(Pd NPs)的原位沉积,制备成CNTs-PAMAM/Pd NPs复合物。通过壳聚糖包埋将制备的该钯纳米复合物用于玻碳电极的修饰,并通过交流阻抗法和循环伏安法对电极性能进行表征和优化,制备成可用于葡萄糖的安培检测的非酶电化学传感器。实验表明,在最佳实验条件下该传感器可在较短时间内 (<3 s) 实现对葡萄糖的快速稳态安培响应,并可在从0.03 mmol/L至61.7 mmol/L较宽线性范围内实现对葡萄糖的准确测定,检出限为11.5 μmol/L。该传感器成本低廉,性质稳定,且具有较好的选择性和重复性,因而在实际应用中具有较好的发展前景。
非酶传感器;葡萄糖;化学修饰电极;碳纳米管;钯纳米粒子
葡萄糖的快速、准确检测在临床诊断和食品分析等领域中具有十分重要的意义。与比色法和荧光分析等方法相比,电化学方法由于具有较高的灵敏度、选择性和更低的检测成本,因而在葡萄糖的准确检测中得到了广泛的应用[1]。传统方法中,人们多采用基于酶固定技术而构建的酶生物传感器来实现葡萄糖的电化学检测[2~4]。但是酶相对较高的价格和外界条件对酶生物活性的影响在一定程度上限制了这些酶生物传感器的广泛应用。
近年来的研究表明,基于葡萄糖在化学修饰电极上的直接电催化氧化而构建起来的非酶传感器可以较好解决以上缺陷[5~7]。作为一种重要的贵金属纳米粒子,钯纳米粒子(Pd NPs) 因其良好的电催化性在非酶电化学氧化中得到了广泛的应用[8~10]。此外,碳纳米管(CNTs) 由于具有较大的比表面积和优良的电子传递能力,将其与Pd NPs相结合制备成纳米复合物后用于电极修饰,不仅可以大大提高电极表面Pd NPs的固定含量,而且可以很好的促进电催化响应电流的提高,从而大大提高传感器的分析性能[11]。本工作将具有128个氨基末端的五代聚酰胺树状聚合物(PAMAM)用于CNTs表面共价功能化后,成功实现了CNTs表面PdCl42-的吸附富集和Pd NPs的原位高含量负载。将制备的CNTs-PAMAM/Pd NPs纳米复合物用于化学电极修饰,较好实现了葡萄糖的非酶电化学传感。
1 实验部分
1.1试剂和仪器
多壁CNT (长1-2 μm,直径60-100 nm)购于深圳纳米港公司,PAMAM (五代)、壳聚糖(CS)、多巴胺、抗坏血酸、尿酸、碳二亚胺(EDC)和N-琥珀酰亚胺(NHS)购于Sigma-Aldrich 公司(美国),葡萄糖和氯钯酸钾购于上海国药化学试剂有限公司。其它试剂都为分析纯,使用前未经纯化处理。不同pH值的磷酸盐缓冲溶液(PBS)通过50 mmol/L 的NaH2PO4和Na2HPO4溶液配制而成。制备的钯纳米复合物的形貌通过FEI Quanta 400F扫描电子显微镜(SEM,美国)来进行表征,交流电化学阻抗实验在CHI 660E电化学分析仪上完成,其它电化学实验都在CHI 832 (上海辰华)上完成。
1.2CNTs-PAMAM/Pd NPs复合物的制备
CNTs-PAMAM/Pd NPs复合物的制备过程如图1所示。首先,根据文献[12]方法,将CNTs通过HNO3/H2SO4(v/v =3∶1) 超声处理得到羧基功能化CNTs。接下来,将1.0 mL 0.5 mg/mL羧基化CNTs通过EDC/NHS活化后与PAMAM共价反应得到CNTs-PAMAM复合物[13]。将所得的CNTs-PAMAM在5 mL水中分散后,向其中加入554 μL 20 mmol/L K2PdCl4搅拌吸附12h,然后逐滴加入100 μL新制的0.5 mol/L NaBH4,搅拌反应1h后离心、水洗三次,最后将所得的CNTs-PAMAM/Pd NPs复合物分散于1mL pH 7.0的PBS中保存待用。
1.3传感器的制备及电化学检测
将玻碳电极(GCE,直径3 mm) 用0.05 μm的氧化铝抛光成镜面,1∶1硝酸、无水乙醇和水超声洗净后,取5 μL以上CNTs-PAMAM/Pd NPs复合物分散液滴涂在其表面,室温下晾干后滴加3 μL 1.0 mg/mL的CS (1%醋酸溶液),室温晾干后即可得到所需的传感器。以制备的传感器为工作电极,铂柱为辅助电极,饱和甘汞电极(SCE)为参比电极组成三电极系统,进行交流电化学阻抗、循环伏安法和安培法实验。
2 结果与讨论
2.1CNTs-PAMAM/Pd NPs的制备及表征
实验采用羧基化CNTs作为载体,首先通过EDC/NHS偶联剂的作用下使富含氨基的PAMAM共价结合在CNTs表面,进而利用PAMAM优良的内部纳米级空腔和丰富的表面氨基来吸附富集高含量的PdCl42-,最后用NaBH4还原剂原位制备成富含高含量Pd NPs的CNTs纳米复合物。从图2所示的实验制备所得产物的SEM图片中,我们可以看到大量的纳米粒子附着在纳米管表面,这一结果证明了CNTs-PAMAM/Pd NPs复合物的成功制备。
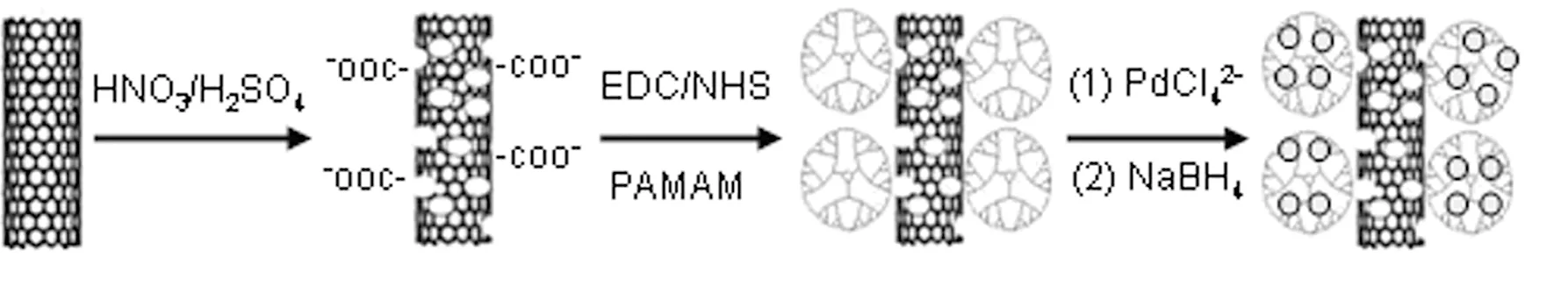
图1 CNTs-PAMAM/Pd NPs纳米复合物的制备过程
2.2传感器的制备及表征
将制备的CNTs-PAMAM/Pd NPs纳米复合物用于电极修饰,并通过电化学阻抗表征了该传感器的制备过程。从图3我们可以看出,CNTs-PAMAM/Pd NPs修饰电极电化学阻抗与裸电极相比明显降低,说明该纳米复合物的修饰可以有效的促进铁氰化钾探针在电极表面的电子传递速率。为了增加电极的稳定性,当进一步在该修饰电极表面覆盖一层CS后,其电化学阻抗的增加。该阻抗增加是由于电极表面修饰的非导电CS聚合物对电子传递的阻碍作用引起的,这一阻抗变化也证明了传感器的成功制备。
2.3传感器的电化学行为及催化响应
实验通过循环伏安方法考察了传感器的电化学行为及其对葡萄糖的电催化响应情况。从图4看出,当传感器在50 mmol/L pH 7.4 PBS中循环扫描时出现两对明显的氧化还原峰,一对峰在电位(-0.4,-0.6V)处对应于PdOH的氧化还原;另一对在(0.35,-0.1V)处的峰应该属于电极表面的Pd NPs在形成钯氧化物过程中表现出来的电化学行为[14]。当向底液中加入15 m mol/L葡萄糖后,我们可以观察到明显的氧化电流增加,这说明该CNTs-PAMAM/Pd NPs修饰电极对葡萄糖具有良好的电催化氧化作用。该传感器的催化机理为:

图2 CNTs-PAMAM/PdNPs的SEM图
Pd+OH-→PdOH+e-
PdOH+glucose→Pd+glucolactone
与此对比,CNT-PAMAM修饰电极在pH 7.4 PBS中没有表现出明显的氧化还原峰,当向底液中加入15 m mol/L葡萄糖后其响应电流也无明显的变化,这也证明了CNTs-PAMAM/Pd NPs修饰电极对葡萄糖的电催化氧化是由于纳米复合物上高含量Pd NPs的优良的电催化性能而引起的。因此基于该CNTs-PAMAM/Pd NPs修饰电极对葡萄糖良好的电催化氧化作用,可以方便的实现对葡萄糖的非酶电化学检测。
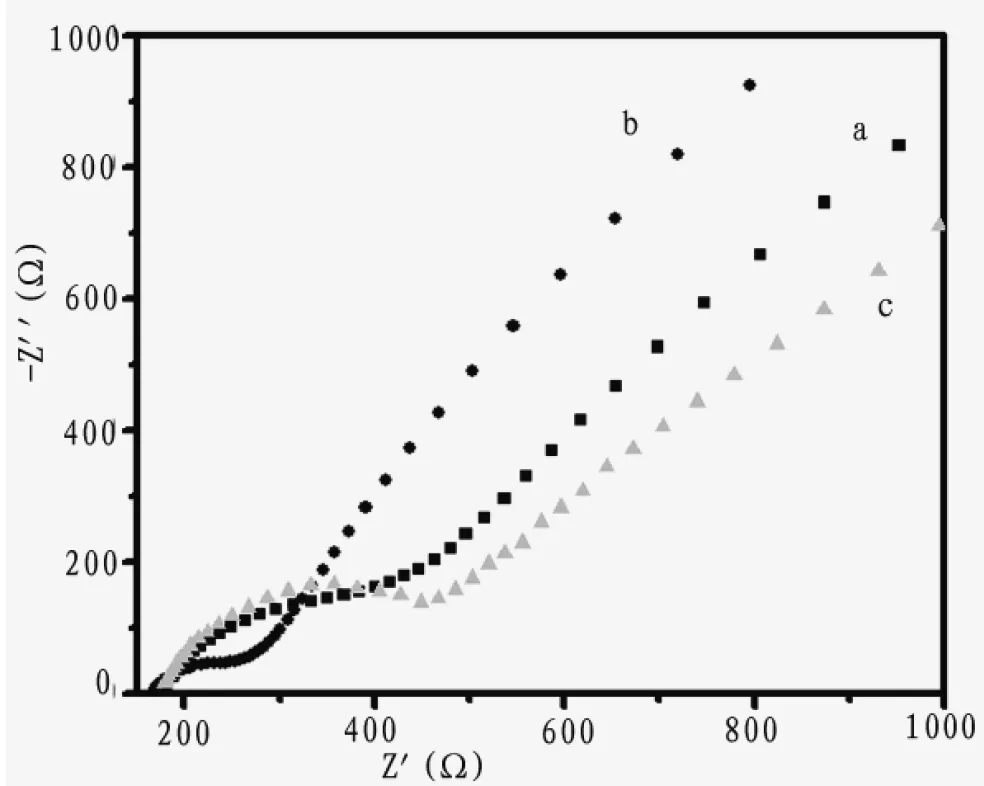
图3 裸电极GCE (a), CNTs-PAMAM/Pd NPs (b) 和 CNTs-PAMAM/Pd NPs/CS (c)修饰电极在含有5.0 m mol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1)中的0.1 mol/L KCl溶液中的交流阻抗图谱
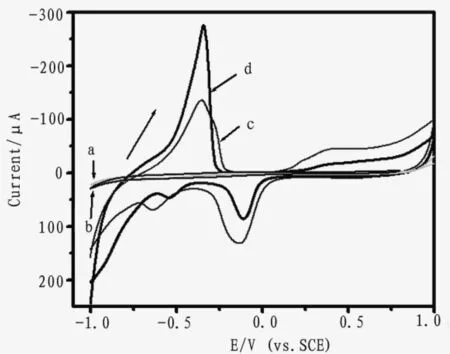
图4 CNT-PAMAM (a, b), CNTs-PAMAM/Pd NPs/CS (c, d) 修饰电极在pH 7.4 PBS (a, c)和含有15 m mol/L葡萄糖的pH 7.4 PBS (b, d)中的循环伏安图
为了得到最佳的电催化效果,实验进一步通过循环伏安法考察了传感器对不同pH值的50 m mol/L PBS中1 m mol/L葡萄糖的催化氧化电流的大小。结果表明,从溶液pH从6.2增加到7.4,传感器的催化氧化电流逐渐增大;当溶液pH高于7.4后,氧化峰电流反而随着pH的增加而减小。由于在pH 7.4的PBS中该传感器可以得到最大催化氧化电流,故实验选择pH 7.4作为本工作的最优条件。
2.4葡萄糖的安培检测
在搅拌条件下向底液中加入不同浓度的葡萄糖,通过稳态安培法考察了传感器在-0.1 V的安培响应。从图5可以看出,随着葡萄糖的加入,传感器立即产生明显的安培电流响应,其响应时间小于3s.在从0.03 m mol/L至11. 2 m mol/L和11.2 m mol/L至61.7 m mol/L较宽的浓度范围内,安
培响应电流与葡萄糖浓度成良好线性关系,其线性回归方程分别为I(μA)=7.2218 - 1.4824C
(m mol/L) (R=0.9993)和I(μA) =-1.5531-0.6705C(m mol/L) (R=0.9986),检出限为11.5 μmol/L.
2.5传感器的选择性、稳定性和重现性
实验通过向底液中加入一定浓度可能的干扰物,结合其安培响应考察了传感器的选择性。从图 6可以看出,当向底液中依次加入0.1 m mol/L 多巴胺、蔗糖、抗坏血酸和0.2 m mol/L 尿酸后,该传感器上没有产生无明显的安培电流响应。这一结果表明,这些物质对葡萄糖的测定没有明显干扰,该非酶传感器对葡萄糖具有较好的选择性。
实验还考察了传感器的重复性和稳定性。将同一支传感器用于1 m mol/L葡萄糖重复测定五次,其测定结果的相对标准偏差为2.3%;采用相同方法制备5支传感器用于1 m mol/L葡萄糖的安培检测,其测定结果的相对标准偏差为4.8%,说明传感器具有较好的重复性。此外,将制备的传感器置于4℃冰箱保存一个月之后,其响应电流不低于初始值88%,说明该传感器具有较好的稳定性。
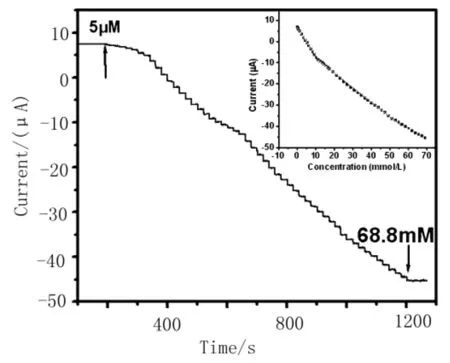
图5 CNTs-PAMAM/Pd NPs/CS修饰电极对葡萄糖的安培响应曲线及安培响应电流与葡萄糖浓度的线性关系(内插图)。工作电位:-0.1V
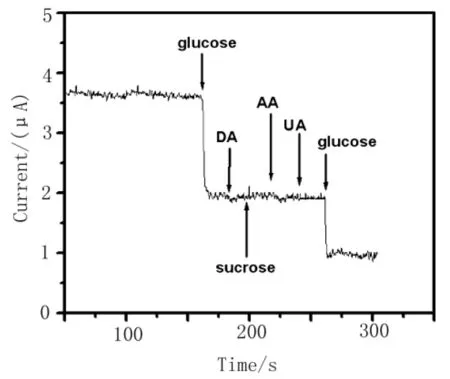
图6 检测条件下该传感器对1mmol/L葡萄糖,0.1mmol/L多巴胺,0.1mmol/L乳糖,0.1mmol/L抗坏血酸,0.1mmol/L尿酸和0.625mmol/L葡萄糖催化响应。
3 结论
基于羧基化CNTs表面的树状聚合物功能化,成功实现了CNTs上Pd NPs的高含量原位沉积。将制备的CNTs-PAMAM/Pd NPs纳米复合物用于电极修饰,可以较好实现对葡萄糖的电催化氧化氧化,进而发展了一种性能良好的非酶葡萄糖电化学传感器。该传感器对葡萄糖响应速度快,且具有较宽的线性范围和较低的检测限,稳定性和重复性良好,因而具有一定的应用前景。
[1]Wang J.Carbon-nanotube based electrochemical biosensors: A review [J]. Electroanalysis, 2005, 17 (1): 7~14.
[2]Wilson R, Turner A P F. Glucose oxidase: an ideal enzyme [J]. Biosensors and Bioelectronics, 1992, 7 (3): 165~185.
[3]Fu Y C, Li P H, Xie Q J, et al. One-pot preparation of polymer-enzyme-metallic nanoparticle composite films for high-performance biosensing of glucose and galactose [J]. Advanced Functional Materials, 2009, 19 (11): 1784~1791.
[4]Zhao H T, Ju H X. Multilayer membranes for glucose biosensing via layer-by-layer assembly of multiwall carbon nanotubes and glucose oxidase [J]. Analytical Biochemistry, 2006, 350 (1): 138~144.
[5]Park S, Chung T D, Kim H C. Nonenzymatic glucose detection using mesoporous platinum [J]. Analytical Chemistry, 2003, 75 (13): 3046~3049.
[6]Zhang Y Q, Wang Y Z, Jia, J B. Nonenzymatic glucose sensor based on graphene oxide and electrospun NiO nanofibers [J]. Sensors and Actuators B, 2012, 171: 580~587.
[7]Gao X, Jin L Y, Wu Q. A nonenzymatic hydrogen peroxide sensor based on silver nanowires and chitosan film [J]. Electroanalysis, 2012, 24 (8): 1771~1777.
[8]Zhang W J, Bai L, Lu L M, et al. A novel and simple approach for synthesis of palladium nanoparticles on carbon nanotubes for sensitive hydrogen peroxide detection [J]. Colloids and Surfaces B: Biointerfaces, 2012, 97,145~149.
[9]Niu X H, Lan M B, Chen C. Nonenzymatic electrochemical glucose sensor based on novel Pt-Pd nanoflakes [J]. Talanta, 2012, 99 (15): 1062~1067.
[10]Lim S H, Wei J, Lin J Y, et al. A glucose biosensor based on electrodeposition of palladium nanoparticles and glucose oxidase onto Nafion-solubilized carbon nanotube electrode [J]. Biosensors and Bioelectronics, 2005, 20 (11): 2341~2346.
[11]Zeng Q, Cheng J S, Liu X F, et al. Palladium nanoparticle/chitosan-grafted graphene nanocomposites for construction of a glucose biosensor [J]. Biosensors and Bioelectronics, 2011, 26 (8): 3456~3463.
[12]You J M, Jeong Y N, Ahmed M S, et al. Reductive determination of hydrogen peroxide with MWCNTs-Pd nanoparticles on a modified glassy carbon electrode [J]. Biosensors and Bioelectronics, 2011, 26 (5): 2287~2291.
[13]Zeng Y L, Huang Y F, Jiang J H, et al. Functionalization of multi-walled carbon nanotubes with poly(amidoamine) dendrimer for mediator-free glucose biosensor [J]. Electrochemistry Communications, 2007, 9 (1): 185~190.
[14] Chen X L, Pan H B, Liu H F, et al. Nonenzymatic glucose sensor based on flower-shaped Au@Pd core-shell nanoparticles-ionic liquids composite film modified glassy carbon electrodes [J]. Electrochimica Acta, 2010, 56 (2): 636~643.
Keywords: nonenzymatic sensor;glucose;chemically modified electrode;carbon nanotubes;palladium nanoparticles
Preparationofdendrimerfuncationalizedcarbonnanotube/Pdnanoparticlescompositefornonenzymaticglucosebiosensing
HOU Dai-hong,LAI Guo-song,ZHANG Hai-li
(College of Chemistry and Chemical Engineering,Hubei Normal University,Huangshi 435002,China)
Polyamidoamine (PAMAM) dendrimer was covalently grafted with carboxylated carbon nanotubes (CNTs) for the in situ deposition of palladium nanoparticles (Pd NPs). Based on the electrode modification with the as-prepared CNTs-PAMAM/Pd NPs nanocomposites and the further coating of chitosan on its surface, a nonenzymatic amperometric glucose biosensor was developed. Electrochemical impedance spectroscopy and cyclic voltammetry were used to characterize and optimize the performance of the sensor. Under the optimal conditions, this sensor exhibited a rapid amperometric response towards glucose (less than 3 s), and a wide linear range from 0.03 to 61.7 m mol·L-1was obtained with a detection limit of 11.5 μmol·L-1(S/N=3). This biosensor has low cost, good stability, selectivity and repeatability, thus indicating great potentials for practical applications.
2013—12—08
湖北省教育厅重点项目(D2010250);国家自然科学基金(21075030)
侯代红(1987— ),女,湖北公安人,硕士研究生.
O167.3
A
1009-2714(2014)01- 0037- 05
10.3969/j.issn.1009-2714.2014.01.008
