吡格列酮对高脂血症大鼠主动脉组织MMP-2、MMP-9表达的影响
2014-08-24刘春丽商玮赵凌杰姚茹冰董晓蕾沈思钰郭郡浩赵智明蔡辉
刘春丽 商玮 赵凌杰 姚茹冰 董晓蕾 沈思钰 郭郡浩 赵智明 蔡辉
·论著·
吡格列酮对高脂血症大鼠主动脉组织MMP-2、MMP-9表达的影响
刘春丽 商玮 赵凌杰 姚茹冰 董晓蕾 沈思钰 郭郡浩 赵智明 蔡辉
目的观察吡格列酮对高脂血症大鼠主动脉基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)表达的影响。方法26只雄性SD大鼠随机分成普通饲料组(n=9)和高脂饲料组(n=17),分笼饲养,12周后检测空腹血脂水平,以确定高脂饲料组高脂血症大鼠造模是否成功;再将成模大鼠随机分成模型组(n=8)和吡格列酮组(n=9)。第13周起予吡格列酮组大鼠予吡格列酮混悬液连续灌胃4周,余2组用相应量的蒸馏水灌胃4周,平行检测2组大鼠血脂水平,免疫组化检测主动脉MMP-2、MMP-9表达,并用Image-Pro Plus 6.0图像分析系统分析染色结果。结果高脂饲料喂养12周大鼠总胆固醇(TC)、三酰甘油(TG)和低密度脂蛋白胆固醇(LDL-C)水平较对照组明显升高(P<0.05),表明造模成功。吡格列酮组主动脉MMP-2、MMP-9表达水平较之模型组明显降低(P<0.05)。结论吡格列酮能通过抑制主动脉MMP-2、MMP-9表达,有利于斑块的稳定性增加。
吡格列酮;高脂血症;动脉粥样硬化;基质金属蛋白酶-2;基质金属蛋白酶-9
动脉粥样硬化(atherosclerosis,AS)是一种伴有脂代谢紊乱、内皮损伤及炎性反应的慢性动脉疾病,其过程主要包括脂纹形成,纤维斑块、粥样斑块和复合样变。基质金属蛋白酶类(matrix metalloroteinases,MMPs)表达增加被认为是导致急性冠脉综合征的主要原因之一,基质金属蛋白酶-2(MMP-2)、MMP-9是其中重要的组成部分,参与细胞外基质形成,是反应斑块稳定性的分子生物学指标之一。吡格列酮(pioglitazone,TZDs)是一种过氧化酶增殖物激活受体γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)激动剂,能够减轻胰岛素抵抗程度,改善脂质代谢水平,抑制血管炎症反应,在AS早期具有血管保护作用,有效阻止AS进展[1]。本文探讨吡格列酮对AS血管中MMP-2,MMP-9表达的影响,阐明其对AS斑块稳定性的作用。
1 材料与方法
1.1 实验动物 出生21 d Sprague Dawley(SD)雄性健康大鼠,体重55~68 g,由我院动物实验中心提供[实验动物使用许可证号SYXK(苏)2003-0032]。
1.2 实验药品和试剂 三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、LDL-C检测试剂盒,购自南京建成生物工程研究所。盐酸吡格列酮片(15 mg/片)由杭州中美华东制药生产。兔抗大鼠多克隆抗体MMP-2、MMP-9购自武汉博士德生物技术有限公司。SP双染试剂盒由福州迈新生物科技有限公司生产。苏木素染色液购自南京建成公司。中性树胶为福州迈新生物科技有限公司。多聚赖氨酸由福州迈新生物科技有限公司,用蒸馏水配制成10%多聚赖氨酸。HE染色试剂盒购自南京凯基生物科技发展公司。二甲苯、甲醇、枸橼酸三钠等其他试剂,均为国产分析纯。
1.3 实验仪器 组织切片机,美国Reichert HistoSTAT;孵箱,上海精宏实验设备有限公司,型号:THZ-312;烤箱,上海圣欣科学仪器有限公司,型号:101AS-3;冰箱,中国海尔,型号:BCD-258A/C;显微镜,日本Nikon,型号:E200;天平,德国赛多利斯型号:E200;耐高温塑料染色架,福州迈新型号:RAK-2001;Image-Pro Plus 6.0图像分析系统。
1.4 实验方法
1.4.1 高脂血症大鼠模型的建立及分组:26只大鼠表随机分为高脂饲料(n=17)和普通对照组(n=9),高脂组给予高脂饲料(鱼粉3%、猪油12%、鸡蛋12%、胆固醇2%、胆酸盐0.5%、甲基硫氧嘧啶0.2%和72.3%的基础饲料),普通对照组给予标准大鼠饲料,分别喂养12周后,通过眼眶静脉丛取血,平行检测血脂水平以建立高脂血症大鼠模型。成模大鼠(n=17)随机分成模型组(n=8)和吡格列酮组(n=9),自实验第13周起,吡格列酮组大鼠给予吡格列酮混悬液(按吡格列酮10 mg·kg-1·d-1的剂量溶于1.5 ml/100 g体重的蒸馏水中制成混悬液),连续灌胃4周,对照组和模型组给予相应量的蒸馏水灌胃,干预期间模型组和吡格列酮组继续喂饲高脂饲料。进食量控制在15 g·100 g-1·d-1,早、中、晚三餐定时定量,对照组给予普通饲料,实验第16周末,禁食24 h后,用20%氯胺酮,以1 ml·100 g-1·d-1体型剂量麻醉后,剪开胸腔,暴露心脏,左心室穿刺取血5 ml,室温静置1 h后,3 000 r/min离心5 min,分离血清,置-20℃冰箱保存,待测血脂指标;冰盘中分离大鼠主动脉,置液氮中保存,待行组织形态学和免疫组化检测。
1.4.2 HE染色:主动脉HE染色由南京凯基生物科技发展有限公司完成。于大鼠主动脉弓与胸主动脉交界处取材,10%中性甲醛固定,石蜡包埋,水平横切面制备石蜡切片(厚度4 μm),HE染色风干,中性树胶封片,×200光镜下观察。
1.4.3 大鼠血脂测定:三酰甘油(TG)用TPO-PAP法,总胆固醇(TC)用CHOD-PAP法,高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)用选择性沉淀法。
1.4.4 大鼠主动脉MMP-2、MMP-9表达:采用SP法,胸主动脉根部取材至10%甲醛中固定,常规石蜡包埋,连续4 μm切片。二甲苯脱蜡,梯度酒精脱水后,不同浓度乙醇水化,PBS浸泡并清洗数次后。将放有切片的耐高温塑料染色架放入盛有抗原修复缓冲液中,20 min后取出,自然冷却。PBS浸泡、清洗,3% H2O2-甲醇溶液处理,再次PBS浸泡、清洗后加入一抗100 μl,放至37℃湿盒孵育2 h。相关处理后,加入HRP标记二抗50 μl。新鲜配制的二氨基联苯氨(DAB)液进行显色,镜下观察染色深浅,染好立即中止,用自来水轻柔冲洗15 min用蒸馏水终止显色反应。苏木素复染,中性树胶封片,光学显微镜下进行结果观察。

2 结果
2.1 实验16周末3组大鼠主动脉组织形态学观察 对照组血管壁三层结构清晰,血管内膜光滑,内皮细胞完整,内膜下可见少量泡沫细胞,中膜厚度均一,中膜平滑肌细胞与弹力板近似平行相间排列;模型组血管内皮连续性受损,管壁局部向管腔突出,内皮下大量脂质和泡沫细胞堆积,部分内膜增厚,中层结构紊乱,平滑肌细胞明显增生,排列紊乱;吡格列酮组内膜未见明显改变,内皮细胞偶有脱落,内膜下分布少量泡沫细胞,内皮细胞尚完整,中膜厚度适中,平滑肌细胞轻度增生,分布较均匀,形态基本正常。见图1。

图1 3组大鼠主动脉组织形态学观察(HE×200)
2.2 实验12周末血脂、血糖水平 高脂饲料组TC、TG、LDL-C水平显著高于对照组,差异有统计学意义(P<0.01),参照文献[2],高脂饲料组17只大鼠均符合高脂血症模型。见表1。


组别BGTGTCHDL⁃CLDL⁃C对照组(n=9)3.50±0.670.93±0.151.83±0.231.26±0.090.19±0.05高脂饮食组(n=17)3.54±0.841.73±0.47∗2.98±0.32∗1.36±0.200.50±0.34∗ t值-0.148-6.407-9.608-1.763-3.633 P值0.884<0.01<0.010.0910.002
注:与对照组比较,*P<0.01
2.3 实验第16周末血脂、血糖水平 3组大鼠TG、TC1)差异有统计学意义(P<0.01),因方差齐性,经LSD两两比较后,模型组TC、TG、LDL-C较对照组水平显著升高,差异有统计学意义(P<0.01),吡格列酮组TC、TG水平较模型组明显降低,差异有统计学差异(P<0.01),3组间HDL-C、LDL-C、BG差异无统计学意义(P>0.05)。见表2。

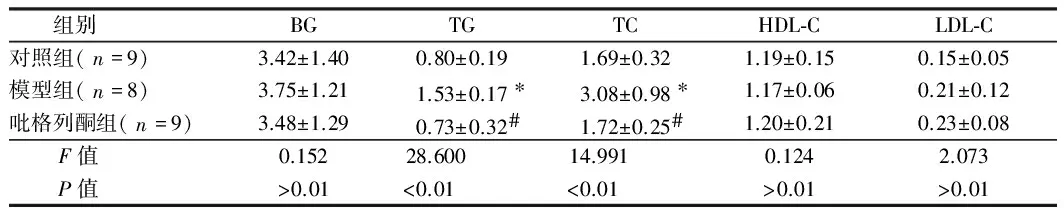
组别BGTGTCHDL⁃CLDL⁃C对照组(n=9)3.42±1.400.80±0.191.69±0.321.19±0.150.15±0.05模型组(n=8)3.75±1.211.53±0.17∗3.08±0.98∗1.17±0.060.21±0.12吡格列酮组(n=9)3.48±1.290.73±0.32#1.72±0.25#1.20±0.210.23±0.08 F值0.15228.60014.9910.1242.073 P值>0.01<0.01<0.01>0.01>0.01
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.4 3组大鼠主动脉MMP-2、MMP-9免疫组化染色 MMP-2、MMP-9表达阳性主要表现为细胞胞质中有棕黄色颗粒状阳性反应物。实验发现,模型组大鼠主动脉MMP-2、MMP-9棕色颗粒状阳性反应物明显增加,吡格列酮组大鼠主动脉MMP-2、MMP-9蛋白棕色颗粒状阳性反应物明显减少。见图2、3。
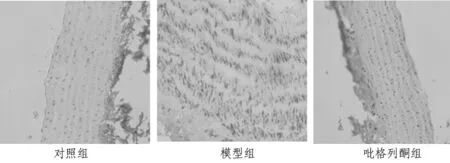
图2 3组大鼠主动脉MMP-2(免疫组化×400)

图3 3组大鼠主动脉MMP-9(免疫组化×400)
2.5 Image-Pro Plus 6.0图像分析系统对主动脉平均光密度值定量分析 结果显示模型组的MMP-2、MMP-9阳性颗粒平均光密度明显高于对照组(P<0.05),吡格列酮组的平均光密度值显著低于模型组(P<0.05),而与对照组差异无统计学意义(P>0.05)。见表3。


组别MMP⁃9MMP⁃2普通组0.156±0.0110.138±0.008模型组0.766±0.052∗0.376±0.154∗吡格列酮组0.166±0.005#0.154±0.011#
注:与对照组比较,*P<0.05; 与模型组比较,#P<0.05
3 讨论
AS斑块是否稳定主要取决于斑块性质而非其大小,成熟斑块由脂质核心及纤维帽组成,生理状态下胶原处在合成及分解的动态平衡之中,但在不稳定斑块中,这种平衡被打破,任何使胶原合成减少或降解增加的因素都可使纤维帽变薄而易于破裂[3]。动脉粥样硬化(AS)斑块形成过程中始终存在着细胞外基质重构,生成的细胞外基质(ECM)和血管平滑肌细胞一起共同组成AS斑块纤维帽。MMPs在AS血管壁胞外基质重构中发挥重要作用,是降解ECM的重要酶类。MMP-2是由血管壁细胞表达和分泌的,是最重要的MMPs之一,具有多种降解活性,能够完整降解Ⅳ型基底膜胶原,Ⅴ、Ⅶ、Ⅹ型胶原与变性的Ⅰ、Ⅲ型胶原及弹性蛋白[4]。外周血中的单核细胞与内皮细胞黏附,在管壁中迁移以及吞噬脂质演变为泡沫细胞过程中,均可分泌MMP-2[5]。活化的MMP-2几乎可降解除多糖以外的全部胞外基质,在动脉粥样硬化的血管细胞中MMP-2表达的增加、活性的增强,降解斑块的细胞外基质成分而减弱斑块强度,促进AS发生、发展,降低斑块稳定性。MMP-9是由中性粒细胞、巨噬细胞在受到特定刺激后合成分泌,降解人粥样硬化斑块纤维帽中的胶原蛋白。病理研究显示人冠状动脉粥样硬化斑块中MMP-9过度表达,斑块不稳定性明显增加,并与急性冠脉综合征病情严重程度相一致[6]。
吡格列酮作为PPARγ激动剂,通过PPAR-γ的特殊配体发挥改善胰岛素抵抗及抑制血管炎性反应等作用[7,8]。本实验通过利用吡格列酮干预高脂血症大鼠,观察其对大鼠主动脉MMP-2、MMP-9表达的影响,结果发现高脂血症组大鼠主动脉MMP-2、MMP-9表达较对照组明显增加,而吡格列酮组大鼠主动脉MMP-2、MMP-9表达较高脂血症组大鼠明显降低,表明吡格列酮能够抑制主动脉MMP-2、MMP-9活性水平,减少斑块内ECM降解,防止斑块破裂。可能与CTGF、糖原合酶-3β(GSK-3β)抑制MMPs作用有关[9,10],在增加斑块稳定性方面发挥重要作用,具体机制有待进一步研究。
综上所述,吡格列酮能通过抑制MMP-2、MMP-9活性水平,抑制AS模型大鼠血管壁斑块内基质降解程度,增加斑块稳定性,为进一步研究吡格列酮的抗AS理论提供更多的理论依据。
1 Kasai T,Miyauchi K,Yokoyama T,et al.Pioglitazone attenuates neointimal thickening via suppression of the early inflammatory response in a porcine coronary after stenting.Atherosclerosis,2008,197: 612-619.
2 张岫美,魏欣冰,吴葆杰.调血脂药及抗AS药的筛选//徐叔云,卞如濂,陈修主编.药理实验方法学.第3版.北京:人民卫生出版社,2001.1201-1206.
3 Nurkic J,Ljuca F,Nurkic M,et al.Biomarkers of plaque instability in acute coronary syndrome patients.Med Arh,2010,64: 103-106.
4 蔡志玲,陈永斌.MMP-2,MMP-9及TIMP-1在通心络治疗急性冠脉综合征中介导作用的研究.广西医科大学学报, 2011,28:178-182.
5 王凤,金笑平.基质金属蛋白酶2及其基因多态性与动脉粥样硬化的关系.医学综述,2010,16:3041-3043.
6 赵东明,杨萍,刘国庆,等.血清基质金属蛋白酶-9和干扰素-γ在急性冠脉综合征中的作用.中国老年学杂志,2011,5:1744-1745.
7 Hirano M,Nakamura T,Kitta Y,et al.Rapid improvement of carotid plaque echogenicity within 1 month of pioglitazone treatment in patients with acute coronary syndrome.Atherosclerosis,2009,203:483-488.
8 Leonhardt W,Pfutzner A,Muller J,et al.Effects of pioglitazone and/or simvastatin on low density lipoprotein subfractions in non-diabetic patients with high cardiovascular risk: A sub-analysis from the PIOSTAT study.Atherosclerosis,2008,201: 155-162.
9 Yang M,Huang H,Li J,et al.Connective tissue growth factor increases matrix metalloproteinase-2 and suppresses tissue inhibitor of matrix metalloproteinase-2 production by cultured renal interstitial fibroblasts.Wound Repair Reqen,2007,15: 817-824.
10 Lee CS,Kwon YW,Yang HM,et al.New mechanism of rosiglitazone to reduce neointimal hyperplasia: activation of glycogen synthase kinase-3 beta followed by inhibition of MMP-9.Arterioscler Thromb Vasc Biol,2009,29: 472-479.
EffectofpioglitazoneontheexpressionofMMP-2andMMP-9inaortaofratswithhyperlipidemia
LIUChunli,SHANGWei,ZHAOLingjie,etal.NanjingGeneralHospitalofNanjingMilitaryCommand,Nanjing210002,China
ObjectiveTo observe the effect of pioglitazone on the expression of MMP-2 and MMP-9 in aorta of rats with hyperlipidemia.Methods26 male SD rats were randomly divided into normal diet control group (n=9) and high-fat diet group (n=16),and the rats were bred in respective cage.After 12 weeks,the fasting plasma lipid levels were detected to decide whether the animal models with hyperlipidemia in high fat diet group were successful or not.Then the model rats were redivided into model group (n=8) and pioglitazone group (n=9).From the 13th week,the rats in pioglitazone group were given pioglitazone (10mg·kg-1·d-1) by gavage for 4 weeks,however,the rats in the other two groups were given equivalent distilled water by gavage for 4 weeks,the blood fat levels in the two groups were detected,the expression levels of MMP-2 and MMP-9 in aorta were detected by immunohistochemisty,finally,the staining results were analyzed by Image Pro Plus 6.0 image analysis system.ResultsAfter 12-week feeding,the levels of total cholesterol (TC),triglyceride (TG) and low-density lipoprotein cholesterol (LDL-C) in high fat diet group were significantly increased,as compared with those in control group (P<0.05),which showed that the animal models were successfully established.The expression levels of MMP-2 and MMP-9 in aorta in pioglitazone group were significantly decreased,as compared with those in model group (P<0.05).ConclusionPioglitazone can inhibit the expression of MMP-2 and MMP-9 in aorta,accordingly increase plaque stability.
pioglitazone;hyperlipidemia; atherosclerosis;matrix metalloproteinases-2;matrix metalloproteinases-9
10.3969/j.issn.1002-7386.2014.05.006
210002 南京市,中国人民解放军南京军区南京总医院中西医结合科;
蔡辉,210002 中国人民解放军南京军区南京总医院;
E-mail:caihuiphd@163.com
R 543.5
A
1002-7386(2014)05-0659-04
2013-12-11)
