3.0T动态增强MRI在前列腺癌诊断中的价值
2014-08-22景国东汪剑陈录广杨波王莉陆建平
景国东,汪剑,陈录广,杨波,王莉,陆建平
·前列腺MRI专题·
3.0T动态增强MRI在前列腺癌诊断中的价值
景国东,汪剑,陈录广,杨波,王莉,陆建平
目的通过动态增强MRI(DCE-MRI)对前列腺癌进行定量分析,评估DCE-MRI在前列腺癌中的诊断价值。方法选取46名前列腺疾病患者,年龄43~81岁,包括前列腺癌患者35名,前列腺增生患者11名。所有患者均行常规MRI及DCE-MRI检查,在灌注参数图上测量前列腺癌与正常组织的容积转运常数(Ktrans)、速率常数(Kep)、血管外细胞外容积分数(Ve)值,比较三者在前列腺癌及正常组织中的差异,并进行ROC曲线分析,计算Ktrans、Kep、Ve诊断前列腺癌的敏感度及特异度并对Ktrans、Kep、Ve三者与Gleason评分进行相关性分析。结果在前列腺癌与正常组织中,Ktrans、Kep差异均有统计学意义(P<0. 001),Ve差异无统计学意义(P>0.05)。Ktrans、Kep的ROC曲线下面积最大,两者的诊断敏感度及特异度分别为94.6%、92.9%和85.7%、71.4%。Ve在前列腺癌诊断中无明显价值。Ktrans、Kep、Ve与Gleason评分无明显相关性。结论DCE-MRI定量分析在前列腺癌诊断中具有较高价值,可用于前列腺良恶性病变的鉴别诊断。
前列腺肿瘤; 前列腺增生; 磁共振成像;诊断,鉴别
前列腺癌是男性第二常见的恶性肿瘤,在男性癌症病死率中居第六位[1]。近年来,MRI检查已成为前列腺疾病最优的影像学检查方法,MRI具有良好的软组织分辨力,并且可多方位、多参数、多功能成像。常规MRI检查T2WI成像可清楚显示前列腺的解剖结构及周围组织结构[2],前列腺癌在T2WI上的典型表现为外周带内呈低信号影,但前列腺炎症、出血、钙化、内分泌治疗后也可表现为外周带内低信号,这给前列腺癌的诊断增加了困难。常规MRI在前列腺癌诊断中由于存在诸多不足,这就需要联合其他检查技术对前列腺良、恶性病变进行鉴别[3]。动态增强磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI)是一种无创性评估组织和肿瘤血管生理特性的成像方法,其原理主要是基于肿瘤的血管生成和肿瘤新生血管通透性的改变[4],通过静脉团注对比剂后,观察对比剂在血管及组织中浓度的变化,检测肿瘤血管生成、血管通透性及血管灌注。此前很多研究中,DCE-MRI在1.5T MRI中用于评价转运常数Ktrans与肿瘤Gleason评分相关性的研究结论不一致,而3.0T MRI在这方面的研究报道很少。本文通过DCE-MRI对前列腺癌进行定量分析,旨在探讨DCE-MRI在前列腺癌诊断中的价值。
材料与方法
1.病例资料
搜集我院2013年6月-2014年1月35例前列腺癌和11例前列腺增生患者的病例资料,患者年龄52~82岁,前列腺特异性抗原(prostate specific antigen,PSA)水平4.75~>100 ng/ml,所有患者均经手术病理证实。所有患者行MR检查前均签署知情同意书。主要临床症状包括排尿困难、尿频、尿潴留、间断性血尿等。前列腺癌术后Gleason评分:评分为6分者4例,7分者10例,8分者8例,9分者11例,10分者2例。
2.患者纳入标准
前列腺癌患者纳入标准:① MR检查前1个月内未进行过前列腺穿刺;②患者行MR检查前未做过内分泌及放射治疗等;③患者临床资料及病历资料齐全;④患者无磁共振检查禁忌。
3.检查方法
MRI检查采用Siemens Skyra 3.0T MR扫描仪。患者检查前一天进食少渣食物,检查前禁食4~6 h,检查时排空膀胱。患者取仰卧位,将18通道相控阵体线圈置于腹壁,扫描中心位于耻骨联合上方约2 cm处,并用绑带对线圈进行固定,以减少患者呼吸运动产生的伪影。前列腺行横轴面、矢状面、冠状面三方位2D T2WI快速自旋回波序列扫描。横轴面扫描参数:TR 4000 ms,TE 104 ms,视野180 mm×180 mm,层厚3.0 mm,层间距0 mm,层数21,矩阵384×384 ,翻转角134°。回波链长度18 ,平均次数1 ,采集时间2 min 58 s。冠状面扫描参数:TR 4000 ms,TE 104 ms,视野180 mm×180 mm,层厚3.0 mm,层间距0 mm,层数21,矩阵384×384,翻转角134°。回波链长度18 ,平均次数1 ,采集时间2 min 39 s。矢状面扫描参数:TR 4000 ms,TE 104 ms,视野180 mm×180 mm,层厚3.0 mm,层间距0 mm,层数21,矩阵384×384,翻转角134°。回波链长度18,平均次数1,采集时间2 min 9 s。前列腺横轴面T1WI扫描参数:TR 4000 ms,TE 104 ms,视野180 mm×180 mm,层厚3.0 mm,层间距0 mm,层数21,矩阵384×384,翻转角134°。回波链长度18,平均次数1,采集时间2 min 18 s。
前列腺DCE-MRI扫描对比剂选用钆喷替酸葡甲胺(Gd-DTPA),经肘前静脉留置针高压注射器快速注射,流率3.0 ml/s,然后注射30 ml生理盐水以保证药物完全注入体内,流率3.0 ml/s。在注射对比剂前先扫一个扫描周期作为蒙片,注射对比剂时同时进行第二个周期扫描,每个扫描周期得到30幅图像,共75个扫描周期,扫描时间5 min 13 s。扫描采用T1-Vibe-FS序列,扫描参数:TR 4000 ms,TE 104 ms,视野180 mm×180 mm,层厚3.0 mm,层间距0 mm,层数21,矩阵384×384,翻转角134°。回波链长度18,平均次数1,采集时间2 min 58 s。动态增强扫描注射对比剂之前先平扫两个周期T1mapping,用于T1值的计算。
4.图像及数据分析
所有动态增强MRI数据的处理均在Siemens syngoMultiModality工作站上完成,采用Tissue 4D处理软件。画定兴趣区时首先通过根治术后大体标本切片和经直肠超声引导下前列腺十二针穿刺病理结果来明确肿瘤组织与非肿瘤组织。观察肿瘤的位置、形态、大小及边界,画定兴趣区后通过软件对肿瘤与非肿瘤组织的Ktrans、速率常数Kep、血管外细胞外容积分数Ve值进行自动分析,最后对数据进行收集整理。ROI的选择应位于前列腺包膜内,尽量避开尿道、钙化灶等区域,每个病灶的ROI测量2~3次取平均值。
5.统计学分析
采用 SAS 9.2统计学软件进行统计学分析,使用成组t检验比较前列腺肿瘤组织与非肿瘤组织Ktrans、Kep、Ve的差异,应用 ROC 曲线评价Ktrans、Kep、Ve对前列腺癌的诊断效能。采用直线相关性检验评价Ktrans、Kep、Ve与病理Gleason评分系统的相关性。评估肿瘤组织与非肿瘤组织两组组间差异时,先进行方差齐性检验,若方差齐则采用单因素方差分析,若方差不齐则采用非参数检验中的Kruskal Wallis检验。以P<0.05为差异有统计学意义。
结果
本研究共采集84份可用组织样本,包括56份前列腺肿瘤和28份前列腺非肿瘤组织样本。前列腺癌结节在T2WI上表现为低信号结节,增强扫描表现为快速强化,快速退出,强化曲线呈“速升速降”型,而对侧增生前列腺组织呈“缓慢升高”型(图1)。
1.前列腺癌DCE-MRI定量分析结果
DCE-MRI定量分析结果显示,前列腺肿瘤组Ktrans值为(0.24±0.09)min-1,非肿瘤组Ktrans值为(0.10±0.03)min-1,两组之间差异有统计学意义(P<0.001)。前列腺肿瘤组Kep值为(0.70±0.29)min-1,非肿瘤组Kep值为(0.30±0.12)min-1,两组之间差异有统计学意义(P<0.001)。前列腺肿瘤组Ve值为0.40±0.16,非肿瘤组Ve值为0.40±0.14,两组之间差异无统计学意义(P>0.05,表1)。
χ2检验显示,(Ktrans-Kep) 与Ktrans比较,诊断效能差异无统计学意义(P>0.05);Kep与Ktrans比较、(Ktrans-Kep)与Kep比较,诊断效能差异均有统计学意义(P<0.05),Ktrans、(Ktrans-Kep)诊断效能均优于Kep(表2)。
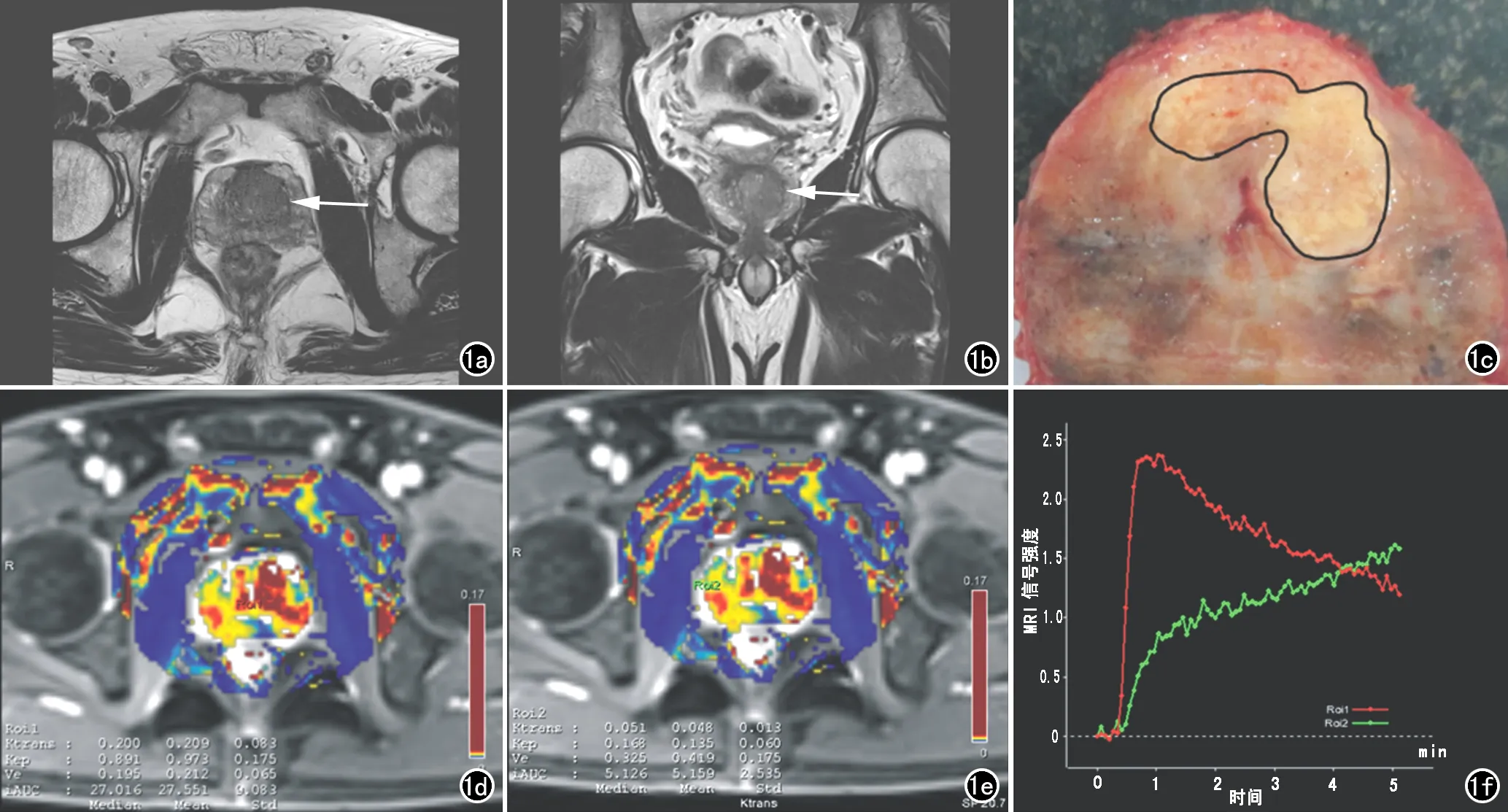
图1 患者,60岁,前列腺癌患者,Gleason评分为7分。a) T2WI横轴面示左侧叶不规则形低信号影(箭),边界欠清;b) T2WI冠状面示左侧叶不规则低信号影(箭);c) 术后标本切面,前列腺左侧叶可见明显的癌灶组织;d) T1灌注图示左侧叶病灶呈高灌注;e) 正常组织T1灌注图,表现为低灌注;f) 时间-信号曲线图示癌灶曲线呈速升速降型(红色),正常组织呈缓慢上升型(绿色)。

表2 诊断效能比较
ROC曲线分析结果显示,Ktrans、Kep值在诊断前列腺癌的曲线下面积分别为0.9927、0.9177,P<0.001;Ktrans诊断前列腺癌敏感度和特异度分别为92.9%和71.4%。Ve值在诊断前列腺癌的曲线下面积为0.5217,P>0.05。Ktrans与Kep在前列腺癌诊断中具有重要价值,且Ktrans明显优于Kep,Ve在在前列腺癌诊断中无明显价值(图2)。
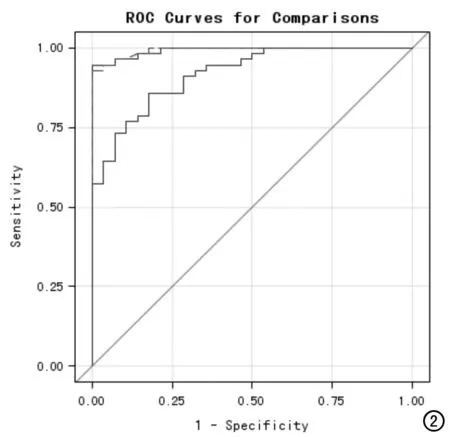
图2 Ktrans、Kep值ROC曲线分析图。
2.前列腺癌Ktrans、Kep、Ve值与病理Gleason评分系统相关性分析
统计学分析显示前列腺癌组织Ktrans、Kep、Ve值与 Gleason评分无相关性,差异无统计学意义(P>0.05,表3)。

表3 Ktrans、Kep、Ve值与Gleason评分直线相关分析结果
注:Ktrans、Kep、Ve与Gleason评分不存在直线相关关系。
讨论
肿瘤组织在DCE-MRI中主要表现为血管密度增加及血流灌注增强,这是许多癌组织包括前列腺癌的常见表现。前列腺癌组织具有较高的微血管密度,微血管密度增加在良性前列腺增生及前列腺高级别上皮内瘤变中也常见,前列腺癌与良性前列腺增生存在一定重叠[5]。微血管密度与组织学分级有关,可以作为患者生存率及治疗后预后评估指标。动态增强扫描量化分析可以分为定量分析和半定量分析两种方法[5]。DCE-MRI定量分析是通过Tofts-Kermode模型扩展的双室模型进行数学计算[6,7],得出一系列参数如容积转运常数(Ktrans)、速率常数(Kep)、血管外细胞外容积分数(Ve),这些定量参数用来评价肿瘤血管的生理学特性,有助于建立客观的标准用于前列腺癌的诊断和评估治疗效果[8,9],三者之间的关系:Kep=Ktrans/Ve。半定量分析主要通过时间-信号强度曲线进行分析,计算比较简单容易。时间-信号强度曲线反映了病变血流灌注情况,根据文献报道[4],曲线可分为四型:Ⅰ速升速降型,兴趣区早期信号强度快速上升,到达一定值后信号强度迅速下降;Ⅱ速升缓降型,兴趣区内早期信号强度快速上升,到达一定值后缓慢下降;Ⅲ平台型,兴趣区早期信号强度增加明显,到达一定值后停止增加或者明显变缓,呈平台表现;Ⅳ缓慢升高型,整个动态观测时间内兴趣区信号强度持续性增强。前列腺癌常见的强化方式为速升速降型及速升慢降型,平台型常见于前列腺增生,缓慢上升型常见于正常前列腺组织及前列腺良性病变。根据文献报道,DCE-MRI能够鉴别低级别肿瘤与高级别肿瘤,在防止低级别肿瘤的过度治疗中起着非常重要的作用[10,11]。因此DCE-MRI在鉴别低级别肿瘤与高级别肿瘤中具有较高的临床应用价值。
在过去的10年中,DCE-MRI定量分析在前列腺磁共振成像中的应用越来越广泛,通过评价肿瘤新生血管渗透性,DCE-MRI有望成为用于前列腺癌诊断和分期的工具。DCE-MRI药代动力学模型定量分析的主要参数有Ktrans、Kep及Ve。定量参数与血管通透性、灌注和血管容积基本生理特性相关,并且可以应用药代动力学模型从DCE-MRI数据中得出。Ktrans代表单位时间内对比剂从血液进入到组织间隙的转运容积,大小取决于血流量、毛细血管渗透性及表面积;Kep代表单位时间内对比剂从组织间隙进入血管的量;Ve代表单位体积组织血管外细胞外间隙体积,取值在0~1之间。
在本研究中,通过DCE-MRI定量分析发现Ktrans、Kep值在肿瘤组织明显高于前列腺正常组织。DCE-MRI是基于血液中的对比剂渗透到周围组织间隙,以往研究也表明,Ktrans、Kep值异常升高被认为与微血管密度和渗漏增加有关[12]。在前列腺癌中,血管生成速度过快,导致内皮细胞间隙较正常血管内皮细胞间隙增大,与正常血管比较具有较大的渗透性。DCE-MRI可以反映前列腺不同性质组织的毛细血管生成及其通透性情况,进而用来预测肿瘤临床病理分期、治疗效果和肿瘤复发[13-18]。Chen等[19]报道,通过DCE-MRI定量分析发现Ktrans、Kep值在肿瘤组织明显高于前列腺中央叶及外周带;Ve值在中央叶最高,在癌组织、中央叶及外中带无明显差异,本文研究结果与其相似。
目前只有少部分研究是关于DCE-MRI与Gleason评分相关性的,并且这些研究没有得出一致的结论[13,18]。本研究中Ktrans、Kep值与肿瘤组织Gleason评分无明显相关性,这与之前的一些研究结果相似[12,19-20]。Gleason评分是评估前列腺癌侵袭性的病理学标准,并被认为是评价患者预后最有意义的指标[20],其作为反映前列腺癌组织生长形态、结构特征与生物学行为相关性的分级系统,在临床工作中是前列腺癌患者制定治疗方案和预后的重要指标之一。Gleason评分分为5级,1级为组织结构分化最好,预后最好,级别随着组织结构分化及预后变差而升高,5级组织结构分化最差,预后最差。Gleason评分=主要结构分级+次要结构分级。主要结构类型为癌区最常见类型,次要结构类型为癌区第二常见类型且占标本的5%以上[21],而只有1种Gleason结构类型的前列腺癌,一般将其主要结构类型分级与次要结构类型视为一致,前列腺癌主要结构与次要结构分级相加,即为这一标本的Gleason评分[22,23],范围为2~10分,Gleason评分越高说明肿瘤侵袭性越大,复发的可能性越大[24]。本研究中Ktrans值与Gleason评分无明显相关性,其可能原因为:①本研究病例数较少,样本量不足;②数据测量时可能掺杂人为主观因素;③本研究组内患者评分普遍较高,Gleason评分最低值为6分,分值比较集中;④由于前列腺癌组织的多样性,不同病灶间评分会不同,这与根治术后标本的Gleason评分常常不完全一致,而且本研究忽略了Gleason评分同样分值主要、次要组织结构的前后关系的影响,因为主次关系不同,肿瘤侵袭性也不同。目前关于前列腺癌动态增强扫描定量分析参数的研究方法尚不成熟,不同研究中心所采用的软件及药代动力学模型不同,而且处理方法和结果也不完全相同,其可行性和准确性有待通过大量研究进一步证实[25]。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Schnall MD,Lenkinski RE,Pollack HM,et al.Prostate:MR imaging with an endorectal surface coil[J].Radiology,1989,172(2):570-574.
[3]Tanimoto A,Nakashima J,Kohno H,et al.Prostate cancer screening:the clinical value of diffusion-weighted imaging and dynamic MR imaging in combination with T2-weighted imaging[J].J Magn Reson Imaging,2007,25(1):146-152.
[4]Ren J,Huan Y,Wang H,et al.Dynamic contrast-enhanced MRI of benign prostatic hyperplasia and prostatic carcinoma:correlation with angiogenesis[J].Clin Radiol,2008,63(2):153-159.
[5]Alonzi R,Padhani AR,Allen C.Dynamic contrast enhanced MRI in prostate cancer[J].Eur J Radiol,2007,63(3):335-350.
[6]Riches SF,Payne GS,Morgan VA,et al.MRI in the detection of prostate cancer:combined apparent diffusion coefficient,metabolite retio,and vascular parameters[J].AJR,2009,193(6):1583-1591.
[7]Tofts PS,Brix G,Buckley DL,et al.Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusable tracer:standardized quantities and symbols[J].J Magn Reson Imaging,1999,10(3):223-232.
[8]Kozlowski P,Chang SD,Jones EC,et al.Combined diffusion-weighted and dynamic contrast-enhanced MRI for prostate cancer diagnosis--correlation with biopsy and histopathology[J].J Magn Reson Imaging,2006,24(1):108-113.
[9]Ocak I,Bernardo M,Metzger G,et al.Dynamic contrast-enhanced MRI of prostate cancer at 3T:a study of pharmacokinetic parameters[J].AJR,2007,189(4):189-201.
[10]Schroder FH,Hugosson J,Roobol MJ,et al.Screening and prostate-cancer mortality in a randomized European study[J].N Engl J Med,2009,360(13):1320-1328.
[11]Ehdaie B,Shariat SF.Magnetic resonance imaging-targeted prostate biopsy:back to the future[J].Eur Urol,2013,63(1):141-144.
[12]Kozlowski P,Chang SD,Meng R,et al.Combined prostate diffusion tensor imaging and dynamic contrast enhanced MRI at 3T-quantitative correlation with biopsy[J].Magn Reson Imaging,2010,28(5):621-628.
[13]Padhani AR,Gapinski CJ,Macvicar DA,et al.Dnamic contrast enhanced MRI of prostate cancer:correlation with morphology and tumour stage,histological grade and PSA[J].Clin Radiol,2000,55(2):99-109.
[14]Kozlowski P,Chang SD,Jones EC,et al.Combined diffusion-weighted and dynamic contrast-enhanced MRI for prostate cancer diagnosis——correlation with biopsy and histopathology[J].J Magn Reson Imaging,2006,24(1):108-113.
[15]Yoshizako T,Wada A,Hayashi T,et al.Usefulness of diffusion-weighted imaging and dynamic contrast-enhanced magnetic resonance imaging in the diagnosis of prostate transition-zone cancer[J].Acta Radiol,2008,49(10):1207-1213.
[16]Franiel T,Hamm B,Hricak H.Dynamic contrast-enhanced magnetic resonance imaging and pharmacokinetic models in prostate cancer[J].Eur Radiol,2011,21(3):616-626.
[17]Jager GJ,Ruijter ET,van de Kaa CA,et al.Dynamic turboFLASH subtraction technique for contrast-enhanced MR imaging of the prostate:correlation with histopathologic results[J].Radiology,1997,203(3):645-652.
[18]Engelbrecht MR,Huisman HJ,Laheij RJ,et al.Discrimination of prostate cancer from normal peripheral zone and central gland tissue by using dynamic contrast-enhanced MR imaging[J].Radiology,2003,229(1):248-254.
[19]Chen YJ,Chu WC,Pu YS,et al.Washout gradient in dynamic contrast-enhanced MRI is associated with tumor aggressiveness of prostate cancer[J].J Magn Reson Imaging,2012,36(4):912-919.
[20]Buhmeida A,Pyrhonen S,Laato M,et al.Prognostic factors in prostate cancer[J].Diagn Pathol,2006,3(1):4.
[21]Wang L,Mazaheri Y,Zhang J,et al.Assessment of biologic aggressiveness of prostate cancer: correlation of MR signal intensity with Gleason grade after radical prostatectomy[J].Radiology,2008,246(1):168-176.
[22]Gleason DF,Mellinger GT.Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging[J].J Urol,1974,111(1):58-64.
[23]周桥.前列腺癌Gleason分级[J].中华病理学杂志,2005,34(4):240-243.
[24]Epstein JI,Allsbrook WJ,Amin MB,et al.The 2005 International Society of Urological Pathology (ISUP) consensus conference on Gleason grading of prostatic carcinoma[J].Am J Surg Pathol,2005,29(9):1228-1242.
[25]李春媚,陈敏,李飒英,等.前列腺癌MR动态增强扫描定量分析及其应用[J].中华放射学杂志,2011,45(5):508-510.
下期要目
超低剂量CTA研究专题
臀部少见疾病的影像学表现
DCE-MRI评价肿瘤血管生成的实验研究
低剂量CT扫描结合迭代算法重建行颞骨成像
肺真菌临床影像学分析
原发性胸腺淋巴瘤的CT诊断与鉴别
3.0T MRI评价扩张型心肌病患者左心结构及功能的关系
DWI监测不同剂量单次照射兔VX2肝癌的疗效
1H-MRS评价无水乙醇消融治疗兔软组织VX2肿瘤疗效
迭代重建法与滤过反投影法在冠状动脉CTA检查中的价值
螺旋CT三维重建技术在腹壁疝中的应用
MRI联合4D CEMRA诊断四肢远端长骨转移瘤
3.0Tdynamiccontrast-enhancedMRIinclinicaldiagnosisofprostatecancer
JING Guo-dong,WANG Jian,CHEN Lu-guang,et al.
Department of Radiology,Changhai Hospital,Second Military Medical University,Shanghai 200433,P.R.China
Objective:To assess the diagnostic value of dynamic contrast-enhanced MRI (DCE-MRI) in prostate cancer with the quantitative analysis of prostate cancer by DCE-MRI.MethodsForty-six patients with prostate diseases,aged between 43 and 81,including 35 patients with prostate cancer and 11 with prostate hyperplasia were selected.All the patients were conducted with conventional MRI and DCE-MRI scan.The variations of the value of Ktrans,Kep,and Vebetween the prostate cancer and normal tissues were measured and compared.And under the ROC curve analysis,we calculated the sensitivity and specificity of Ktrans,Kepand Vein the diagnosis of prostate cancer,as well as the correlation between Ktrans,Kep,Veand the Gleason score in prostate cancer.ResultsThe values of both Ktransand Kepwere significantly different between the prostate cancer and normal tissues,while Vewas not.The areas of Ktrans、Kepunder the ROC curve were the largest,and the sensitivity and specificity of both parameters were 94.6%、92.9% vs 85.7%、71.4% ,yet,Vewas clinically useless in the diagnosis of prostate cancer.Meanwhile,Ktrans,Kepand Vevalues were not relevant with Gleason score.ConclusionDCE-MRI quantitative analysis plays a significant role in the diagnosis of prostate cancer,and may help in differential diagnosis of prostate tumors.
Prostate neoplasms;Prostatic hyperplasia;Magnetic resonance imaging; Diagnosis,differential
200433 上海,第二军医大学长海医院放射科(景国东、汪剑、陈录广、王莉、陆建平),泌尿外科(杨波)
景国东(1984-),男,山东人,硕士研究生,主要从事腹部影像诊断工作。
王莉,E-mail:wangli_changhai@163.com;陆建平,E-mail:cjr.lujianping@vip.163.com
长海医院“1255”学科建设计划资助项目(CH125520803)
R737.25; R445.2
A
1000-0313(2014)05-0482-05
2014-03-26
2014-04-16)
