类风湿关节炎患者骨质疏松情况分析
2014-08-22张育红
叶 青 张育红
湖北医药学院附属人民医院风湿免疫科,湖北十堰 442000
类风湿关节炎(rheumatoid arthritis,RA)是以对称性多关节炎为主要临床表现的异质性、系统性、自身免疫性疾病。骨质疏松(osteoporosis,OP)是RA患者的常见合并症。本文选择了64例RA患者和60例健康志愿者,用双能X线骨密度仪进行骨密度(BMD)测量,以了解RA患者OP的发生情况,并探讨其相关影响因素,为RA患者OP的临床防治提供依据。
1 资料与方法
1.1 一般资料
RA组患者64例,均为本科2011年1月—2012年5月住院患者,所有患者均符合美国风湿病学会(ACR)1987年修订的RA分类诊断标准。64例患者,其中男10例,女54例(绝经前34例,绝经后20例),年龄30~70岁,平均年龄(48.3±15.9)岁;曾经或正在服用糖皮质激素43例,未服用糖皮质激素21例。健康对照组60例,其中男10例,女50例(绝经前32例,绝经后18例),年龄30~70岁,平均年龄(50.9±14.1)岁。两组研究对象均无长期服用雌激素、雄激素、抗凝剂及影响骨代谢的药物史;无严重肝肾疾病、甲状腺、甲状旁腺等疾病,且排除酗酒者。两组患者的性别、年龄、体重指数相匹配,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
采用双能 X线(DEXA)骨密度仪,测量部位为腰椎(L2~L4)、股骨上端(股骨颈、Ward’s三角区、大转子)BMD,测量单位为g/cm2。骨质疏松诊断标准参照《中国人骨质疏松症建议诊断标准》[1],低于正常人骨峰值2.5 SD为骨质疏松,低于正常人骨峰值1.0 SD为骨量减少。
1.3 统计学处理
采用SPSS 11.0软件,计量资料采用t,相关分析采用线性相关分析法,以P<0.05为差异有统计学意义。
2 结果
RA组无论男、女(绝经前、绝经后),在腰椎(L2~L4)、股骨上端(股骨颈、Ward’s三角区、大转子)的BMD较健康对照组均明显降低,差异有统计学意义(P<0.05)。见表1-3。
在RA组中,曾经或正在服用糖皮质激素患者中OP发病率为44.2%(19/43),未服用糖皮质激素患者中OP发病率为19.0% (4/21),未服用糖皮质激素患者OP的发病率明显低于曾经或正在服用糖皮质激素患者。
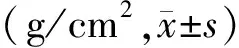
表1 两组男患者BMD比较
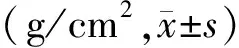
表2 两组绝经前女患者BMD比较
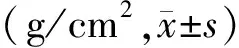
表3 两组绝经后女患者BMD比较
3 讨论
类风湿关节炎(RA)是最常见的一种关节炎,是造成人类丧失劳动力和致残的主要原因之一,在我国患病率为0.32%~0.36%左右[2]。OP在RA患者中普遍存在,而且是RA患者骨和关节侵犯的一种早期表现。2000年Haugeberg等[3]首次进行大样本的研究,报道RA患者中OP的发病率是正常人的2倍,证实RA患者中存在较高的OP发病率。
RA患者存在两种形式的骨质疏松,一种为局部和区域性的,主要表现为近关节面周边及关节邻近骨的骨量丢失,目前常以手及前臂的BMD表示;另一种为全身性的OP,常用腰椎及股骨颈的BMD代表。RA患者中此两种骨质疏松同时存在[4]。
RA患者发生OP的机制比较复杂,目前并不是十分清楚。1984年有研究者在RA患者的骨-血管翳的交界处发现有具有破骨细胞表型的多核细胞的存在,后来在1998年和2000年美国的一位研究者[5-6]分别发现这些存在于吸收陷窝内的多核细胞可以表达降钙素受体mRNA和酒石酸酸性磷酸酶以及组织蛋白酶K的mRNA,这都是成熟的破骨细胞所具有的特异性标志,从而证明了这些存在于RA患者关节滑膜表面的细胞就是破骨细胞。在一种缺少破骨细胞的小鼠模型身上诱导形成关节炎动物模型后,基本上没有发现关节炎所造成的骨质破坏[7],从而直接说明了破骨细胞在RA骨破坏中的核心作用。这可能是RA本身引起OP的原因。
在本研究中,所有应用糖皮质激素的RA患者BMD较未应用糖皮质激素的患者均明显降低,差异有统计学意义(P<0.05)。糖皮质激素是治疗多种结缔组织病的一线药物,它有很强而快速的抗炎作用,但也有较多的不良反应,尤其对长期服用者,OP就是其不良反应之一。糖皮质激素可抑制肠道对钙的吸收和促进尿钙的排泄从而导致血钙降低,继发性甲状旁腺功能亢进,促进骨吸收;并可抑制骨化细胞的矿化活性和胶原合成,增加破骨细胞的活性[8]。故糖皮质激素的应用一直被认为是引起RA患者继发OP的一个重要原因。
除RA本身及糖皮质激素的长期应用外,RA患者可能存在导致原发性OP的危险因素:例如高龄、药物引起的女性过早停经、体重过轻及吸烟等。RA患者继发OP进一步影响了患者生活质量,故应及早采取干预措施,在治疗RA的同时预防治疗OP,以减少骨折等的发生。
[1] 刘忠厚,杨定悼,朱汉民,等.中国人骨质疏松症建议诊断标准(第二稿)[J].中国骨质疏松杂志,2000,6(1):1-3.
[2] 陆再英,钟南山.内科学[M].北京:人民卫生出版社,2008:848.
[3] HAUGEBERG G,UHLIG T,FALCH JA,et al.Bone mineral density and frequency of osteoporosis in female patients with rheumatoid arthritis:result from 394 patients in the olso county rheumatoid thritis register[J].Arthritis Rheum,2000,43(3):522-530.
[4] DEODHAR AA,WOOLF AD.Bone mass measurement and bone metabolism in rheumatoid arthritis:a review[J].Br J Rheumatol,1996,35(4):309-322.
[5] GRAVALLESE EM,HARADA Y,WANG JT,et al.Identification of cell types responsible for bone resorption in rheumatoid arthritis and juvenile rheumatoid arthritis[J].Am J Pathol,l998,152(4):943-951.
[6] GRAVALLESE EM,MANNING C,TSAY A,et al.Synovial tissue in rheumatoid arthritis a source of osteoclast differentiation factor[J].Arthritis Rheum,2000,43(2):250-258.
[7] PETTIT AR,JI H,von STECHOW D,et al.TRANCE/RANKL knock out mice are protected from bone erosion in a serum transfer model of arthritis[J].Am J Pathol,200l,159(5):1689-1699.
[8] LANE NE.An update on glucocorticoid-induced osteoporosis[J].Rheum Dis Clin North Am,2001,27(1):235-253.
