三聚氰胺对草酸钙结石形成机理的影响
2014-08-21柳一鸣寻中华李红亮黄义华
柳一鸣,李 龙,寻中华,李红亮,王 伟,黄义华
(湖南理工学院 化学化工学院,湖南 岳阳 414006)
引言
“宠物食物污染”和“三鹿奶粉”事件相继发生,其相关实验证明三聚氰胺能导致泌尿系结石形成[1~6].但到目前为止,三聚氰胺导致肾结石的形成机理尚未完全明了.由于尿石中 70%~80%的晶体成分是草酸钙(CaOx).本文采用体外模拟方法研究了三聚氰胺对 CaOx成核、晶体生长和晶型转化的影响,这有利于弄清三聚氰胺对草酸钙结石形成的作用机制[7].

图 1 三聚氰胺的化学结构式
1 实验部分
1.1 试剂
三聚氰胺、草酸钠、氯化钙、氯化钠等均为分析纯试剂,实验用水为二次蒸馏水,人造尿则参照文献[8]方法配制(见表1),其主要组成为Na2SO4,MgSO4,NH4Cl,KCl,CaCl2,NaH2PO4,Na2HPO4,NaCl,Na2C2O4.
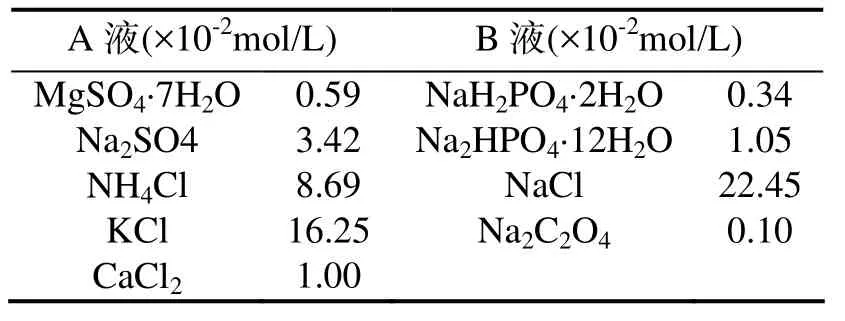
表 1 人造尿的组成
1.2 仪器
XL-30型环境扫描电子显微镜(Philips公司),XD2型X射线粉末衍射仪(北京大学),傅立叶变换红外光谱仪(Bruker公司),pH-3C精密pH计(上海雷磁仪器厂),XJZ100型正置金相显微镜(南京东图数码科技有限公司),DDS-11A型电导率仪(上海盛磁仪器有限公司),SB3200-T 型数控超声波清洗仪.
1.3 实验方法
1.3.1 三聚氰胺对CaOx晶体成核的影响
取 4mL0.01mol·L-1CaCl2溶液,加 42mL的二次水,然后在 37℃下边磁力搅拌边缓慢加入4mL0.01mol·L-1Na2Ox溶液,立即测定溶液电导率.每隔30s读取1次电导率值.改变二次水体积,加入三聚氰胺溶液,使体系中三聚氰胺的浓度分别为0.06、0.12和0.18mmol·L-1,在相同条件下进行比较研究.
1.3.2 三聚氰胺对CaOx晶体生长的影响
取50mL的A液,加入一定量的三聚氰胺溶液(小于2mL),然后边搅拌边加入50mL的B液,改变三聚氰胺的体积,配制浓度为0.06,0.12和0.18mmol·L-1的三种溶液.晶体培养按照文献[9],在37℃下晶体生长1d 后取出,进行SEM、XRD和FT-IR等表征.
1.3.3 三聚氰胺对CaOx晶体形貌和物相的影响
用 SEM 进行形貌观察,测试条件为:样品喷金处理,测量电压 15 kV.用 XRD分析晶体的物相,测试条件为:Cu的Kα辐射,40 kV,20 mA,石墨弯晶单色器,狭缝:DS,1°,RS,0.15 mm,SS,1°,扫描速度:8(°)·m in−1,步宽:0.02°.
采用 XRD 作定量分析时,按照文献[10,11]方法用下式计算 COM的百分含量:
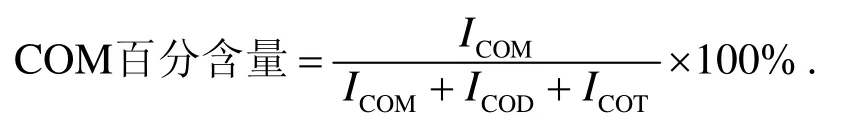
其中ICOM,ICOD和ICOT分别为一水草酸钙(COM)、二水草酸钙(COD)和三水草酸钙(COT)主衍射峰的强度.
2 结果与讨论
2.1 三聚氰胺对CaOx成核的作用
草酸钙尿结石形成的化学本质是在基质的调控作用下从过饱和尿液中析出草酸钙晶体,其结晶过程可用下式表示:

晶体生长过程中,溶液中的离子相互作用形成过饱和溶液,析出草酸钙微粒,微粒间由于范德华力、静电作用及微粒与有机基质的作用而聚集成簇,继而形成晶核并逐渐长大.当过饱和溶液中的Ca2C2O4晶体析出时,溶液中导电离子的总浓度减少,导电能力减弱,溶液的电导率值下降,因此,通过电导率随时间的动态变化情况可以监控草酸钙晶体的结晶动力学过程[12].
草酸钙结晶的形成过程遵循结晶的一般过程,包括成核、生长与聚集三个步骤.整个结晶过程中电导率呈现不同的变化,并且每个步骤电导率的变化都有其自身的特点,代表不同的含义.反应初期电导率的变化与晶体的成核有关,反应后期电导率的变化则反映晶体的生长和聚集.
图2为草酸钙晶体生长过程中电导率随时间动态变化曲线图.在不加三聚氰胺的纯水体系中,溶液的电导率在7min内迅速下降,其后变化变缓,15min后达到沉淀溶解平衡,说明Ca2+与C2O42−反应后迅速聚集成核.加入三聚氰胺以后,达到平衡的时间分别缩短为13、12和7min,可见三聚氰胺促进了CaOx晶体的成核.并且随三聚氰胺浓度增大,促进成核能力增强.

图 2 晶体生长过程中电导率和时间的关系

图3 三聚氰胺的Mulliken电荷分布[13]
这可能是三聚氰胺通过静电作用促进钙离子在其表面聚集成簇,降低成核活化能,为成核创造条件.因为三聚氰胺的-NH2上的N是sp3杂化轨道,该胺基上的孤电子对是-NH2的一个顶端,表现负电荷性质(图3),它能结合成矿阳离子 (如钙离子),而后者再结合成矿阴离子(如草酸根离子),阴离子又结合阳离子,从而把离子聚集,有助于成簇,并且由于三聚氰胺表面负电荷的分布有序,生成的簇是结构有序的,为形成单一的草酸钙晶核创造条件.

图 4 纯水体系中CaOxa 晶体的金相显微镜图(400×).a:0.06mmol/L;b:0.12mmol/L.
图4为加入不同浓度三聚氰胺后CaOxa晶体的金相显微镜图.当三聚氰胺浓度为0.06 mmol/L(图4a),COM 晶体以多种形貌存在,这与空白溶液中得到的CaOxa 晶体相似.随着溶液中三聚氰胺浓度从0.06 mmol/L增大到0.12(图4b)和0.18mmol/L时,单位面积内COM的相对数量从6588个/mm2增加到110653个/mm2,而COM的尺寸则从5.6μm×3.6μm分别减小至2.8μm×1.2μm.但COM尺寸均比空白组得到的尺寸(9.6μm×4.9μm)小,相对晶体数量比空白组的(1870个/mm2)多(见表2).这表明三聚氰胺可以促进COM的成核.

表2 不同浓度三聚氰胺浓度对COM晶体尺寸和数量的影响
2.2 三聚氰胺对CaOx晶体生长的作用
图5为草酸钙晶体的SEM图.未加入三聚氰胺时,晶体为四角双锥的COD(图5a).加入三聚氰胺后得到的 CaOx晶体均为 COM 和 COD的混合物(图 5b).当三聚氰胺的浓度从 0.06增大到 0.12和 0.18 mmol/L时,诱导COM的质量分数分别为13%、30%和46%.这说明,随三聚氰胺浓度的增加,COD减少,COM增加.这表明三聚氰胺抑制了COD生成,促进了COM的生长.

图 5 加入不同浓度三聚氰胺后草酸钙晶体的SEM照片a:0.00 mmol/L (Bar=5μm);b:0.18mmol/L (Bar=10μm)
图6为加入三聚氰胺后CaOx的XRD谱.在空白实验(图6a)得到的产物中,主要出现COM 的衍射峰,几乎没有出现COD的特征峰.COD 的特征峰出现在0.618 ,0.442 ,0.278 nm ,分别归属于COD的(200),(211),(411)晶面.加入三聚氰胺后,同时出现了COM 和 COD 晶体的特征衍射峰.COM 主衍射峰晶面间距d值分别为 0.593 、0.365和0.298 nm ,归属于COM 晶体的(101)、(020)和(202)晶面[14].定量计算表明[9,10],三聚氰胺浓度为0.06(图6b)、0.12(图6c)和0.18(图6d)mmol/L时,COM的百分含量分别为 13 % ,30%和 46 %.

图 6 加入三聚氰胺后CaOx的XRD谱图
三聚氰胺诱导COM生成为FT-IR所证实.在空白试验中,CaOx的羰基不对称伸缩振动υas(COO−)在1647cm-1表现出强的吸收,对称伸缩振动 υs(COO−)出现在1325 cm-1与COD标样的吸收峰一致,这表明CaOx 主要是 COD.加入三聚氰胺以后(图 7),υas(COO−)红移至 1624 和 1626 cm-1,υs(COO−)均在 1321 cm-1附近.对比标样 COM,表明这些 CaOx晶体为 COD和 COM 的混合体.并且随三聚氰胺浓度的增大,υas(COO−)和υs(COO−)吸收峰向低波数方向移动,说明CaOx晶体中COM的比例依次增加,COD的比例依次减小(详见表3).

图 7 加入不同浓度三聚氰胺后CaOx晶体的FT-IR光谱

表3 三聚氰胺对CaOx晶体物相和FT—IR光谱的影响
3 结论
综上所述,本实验结果表明:三聚氰胺能抑制COD促进COM成核,并随浓度的升高,促进作用增强,并且有促进COM晶体生长的作用.由于CaOxa不同晶型与细胞亲和力不同,COM与细胞亲和力较COD大,易滞留变大,不容易排出体外[15,16],有利于草酸钙结石的形成,这增大草酸钙类结石发生的风险.
[1] World Health Organization.Melamine-contamination event.China,2008 [EB/OL] [2008-12-30]
[2] Brown CA,Jeong KS.Poppenga RH,et a1.Outbreaks of renal failure associated with melamine and cyanuric acid in dogs and cats in2004and2007[J].J Vet Diagn Invest,2007,19:525~31
[3] WU Y N,Zhao Y F,Li G J,et al.A Survey on Occurrence of Melamine and Its Analogues in Tainted Infant Formula in china[J].Biomed.Environ.Sci.,2009,22 (2):95~99
[4] Lam C W,Lan L,Che X Y,et al.Diagnosis and spectrum of melamine- related renal disease:Plausible mechanism of stone formation in humans[J].Clin.Chim.Acta,2009,402:150~155
[5] Thompson M E,Lewin-Smith MR,Kalasinsky VF,et al.Characterization of melamine-containing and calcium oxalate crystals in three dogs with suspected pet food-induced nephrotoxicosis[J].Vet Pathol 2008,45:417~426
[6] Wu C F,Liu C C,Chen B H,et al.Urinary melamine and adult urolithiasis in Taiwan[J].Clin.Chim.Acta,2010,411(3~4):184~189
[7] Sheng X X,Jung T S,Wesson J A,et al.From the Cover:Adhesion at calcium oxalate crystal surfaces and the effect of urinary constituents[J].PNAS,2005,102(2):267~272
[8] Grases F,Costa-Bauzá A,March JG,et al.Arti fi cial simulation of renal stone formation.In fl uence of some urinary components[J].Nephron,1993,65:77~81
[9] Nenow,D.,Vitkov,L.Effect of the opposite directions on the crystal face upon the growth kinetics of weddellite[J].J.Cryst.Growth,1997,182:461~464
[10] Donnet M..,Jongen N.,Lemaitre J.,et al.New morphology of calcium oxalate trihydrate precipitated in a segmented flow tubular reactor[J].J.Mater.Sci.Lett.2000,19:749
[11] Ouyang,J.M.Combined Analyses of Mixed Urinary Stones by XPS and XRD[J].Spectros.Spectr.Anal.2003,23(2):391~395 (in Chinese)
[12] 王 萍,沈玉华,谢安建,等.乌梅提取液对草酸钙晶体生长的抑制作用研究[J].无机化学学报,2008,24(10):1604~1609
[13] 陈有双,唐忠锋,张培培,等.三聚氰胺结构和热力学性质的密度泛函理论研究[J].分子科学学报,2009,25(6):418~422
[14] Mandel N.S.,Mandel G.S..Urinary tract stone disease in the United States veteran population.II.Geographical analysis of variations in composition[J].J .Urol .,1989 ,142 :1516~1521
[15] 李 霞,姚松年.卵磷酯—水体系中草酸钙模拟生物矿化的研究[J].无机化学学报,2002,18 (4):421~426
[16] Bouropoulos N.,Weiner S.,Addadi L.Calcium Oxalate Crystals in Tomato and Tobacco Plants:Morphology and in Vitro Interactions of Crystal-Associated Macromolecules[J].Chem.Eur.J .,2001 ,7 (9):1881~1888
