咖啡因与牛血清和人血清白蛋白相互作用:荧光光谱“内滤光效应”的校正
2014-08-20吴琼王二飞吴军军
吴琼,王二飞,吴军军
(湖北大学化学化工学院,湖北 武汉430062)
0 引言
从分子水平阐述蛋白质、核酸等生物大分子与具有生物活性的小分子间的相互作用特征是涉及化学、药学、生命科学等学科的交叉课题,人们一直尝试用各种物理和化学方法来获取这方面的信息,以探讨生命过程的规律.目前,在研究药物小分子与生物大分子相互作用的各种方法中,光谱方法,尤其是荧光光谱和紫外光谱等方法因其灵敏度高、选择性强、样品用量少、操作方法简便以及能提供较多的物理参数等优点而得到了广泛的应用[1].此外,圆二色谱法也成为分析蛋白质构象变化等方面的常用手段.
血清白蛋白(serum albumin)是血浆中含量最丰富的载体蛋白,可与许多内源性或外源性化合物结合[2-3].药物进入体内后,要通过血浆的贮存与运输,达到受体部位,进而发生药理作用.因此,蛋白质与药物的相互作用不仅影响药物在体内的吸收、分布,而且还影响药物在体内的代谢与排泄方式等.咖啡因是重要的天然甲基黄嘌呤类生物碱,它具有兴奋中枢神经系统和心脏、舒张血管、松弛平滑肌和利尿等重要的药理功能,在临床上的应用十分广泛[4-6].本文中主要利用荧光光谱、紫外光谱和圆二色谱等光谱学方法,研究在近似生理条件下咖啡因与血清白蛋白的相互作用,从分子水平探讨其作用机制、作用模式以及药物在血清白蛋白上的作用位置等.由于咖啡因在荧光激发波长处有吸收,其猝灭行为中包含有“内滤光效应”[7],因此我们对荧光实验数据进行了校正,分析了“内滤光效应”对咖啡因与血清白蛋白结合常数的影响.另外,还通过紫外光谱和圆二色谱考察了咖啡因对血清白蛋白二级结构的影响.
1 实验部分
1.1 试剂及溶液 咖啡因(上海第二试剂厂),牛血清白蛋白(BSA)和人血清白蛋白(HSA)(Sigma),华法林(江苏医药有限公司),布洛芬(湖北百科药业股份有限公司).实验试剂均为分析纯,实验用水为二次超纯水.所有溶液均用pH=7.4的PBS缓冲溶液或乙醇配制.
1.2 荧光光谱 用带恒温系统的F-2500荧光光度计(Hitachi,Japan),测定研究体系溶液在不同温度(298,304,310K)的荧光发射谱,以(λex=290nm,选定激发和发射狭缝均为2.5nm(BSA)及5.0nm(HSA).
1.3 吸收光谱 TU-1901紫外-可见光谱仪(北京普析分析仪器公司),波长范围450~190nm.
1.4 圆二色谱 测定室温下各不同体系溶液的远紫外(200~260nm)圆二色谱.Jasco J-810圆二色谱仪(Jasco,Tokyo,Japan),0.1cm石英样品池,扫描速度500nm/min,每个样品均扫描3次.
2 结果与讨论
2.1 荧光猝灭机理和结合常数 荧光是高能级轨道的电子返回到低能级轨道时发射光子的过程.很多种分子的相互作用都能引起荧光体的荧光猝灭,如激发态反应,能量转移,基态复合物的形成以及碰撞猝灭.
蛋白质的荧光主要来自色氨酸、酪氨酸和苯丙氨酸等能产生荧光的氨基酸基团,这3种氨基酸的荧光强度比大约为100∶9∶0.5[8],因此通常情况下可以认为蛋白质的荧光主要来自色氨酸残基的贡献.为了使血清白蛋白的荧光来自色氨酸残基的贡献而酪氨酸的影响降至最低,本文中以290nm为激发波长,通过检测加入药物前后血清白蛋白的内源荧光变化情况来表征药物与蛋白质的结合关系.
利用血清白蛋白分子中色氨酸残基的内源荧光,以λex=290nm激发,在340nm附近有很强的荧光峰;而以同样激发波长激发咖啡因溶液时,在340nm附近则没有荧光峰,表明咖啡因不会产生与血清白蛋白相互干扰的荧光.固定血清白蛋白的浓度为2.0×10-6mol·L-1,随着体系中咖啡因浓度的增加,血清白蛋白的内源荧光产生有规律的猝灭(图1).
荧光猝灭过程分为动态猝灭、静态猝灭、混合猝灭等等,为了研究和讨论的方便,通常将其分为动态猝灭和静态猝灭来讨论.无论是动态猝灭还是静态猝灭,其过程均遵循Stern-Volmer方程[9]:

式中F0和F分别表示不存在和存在猝灭剂时荧光物质的荧光强度,[Q]为猝灭剂的浓度,KSV是Stern-Volmer猝灭常数.
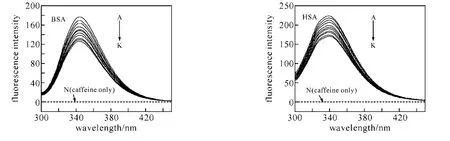
图1 咖啡因浓度对血清白蛋白荧光发射光谱的影响

由于动态猝灭依赖于扩散,温度升高时溶液的黏度下降,分子的运动加速,其结果会导致扩散系数增大,从而增大猝灭常数.若是静态猝灭,温度升高可能导致基态配合物稳定性下降,从而减小猝灭常数[9].因此可以根据不同温度下血清白蛋白的荧光猝灭情况来区分猝灭类型.为了研究咖啡因对血清白蛋白的猝灭机理,我们考察了不同温度(T=298、304、310K)条件下,咖啡因对血清白蛋白的荧光猝灭情况.以F0/F对相应的[Q]作图,由直线斜率可求得各自温度下的KSV值(表1).表1数据显示,随着温度的升高,咖啡因-BSA体系的猝灭常数减小,咖啡因-HSA体系的猝灭常数则增大,表明咖啡因对BSA的荧光猝灭机理为静态猝灭,而对HSA的荧光猝灭机理为动态猝灭.
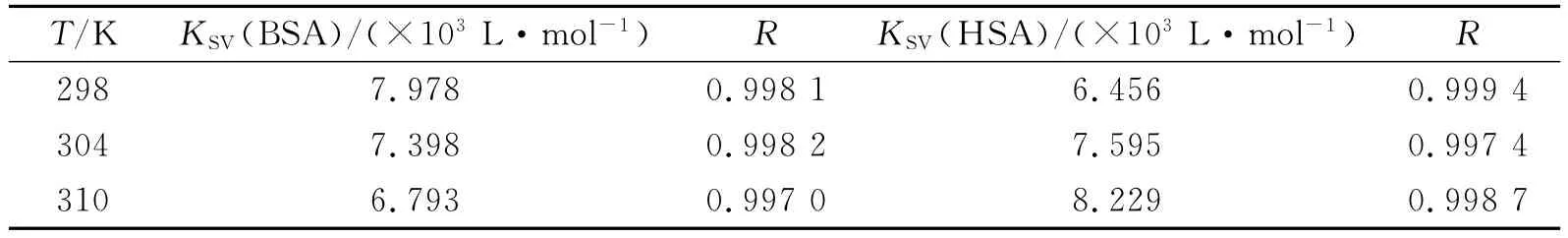
表1 不同温度下咖啡因与血清白蛋白作用的Stern-Volmer猝灭常数
对于静态猝灭,其荧光猝灭数据可用修正的Stern-Volmer方程进行处理[10]:

式中ΔF为加入猝灭剂前后荧光强度的变化,fa为蛋白质(荧光基团)可接近猝灭剂的分数,Ka为有效猝灭常数,可用作结合常数.以F0/ΔF对1/[Q]作图,即可求得蛋白质与咖啡因的结合常数Ka,列于表2.

表2 咖啡因与BSA作用的结合常数及热力学参数
假设生物大分子的若干个结合位点是独立且相同的,根据小分子与大分子配位方程[11]:

式中Kb与n分别是表观结合常数与结合位点数.根据(3)式,以lg((F0-F)/F)对lg[Q]作图,由直线斜率和截距即可求出咖啡因与HSA的表观结合常数Kb及结合位点数n,具体结果列于表3.结果显示Kb及n随体系温度升高而减小,表明咖啡因-HSA体系间形成的结合物不稳定,温度升高时发生了部分分解[11].
蛋白质的结构决定其性质与功能.HSA由585个氨基酸残基组成,仅在214位有一个色氨酸残基(Trp214).BSA由582个氨基酸残基组成,其氨基酸序列与HSA非常类似,但与HSA不同的是,BSA在134及212位上各有一个色氨酸残基(Trp134,Trp212)[12],Trp212位于蛋白质疏水腔内而Trp134则位于分子表面,因此两者的光谱性质会略有差别.可能是134位的色氨酸残基直接与咖啡因的极性基团作用而导致了两种蛋白质猝灭机理的不同,而更详细的关于两者猝灭机理的差别还有待进一步研究.
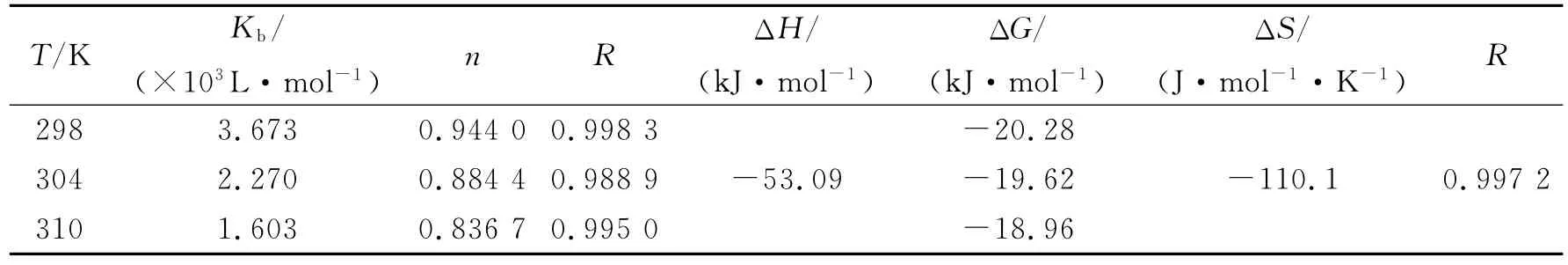
表3 咖啡因与HSA作用的表观结合常数、结合位点数及热力学参数
2.2 结合模式 药物小分子与蛋白质等生物大分子之间的相互作用通常包括静电作用力、疏水作用力、氢键、范德华力和空间位阻排斥力等[13],根据相互作用的热力学参数,可以近似判断活性小分子与生物大分子之间的主要作用力类型.若在研究的温度范围内,反应的焓变没有明显变化,视为常数,利用van’t Hoff方程可以计算反应的焓变ΔH和熵变ΔS:

式中K为对应温度下的结合常数,R为摩尔气体常数.以1nK对1/T作图,由斜率与截距可以分别计算出焓变ΔH和熵变ΔS,再由下式计算出反应的自由能变:

利用不同温度下的Ka和Kb值根据(4)式作图(图2)并计算咖啡因与血清白蛋白作用的热力学参数,结果分别列于表2和表3.
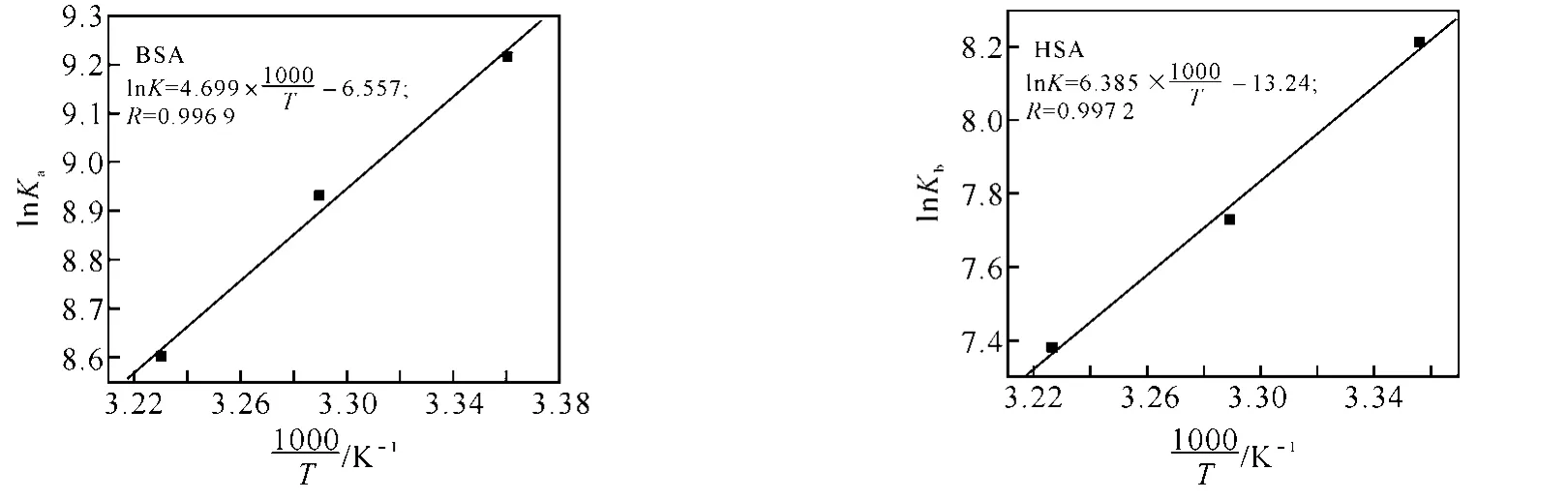
图2 咖啡因与血清白蛋白作用的van’t Hoff关系图pH=7.4,c(serum albumin)=2.0×10-6 mol·L-1
咖啡因与BSA和HSA作用的van’t Hoff关系图线性关系良好,说明在实验温度范围内,ΔH几乎保持常数.根据表2和表3结果,ΔH和ΔS均小于0,由此可以推测,咖啡因与BSA和HSA之间的作用力主要是氢键和范德华力[14],且ΔG<0,说明咖啡因与血清白蛋白的结合是由焓驱动的自发过程,体系熵变小于零,对自发过程不利.
2.3 荧光光谱“内滤光效应”的校正 由于咖啡因在荧光激发波长(290nm)处有吸收,随着样品中咖啡因浓度的增加,其猝灭行为中包含有“内滤光效应”,根据下列方程我们对荧光实验数据进行了校正[15]:

式中FC和F分别代表校正后和观察到的荧光强度,OD290为咖啡因在290nm处的光密度.“内滤光效应”对血清白蛋白荧光光谱的影响见图3.从图中可知校正后BSA和HSA的最大荧光强度猝灭约15%,而如果不校正则约为25%.根据校正后的荧光强度计算的Stern-Volmer猝灭常数以及结合常数分别列于表4和表5,结果显示KSV,Ka和Kb值均比未校正时减小.即由于咖啡因在荧光激发波长处有吸收,随着咖啡因浓度的增加,对入射光的吸收作用也增大,相当于降低了激发光的强度,从而使荧光强度下降,掩盖了配体与蛋白质结合的真实荧光猝灭情况.因此,为了深入研究药物分子与血清白蛋白的相互作用,需要对“内滤光效应”进行校正.
2.4 蛋白质的构象变化 为了考察咖啡因对血清白蛋白二级结构的影响,我们测试了不同浓度咖啡因与血清白蛋白作用的UV-vis谱(图4).随着咖啡因的加入和浓度的增加(图中A→K),咖啡因-血清白蛋白体系的吸收光谱发生明显变化,在300~250nm区域的吸收明显增强并伴随着最大吸收波长的蓝移(BSA:276→273nm,HSA:279→272nm),表明随着咖啡因的加入,血清白蛋白分子的肽链结构有所伸展,色氨酸残基所处微环境的极性增强,疏水性降低[16].
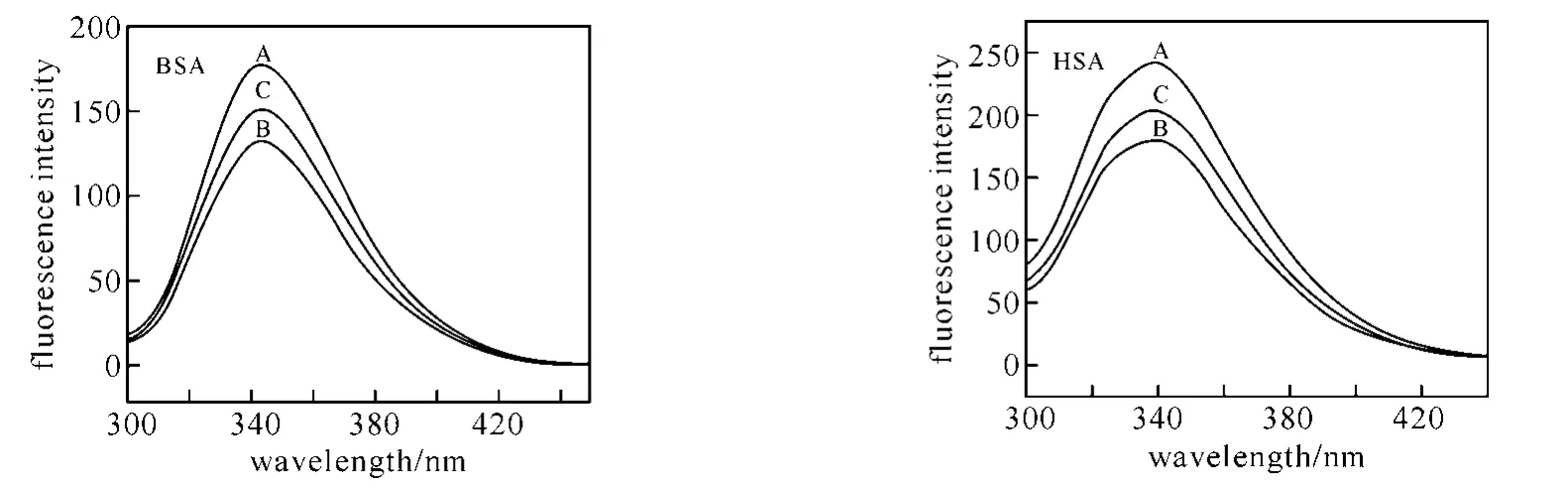
图3 咖啡因存在下血清白蛋白的荧光光谱(T=298K)
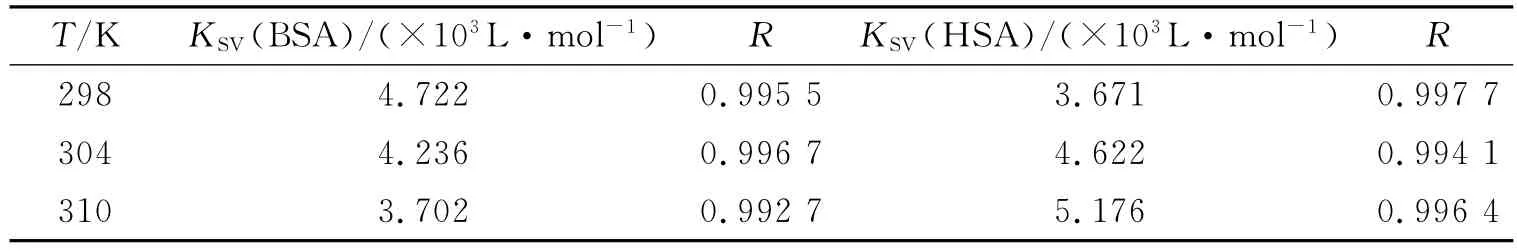
表4 校正后咖啡因与血清白蛋白作用的Stern-Volmer猝灭常数
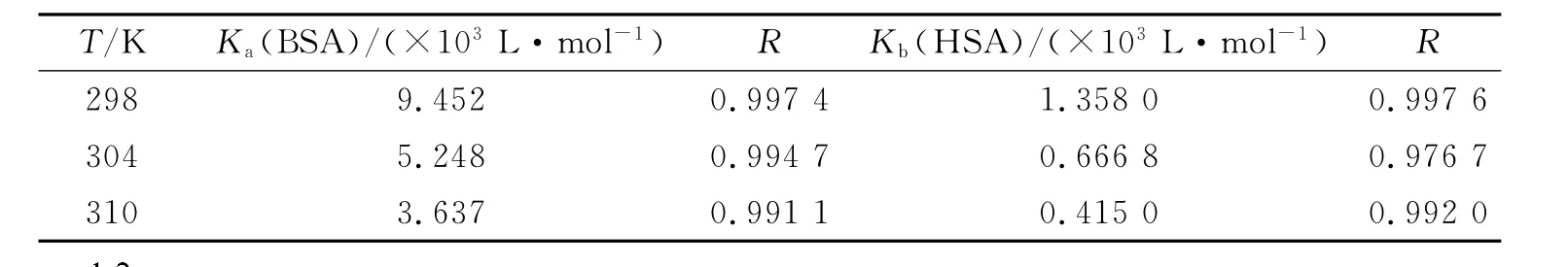
表5 校正后咖啡因与血清白蛋白作用的结合常数
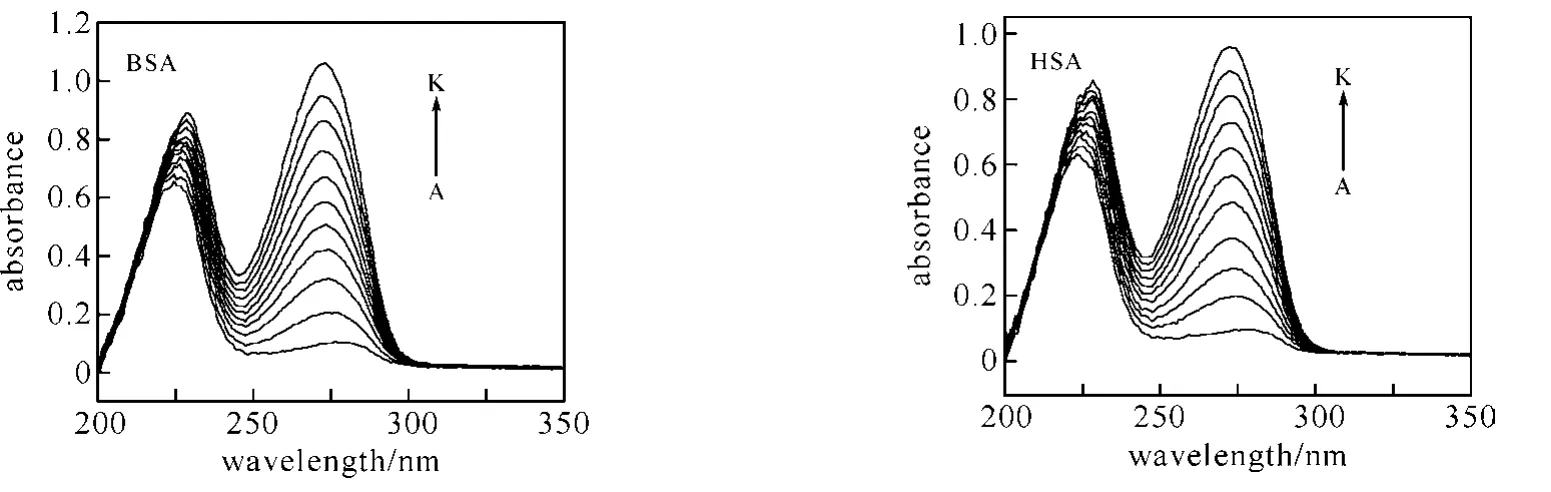
图4 咖啡因对血清白蛋白紫外吸收光谱的影响(T=298K)
圆二色谱(circular dichroic,CD)在研究蛋白质结构方面具有独特的优势,不仅可以为蛋白质的构象变化提供相关信息,而且还可以定量推算出其分子中α-螺旋、β-折叠、以及无规则卷曲的含量等[17-18].为了进一步论证咖啡因对血清白蛋白二级结构的影响,我们测试了不同浓度咖啡因与血清白蛋白作用的CD谱(图5).与文献报道一致,血清白蛋白的CD谱在208nm和222nm紫外区域出现两个负峰,这是蛋白质典型的α-螺旋的结构特征[19].
为了定量计算蛋白质不同类型二级结构的含量,我们将CD结果用含有43种已知精确二级结构模型蛋白质作为参考集的SELCON3计算程序进行分析[20-21],计算结果如表6所示.随着咖啡因浓度的增加,α-螺旋含量降低(BSA:54.5%→48.7%,HSA:46.6%→36.0%),说明血清白蛋白分子结构发生了变化,咖啡因与蛋白质主要多肽链的氨基酸残基结合,破坏了蛋白质的氢键结构[22],蛋白质则采取更松散的构象状态,导致疏水性降低.该分析结果与紫外光谱得出的结论非常一致.
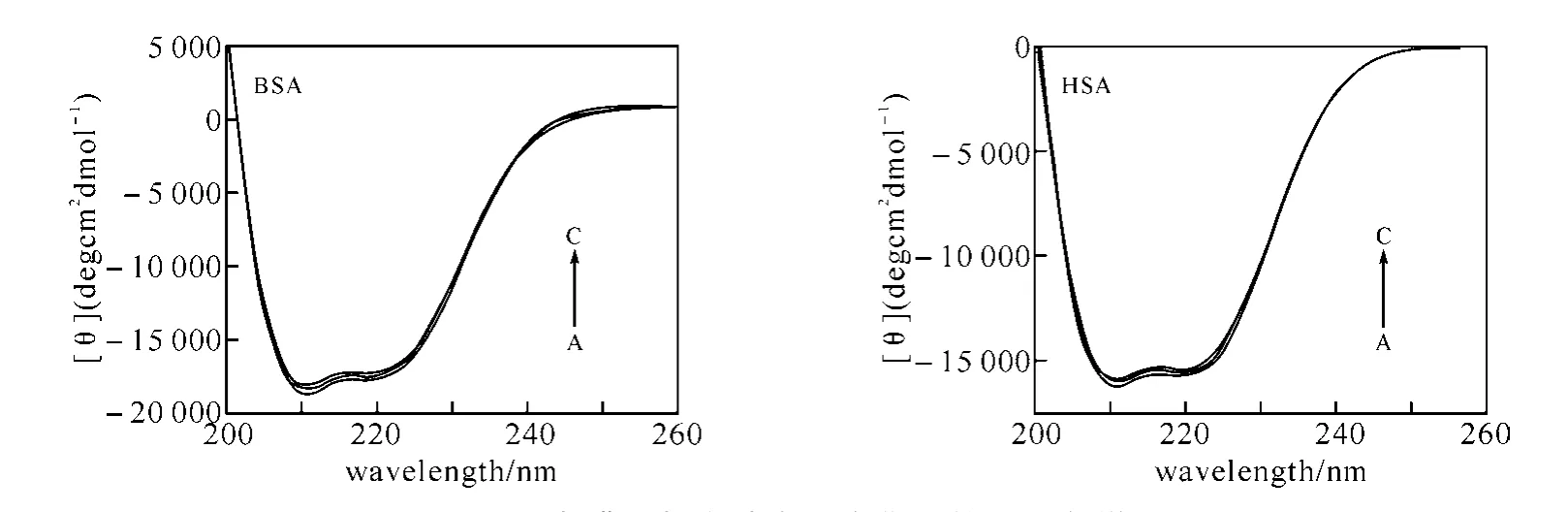
图5 咖啡因与血清白蛋白作用的圆二色谱c(serum albumin)=2.0×10-6 mol·L-1;c(caffeine)/(10-6 mol·L-1),A~C:0,10.0,20.0,respectively
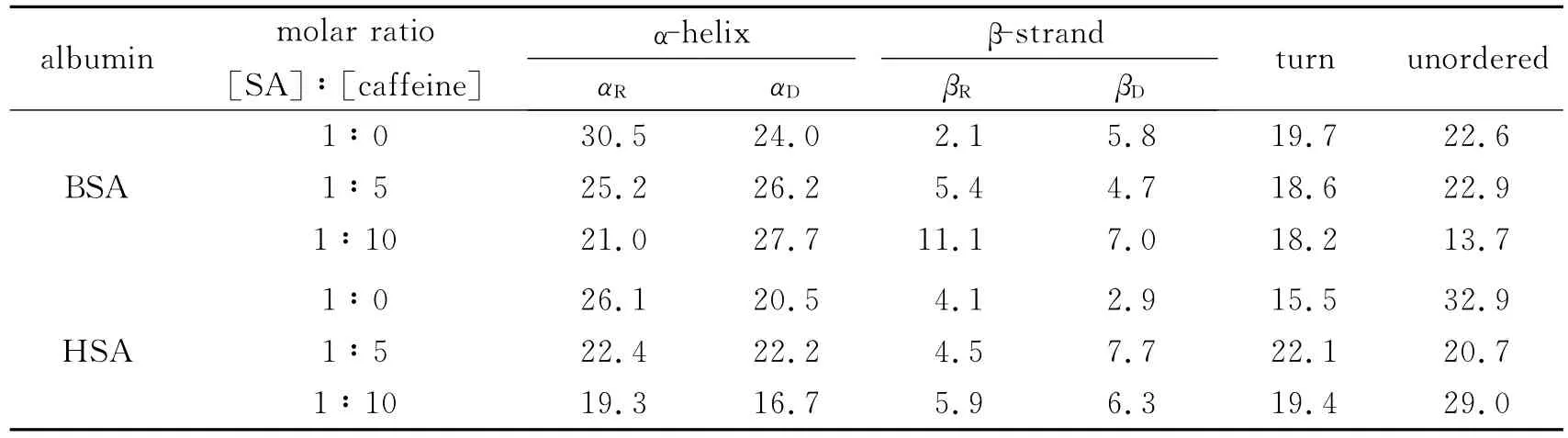
表6 由SELCON3确定的不同二级结构的含量
2.5 咖啡因在BSA上的结合部位 根据小分子与大分子配位方程(3),求出咖啡因-BSA体系结合位点数n=1.024.从表5可以看出咖啡因与BSA的结合常数较大,咖啡因与BSA作用的结合位点数约为1,表明它们之间可以形成一个强结合位点.
BSA和HSA的三维晶体结构非常类似,有3个结构域:SiteⅠ,SiteⅡ和SiteⅢ,其中每个结构域分为A,B两个亚结构域,它们以槽口相对的方式形成圆筒状结构,几乎所有疏水性氨基酸都包埋在圆筒腔内部,形成疏水腔[23].血清白蛋白的主要键合区域就位于SiteⅠ(Subdomain IIA)及SiteⅡ(SubdomainⅢA).
为了确定咖啡因在BSA上的结合位置,实验选择华法林(Warfarin)和布洛芬(Ibuprofen)分别作为SiteⅠ和SiteⅡ位[24-25]的标记物加入到咖啡因-BSA体系(图6).加入华法林后,BSA和咖啡因-BSA体系的荧光强度明显降低,而加入布洛芬后体系的荧光强度几乎没有变化,说明华法林占据了部分与BSA结合的咖啡因的位置,华法林与咖啡因竞争同一个位点,即SiteⅠ(SubdomainⅡA)位.
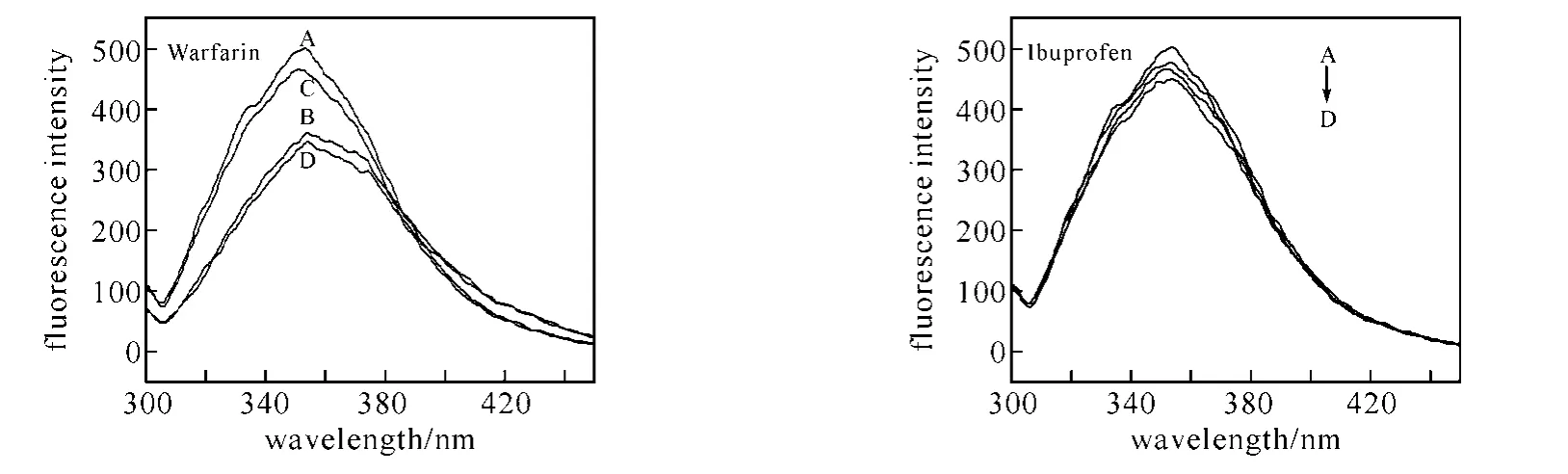
图6 位点标记物对咖啡因-BSA体系的影响(T=298K)
[1]Guo Q L,Li R,Jiang F L,et al.Characterization of the interactions between itraconazole and human and bovine serum albumins by a spectroscopic method[J].Acta Phys-Chim Sin,2009,25(10):2147-2154.
[2]Ran D H,Wu X,Zheng J H,et al.Study on the interaction between florasulam and bovine serum albumin[J].J Fluoresc,2007,17:721-726.
[3]Cui F L,Wang J L,Cui Y R,et al.Fluorescent investigation of the interactions between N-(p-chlorophenyl)-N-(1-naphthyl)thiourea and serum albumin:synchronous fluorescence determination of serum albumin[J].Anal Chim Acta,2006,571:175-183.
[4]Barone J J,Roberts H R.Caffeine consumption[J].Food Chem Toxico,1996,34:119-129.
[5]Lieberman H R,Wurtman R J,Garfield G S,et al.The effects of low doses of caffeine on human performance and mood[J].Psychopharmacology,1987,92:308-312.
[6]Jarvis M J.Does caffeine intake enhance absolute levels of cognitive performance?[J].Psychopharmacology,1993,110:45-52.
[7]Gonzalez-Jimenez J,Frutos G,Cayre I.Fluorescence quenching of human serum albumin by xanthines[J].Biochem Pharmacol,1992,44:824-826.
[8]Hu Y J,Liu Y,Zhao R M,et al.Spectroscopic studies on the interaction between methylene blue and bovin serum albumin[J].J Photochem Photobiol A-Chem,2006,179:324-329.
[9]Lakowicz J R.Principles of fluorescence spectroscopy[M].New York:Plenum Press,1999:237-265.
[10]Lehrer S S.The quenching of the tryptophyl fluorescence of model compounds and of lysozyme by iodide ion[J].Biochemistry,1971,10:3254-3263.
[11]Tong J Q,Tian F F,Li Q,et al.Probing the adverse temperature dependence in the static fluorescence quenching of BSA induced by a novel anticancer hydrazone[J].Photochem Photobiol Sci,2012,11:1868-1879.
[12]Kragh-Hansen U.Molecular aspects of ligand binding to serum albumin[J].Pharmacol Rev,1981,33:17-53.
[13]Leckband D.Measuring the forces that control protein interactions[J].Annu Rev Biophys Biomol Struct,2000,29:1-26.
[14]Ross P D,Subramanian S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20:3096-3102.
[15]Anita Krisko,Marina Kveder,Slavko Pecar,et al.A study of caffeine binding to human serum albumin[J].Croat Chem Acta,2005,78(1):71-77.
[16]Hu Y J,Liu Y,Wang J B,et al.Study of the interaction between monoammonium glycyrrhizinate and bovine serum albumin[J].J Pharm Biomed Anal,2004,36:915-919.
[17]Miles A J,Wallace B A.Synchrotron radiation circular dichroism spectroscopy of proteins and applications in structural and functional genomics[J].Chem Soc Rev,2006,35:39-51.
[18]Dong A,Matsuura J,Allison S D,et al.Infrared and circular dichroism spectroscopic characterization of structural differences betweenβ-lactoglobulin A and B[J].Biochemistry,1996,35:1450-1457.
[19]Kamat B P,Seetharamappa J.In vitro study on the interaction of mechanism of tricyclic compounds with bovine serum albumin[J].J Pharm Biomed Anal,2004,35:655-664.
[20]Sreerama N,Woody R W.A self-consistent method for the analysis of protein secondary structure from circular dichroism[J].Anal Biochem,1993,209:32-34.
[21]Whitmore L,Wallace B A.DICHROWEB,an online server for protein secondary structure analyses from circular dichroism spectroscopic data[J].Nucleic Acids Res,2004,32:W668-W673.
[22]Cui F L,Fan J,Li J P,et al.Interactions between 1-benzoyl-4-p-chlorophenyl thiosemicarbazide and serum albumin:investigation by fluorescence spectroscopy[J].Bioorg Med Chem,2004,12:151-157.
[23]Carter D C,Ho J X.Structure of serum albumin[J].Adv Protein Chem,1994,45:153-203.
[24]Sudlow G,Birkett D J,Wade D N.Characterization of two specific drug binding sites on human serum albumin[J].Mol Pharmacol,1975,11:824-832.
[25]Sudlow G,Birkett D J,Wade D N.Further characterization of specific drug binding sites on human serum albumin[J].Mol Pharmacol,1976,12:1052-1061.
