氨氮降解菌的分离、鉴定及降解效果初步研究
2014-08-19王继华杨雪辰陈黛慈
苗 苗,王继华,杨雪辰,陈黛慈,杜 雪
(哈尔滨师范大学 生命科学与技术学院,哈尔滨 150025)
氨氮降解菌的分离、鉴定及降解效果初步研究
苗 苗,王继华*,杨雪辰,陈黛慈,杜 雪
(哈尔滨师范大学 生命科学与技术学院,哈尔滨 150025)
以(NH4)2SO4为唯一氮源的培养基中,从活性污泥中分离筛选出8株具有氨氮降解能力的菌株,根据各菌株之间降解率及生长情况的比较,从中筛选出1株对氨氮降解效果较为明显的菌株NX3,经形态学和生理特性初步鉴定其为芽孢杆菌属(Bacillus),分别测定了在不同的氨氮初始浓度、pH值、温度下菌株NX3对培养基中氨氮的降解效果,实验结果表明在初始氨氮质量浓度300 mg/L、pH值7.0、温度30 ℃时,该菌株对氨氮降解效果较好,降解率为45.53%。
活性污泥;氨氮降解菌;降解效果
氨氮是水相环境中氮的主要形态,是造成水体富营养化的主要污染物,氨氮的含量是衡量污水污染程度的一个重要指标。2011年监测的26个重点湖库中,包括滇池、密云水库、千岛湖和石门水库等,其主要污染指标为氨氮、化学需氧量和生化五日需氧量,许多湖泊处于不同程度的富营养化状态[1]。海洋局召开2012年海洋环境公报新闻发布会指出,全海域共发现赤潮73次,累计面积 7 971 km2。赤潮发现次数为近5 a最多。因此,水污染已经成为一个迫在眉睫的问题,虽然目前我国在水污染防治方面做了很多工作,但是氮素仍是造成水污染的主要原因之一,近年来,国内外对氨氮废水处理方面开展了较多研究。其中生物脱氮技术备受关注,生物脱氮是利用从自然界中获得的有益微生物降低氨氮,生物脱氮以其无污染、经济和安全等优点被认为是目前最经济有效、最有前途的水体除氮方法,相关研究也备受重视[2-3]。氨氮降解菌是生物脱氮技术的关键,因此本文从活性污泥中分离筛选出1株具有较好氨氮降解能力的菌株,研究了初始氨氮的质量浓度、pH值、温度对菌株氨氮降解效果的影响。
1 材料与方法
1.1 材料
污泥:本实验所用菌种是从哈尔滨某污水处理厂活性污泥中筛选分离得到的。
LB培养基:酵母膏5 g,蛋白胨10 g,NaCl 10 g,水定容至1 000 mL,pH 值7.0(LB固体培养基为加2%琼脂);筛选培养基:葡萄糖5.0 g,(NH4)2SO42.0 g,NaCl 1.0 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,pH值7.2~7.4,水定容至1 000 mL;分离培养基:筛选培养基加2%琼脂;选择培养基:葡萄糖5.0 g,(NH4)2SO40.225 g,NaCl 1.0 g,K2HPO40.5 g,MgSO4·7H2O 0.25 g,pH 值7.2~7.4,水定容至1 000 mL(初始氨氮质量浓度约为50 mg/L) ;驯化培养基:在筛选培养基氨氮浓度基础上,不断提高氨氮浓度;模拟氨氮污水:(NH4)2SO40.47 g,NaC1 1.0 g,K2HPO40.5 g,MgSO4·7H2O 0.25 g,微量盐1 mL[4],水定容至1 000 mL(模拟氨氮污水中氨氮的初始质量浓度为100 mg/L)。
菌悬液的制备:将至少经过2次连续活化的菌株接种到装有葡萄糖蛋白胨液体培养基100 mL的三角瓶中,并在紫外可见分光光度计420 nm波长处测定其吸光度,用葡萄糖蛋白胨液体调整质量浓度,使其 OD420= 0.3, 作为菌悬液[5-6]。
1.2 方法
1.2.1 氨氮降解菌的分离与筛选
菌株的分离和纯化。取5 g活性污泥加入装有45 mL无菌水的内置玻璃珠的锥形瓶中稀释混匀,振荡培养1 h,使菌胶团充分打散,从中取0.1 mL菌液经梯度稀释涂布于LB培养基平板上,在37 ℃培养箱中培养2~3 d后,在平板上挑选出不同形态的单菌落编号并反复划线进行多次分离纯化,直至得到纯培养物,最后将纯化后的各菌株转至斜面保存。
氨氮降解菌的筛选与驯化。将纯化所得各菌株接种至筛选培养基,置37 ℃、120 r/min振荡培养5~7 d后,从中选取浑浊度相对较高的作为初筛试验菌,取各初筛试验菌液0.1 mL,分别涂布至分离培养基中,将分离出的各初筛试验菌接种至驯化培养基,对初筛菌进行不断驯化,最终得到试验菌株。
1.2.2 氨氮降解菌的生长曲线测定
将菌株接种到选择培养基振荡培养,每隔2 h取样,在紫外可见分光光度计600 nm波长下测定其光密度(OD)值,并绘制光密度(OD)值与培养时间的关系曲线。
1.2.3 环境因素对氨氮降解菌的降解效果的影响
将菌种分别接种至装有40 mL筛选培养基的100 mL锥形瓶中,分别在不同温度(25、30、35、40、45 ℃)、不同pH值(6.0、6.5、7.0、7.5、8.0)和不同氨氮初始浓度(50、100、200、300、400 mg/L)条件下进行单因素试验,测定培养基中残余氨氮质量浓度,计算氨氮的降解率,确定反应的温度、pH值、氨氮初始浓度对菌株降解氨氮效果的影响。
1.2.4 降解效果的测定方法
吸取10 mL菌悬液,2 000 r/min离心10 min,弃去上清液,再用10 mL生理盐水洗涤沉淀,混匀,再次离心,如此重复3次,以除去菌种活化过程中产生的氨氮[7]。用10 mL生理盐水清洗沉淀,最后制成氨氮降解菌种液,按10%的接种量将菌种液接入装有40 mL选择培养基的100 mL锥形瓶中,于120 r/min摇床振荡培养48 h后,经2 000 r/min 离心10 min,取上清液测残余氨氮浓度并与未接种菌株的空白培养基作对比,测定培养液中氨态氮含量[8],计算出氨氮降解率。
氨氮的测定: 采用纳氏试剂分光光度法[9]进行。
1.2.5 氨氮降解菌株NX3的初步鉴定
氨氮降解菌NX3经细胞形态和个体菌落形态的观察、生长特征及生理生化特征,具体参照文献[10-11]进行初步鉴定。
2 结果与分析
2.1 氨氮降解菌的分离与筛选结果
从哈尔滨某污水处理厂二沉池采集的污泥,经富集、分离、纯化,共获得26株菌。将纯化所得26株菌经筛选与驯化后,最终得到8株菌,编号分别为:NX3、NX6、NX10-1、NX11-1、NX11-2、NX13-1、NX13-2、NX24。8株菌的主要特征见表1。将这8株菌按10%的接种量,接入到模拟氨氮污水中,于37 ℃、120 r/min条件下培养24~48 h后,计算8株菌的氨氮降解率,结果见图1。并测定这8株菌在以(NH4)2SO4为唯一氮源的无机盐培养基中的生长曲线,结果见图2。最后通过8株菌的降解率结果及在以(NH4)2SO4为唯一氮源的无机盐培养基中的生长情况,综合比较选择出1株在筛选培养基中生长速度较快、相对氨氮降解率较高的NX3菌株进一步试验。

表1 8株氨氮降解菌的主要特征
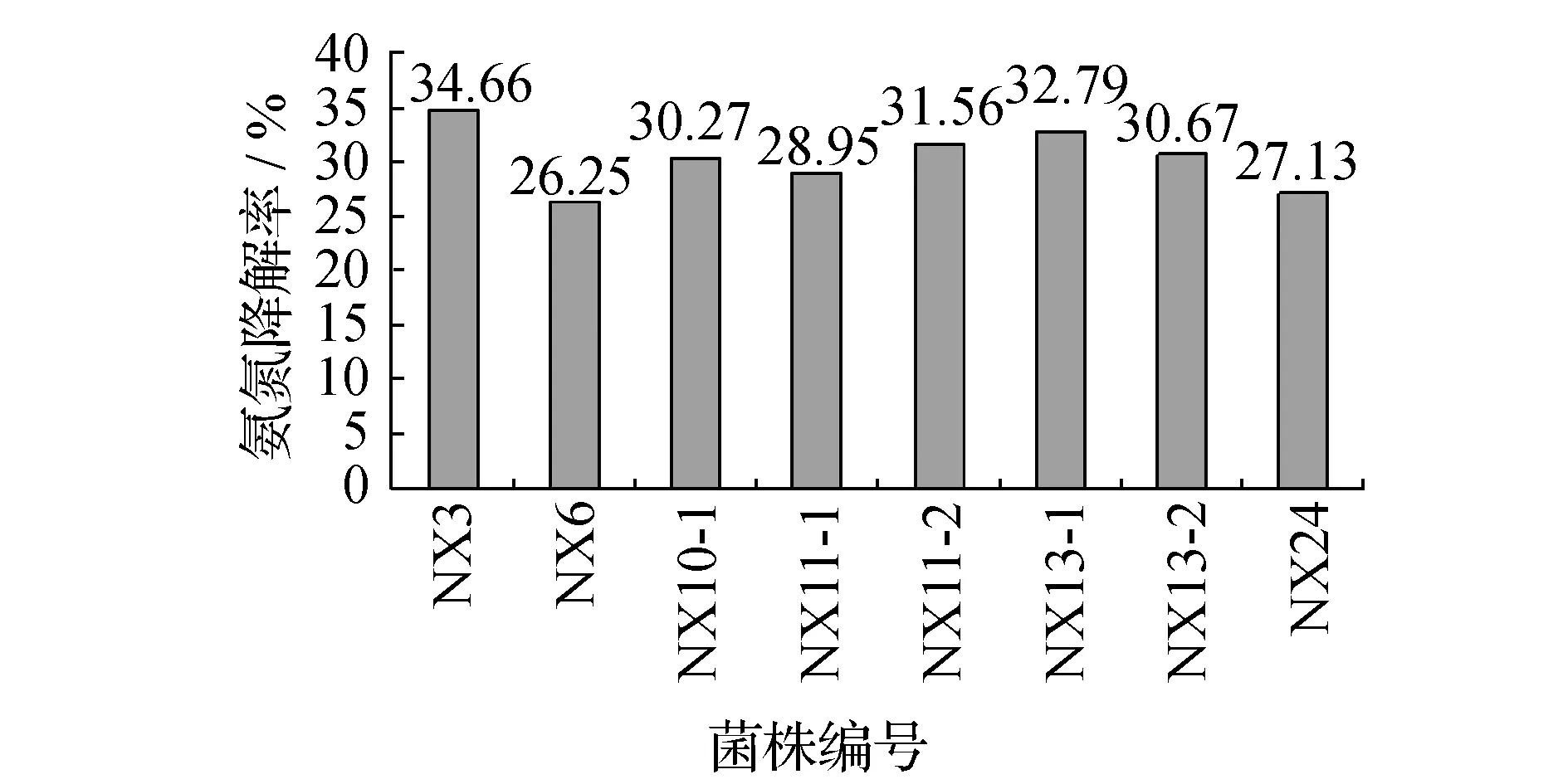
图1 8株菌的氨氮降解率Fig.1 Degradation rate of eight bacterias
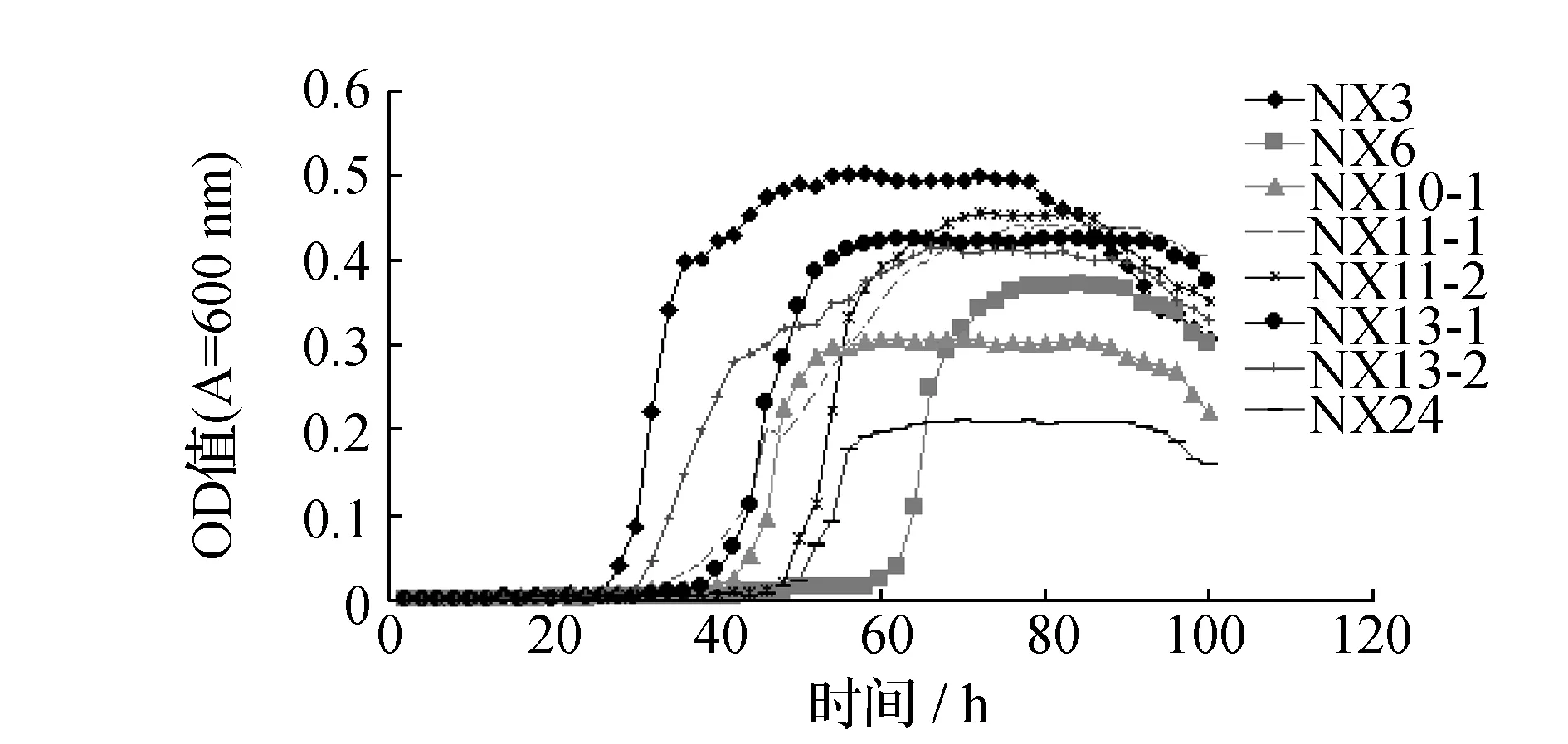
图2 8株菌的生长曲线Fig.2 Growth curve of eight bacterias
为进一步提高NX3菌株降解氨氮的能力,从处理温度、反应的pH值及初始氨氮质量浓度3个方面的环境因素进行优化分析。
2.2 环境因素对菌株降解效果的影响
2.2.1 处理温度对氨氮降解效果的影响
温度是影响微生物生长与代谢的重要环境因素之一,同时也是影响生物脱氮的重要原因。吸取NX3菌的菌种液,实验按10%的接种量,分别接种到预先配置初始氨氮质量浓度为100 mg/L的选择培养基中,然后分别置于温度为25、30、35、40、45 ℃,120 r/min摇床振荡培养,48 h后测定培养基中残余的氨氮浓度,计算相应的氨氮降解率,绘制氨氮降解率与反应温度的曲线,结果见图3。由图3可见在选择培养基中随着反应温度的升高,曲线呈现上升趋势,氨氮降解率有所增加,在30 ℃时达到最大值,但随着温度进一步升高,氨氮降解率反而下降。可能由于微生物产生的酶具有最适温度,酶的活性在一定温度范围内是随温度升高而增加的,但当温度超过这个最适温度后,酶活就会逐渐降低,酶甚至出现失活,相应的酶所催化的酶促反应速率也将随之下降。因此NX3菌株适宜温度为30 ℃。
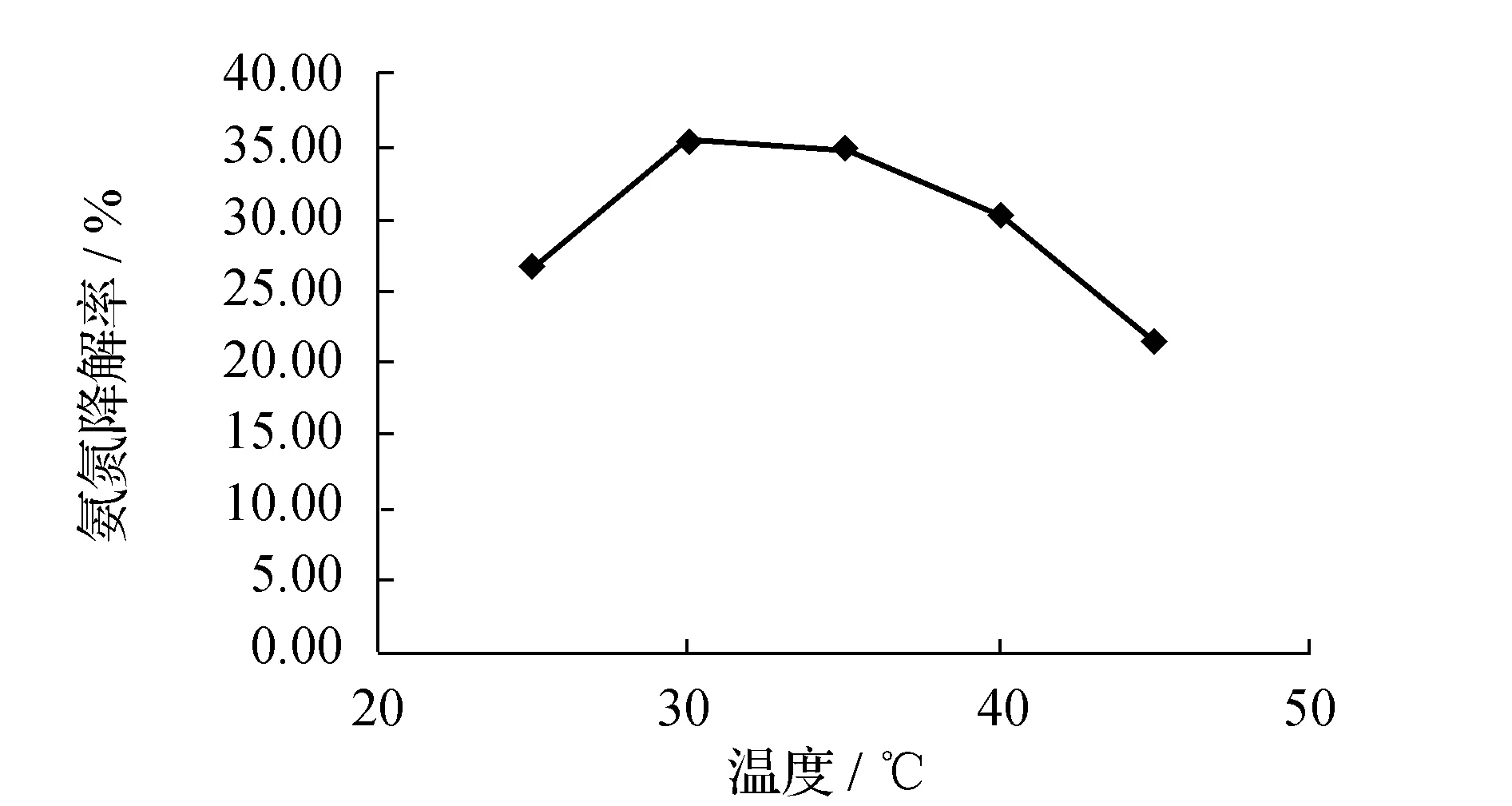
图3 处理温度对氨氮降解效果的影响 Fig.3 Effect of temperature on ammonia nitrogen removal
2.2.2 反应pH值对氨氮降解效果的影响
将初始氨氮浓度为100 mg/L的选择培养基的pH值分别调至6.0、6.5、7.0、7.5、8.0。吸取NX3菌的菌种液,实验按10%的接种量,分别接种至配置好的选择培养基中,在30 ℃、120 r/min的条件下摇床振荡培养48 h后,测定培养基中残余的氨氮质量浓度,计算相应pH值下氨氮的降解率,并绘制出氨氮降解率与pH值的关系曲线,结果见图4。由图4可见随着选择培养基中pH值的逐渐升高,菌株对氨氮的降解率呈现上升趋势,pH值在7.0时,氨氮降解率达到最大值为35.70%,随后曲线呈现逐渐下降趋势。这可能由于外界环境中氢离子的浓度超过或低于微生物酶的一定的适应范围,而引起该种微生物原生质膜的电荷发生变化,影响微生物对营养物质的吸收及其酶的活性,进而影响酶促反应的速率,从而影响微生物的代谢。因此在考虑初始时菌株的生长需要,反应的pH值应控制在7.0左右为宜。

图4 反应pH值对氨氮降解效果的影响Fig.4 Effect of pH on ammonia nitrogen removal
2.2.3 初始氨氮质量浓度对氨氮降解效果的影响
当污水中氨氮浓度过高时,氨氮降解菌及其他细菌的生长会受到抑制甚至停止,从而影响其对氨氮的降解[12]。分别配制氨氮初始含量为50、100、200、300、400 mg/L的选择培养基,反应的pH值调节至7.0,将NX3接种至上述培养基中,在30 ℃、120 r/min条件下摇床振荡培养,48 h后测定选择培养基中的残余氨氮质量浓度,计算出相应的氨氮降解率,并绘制氨氮降解率与氨氮初始质量浓度的关系曲线,结果见图5。培养基的氨氮质量浓度在50~200 mg/L时,曲线呈现明显的上升趋势,说明随着培养基中初始氨氮质量浓度逐渐升高,其菌株对氨氮的降解率也随之升高;初始氨氮质量浓度在300 mg/L时降解率达到最大为45.43%;当初始氨氮的质量浓度高于300 mg/L时,曲线呈现下降趋势,表示随着初始氨氮质量浓度的升高,该菌株对氨氮的降解率呈现出下降趋势。菌株NX3的不同初始氨氮质量浓度影响的实验结果表明,当初始氨氮质量浓度较高时,其氨氮降解效果较为明显,说明此时环境中的营养对NX3菌的生长较为适宜,而初始氨氮质量浓度过高时,会对菌株NX3的生长产生一定的抑制作用,导致菌株对氨氮的降解率下降,因此,氨氮降解菌NX3适宜的氨氮初始质量浓度为300 mg/L。
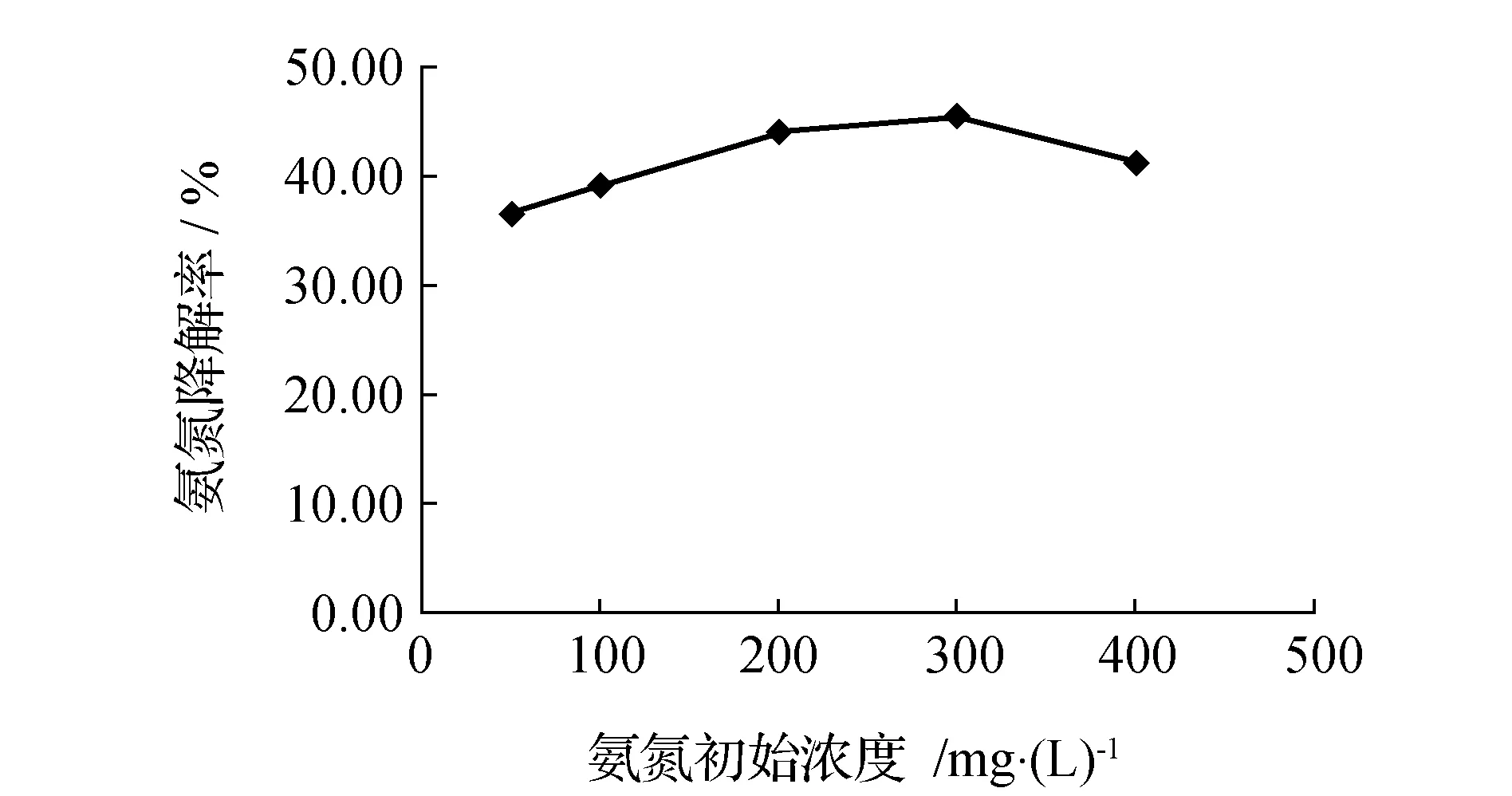
图5 初始氨氮质量浓度对氨氮降解效果的影响Fig.5 Effect of ammonia nitrogen beginning concentration on its removal
2.3 NX3菌株的初步鉴定
菌株NX3菌落为中央白,边缘呈透明,边缘锯齿状;菌体为杆状菌,有芽孢、无荚膜,无鞭毛,革兰氏染色结果为革兰氏阳性;NX3菌株生理生化实验,结果见表2,根据文献[10-11]初步鉴定,这些特征均符合芽孢杆菌属(Bacillus)的特征。

表2 NX3的生理生化特性
注:“+” 代表阳性;“-”代表阴性。
3 结 论
通过对活性污泥中微生物的分离与纯化,以硫酸铵为唯一氮源筛选得到1株对氨氮具有较好降解作用的菌株NX3,经鉴定为芽孢杆菌属(Bacillus),是一类具有重要的环境修复意义的微生物。选择NX3菌为研究菌种,进一步测定氨氮降解的影响因素。考察了处理温度、pH值、初始氨氮质量浓度对该菌株氨氮降解效果的影响,研究结果表明当温度为30 ℃,pH值为7.0,初始氨氮质量浓度为300 mg/L时,该菌株对氨氮的降解效果较好,氨氮降解率为45.43%。因此应用该微生物降解污水中的氨氮,改善环境是可行的。
[1]Ministry of Environmental protection of the People's Republic of China,China environmental state bulletin in 2011[J/OL]. http://jcs.mep.gov.cn/hjzl/zkgb/2011zkgb
(中华人民共和国环境保护部,2011年中国环境状况公报)
[2]李 帆,荚 荣,查 诚.脱氮菌株P6的分离鉴定及其处理氮氮废水的试验研究[J].生物技术,2007,17(5):64-68.
Li F,Jia R,Zha C.Experimental study on isolation and identification of nitrogen removal of nitrogen in wastewater treatment of strain P6[J].Biotechnology,2007,17(5):64-68.(in Chinese)
[3]Moreno B,Gomez M A,Gonzalez-Lopez J,et al.Inoculation of a submerged filter for biological denitrification of nitrate polluted groundwater:a comparative study[J]. Hazard Mater,2005,117(2-3):141-147.
[4]Kim J K,Park K J,Cho K S,et al.Aerobic nitrification-denitri-fieation by heterotrophic Bacillus strains[J].Bioresource Technology,2005,96:1 897-1 906.[5]朱 伟,李 娜.高效氨氮降解菌的筛选鉴定及降解能力测定[J].安徽农业科学,2008,32(22):9 361-9 362.
Zhu W,Li N.Screening and identification on high effective microorganisms degrading ammonia-nitrogen and determination on its degradation ability[J].Journal of An hui Agri. Sci. 2008,36(22):9 361-9 362.(in Chinese)
[6]Miyahara M,Kim S-W,Fushinobu S,et al.Potential of aerobic denitrification by Pseudomonas stutzeri TR2 to reduce nitrous oxide emissions from wastewater treatment plants[J].Applied and Environmental Microbiology,2010,76(14):4 619-4 625.
[7]易 弋,容元平,程谦伟,等.养殖水体氨氮降解菌的分离和初步鉴定[J].贵州农业科学,2011,39(2):154-157.
Yi Y,Rong Y P,Cheng Q W,et al.Isolation and identification of ammonia nitrogen degradation strains from aquaculture water[J].Guizhou Agricultural Sciences,2011,39(2):154-157.(in Chinese)
[8]蔡钰颖,商 平,魏丽娜,等.氨氮降解微生物菌株的分离筛选及去除效果初步研究[J].净水技 术,2008,27(3):44-47.
Ca Y Y,Shang P,Wei L N,et al.Pilot study on separ ation selection and removal effect of ammonia nitrogen bacterium[J].Water Purification Technology,2008,27(3):44-47.(in Chinese)
[9] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法:第4版[M].北京:中国环境科学出版社,2009:133-136.
The editorial board for monitoring and analysis methods of water and wastewater of State Environmental Protection administration.Monitoring and analysis methods of water and wastewater(4th edition)[M]. Beijing:China Environmental Science Press,2009:133-136.(in Chinese)
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
Dong X Z,Cai M Y.The manual of systematic methods of determinative bacteria[M].Beijing:Science Press,2001.(in Chinese)
[11]R.E.布坎南,N.E.吉本斯.伯杰细菌鉴定手册:第8版[M].北京:科学出版社,1984.
Buchanan R E,Gibbons N E.Bergey’s Manual of Determinative Bacteriology(8th edition)[M].Beijing:Science Press,1984.(in Chinese)
[12]Joo H S,Mitsuyo H,Makoto S. Improvement in ammonium removal eficiency in wastewater treatment by mixed culture of Alcaligenes faecal is No.4 and L1[J].J Biosci Bioeng,2007,103:66-73.
Isolation, identification and degradation of ammonia nitrogen degradating bacterium
MIAO Miao, WANG Ji-Hua*, YANG Xue-Chen, CHEN Dai-Ci, DU Xue
(Life Science and Technology College, Harbin Normal University, Harbin, 150025, China)
(NH4)2SO4as the sole nitrogen source medium, isolated eight strains with the ability to degrade ammonia from activated sludge screening,a high effective microorganism named NX3 in degrading ammonia-nitrogen was obtained after comparison of degrading rate and growth among the various strains.The strain was initial identified asBacillus, then utilized the biomass to test the optimal conditions of growth.Experimental results show that the ammonia-nitrogen could be degraded 45.53% when the strain was 30℃, with the initial concentration at about 300 mg/L, and pH value was about 7.0.
activated sludge; ammonia degradating bacteria; degradation
10.13524/j.2095-008x.2014.01.013
2013-10-21
黑龙江省教育厅科学技术研究重点项目(12521Z010);哈尔滨师范大学大学生实践创新基金项目(Sj060803);黑龙江省研究生创新科研资金项目(YJSCX2012-190HLJ)
苗 苗(1990-),女,黑龙江双鸭山人,硕士研究生,研究方向:微生物遗传,E-mail:272728361@qq.com;*通讯作者:王继华(1972-),女,黑龙江庆安人,教授,研究方向:微生物遗传学、环境微生物,E-mail:wangjihua333@hotmail.com。
Q93
A
2095-008X(2014)01-0059-05
