制备低剂量四氯化碳诱导小鼠慢性肝损伤模型的探讨
2014-08-15李梦翟亚南王晶晶孟霞孙泉陈柏安卢静
李梦,翟亚南,王晶晶,孟霞,孙泉,陈柏安,卢静
(首都医科大学实验动物部,北京 100069)
建立人类疾病动物模型对于研究疾病的发生发展和发病机制非常重要。肝损伤动物模型的制备方法有很多,根据发病时程可分为急性、慢性和慢加急性肝损伤模型;根据模型制作方式可分为手术法、药物法等。急性的、药物法的肝损伤模型较多,然而急性肝病只占临床病人的少部分,慢性病例占据大多数,而且慢性肝病初期不易察觉,难以诊断,因此肝病的慢性过程逐渐引起重视。药物模型有很多,重复性和模拟性好的药物毒性大,而其他的则建模结果不够稳定。并且,目前用大鼠制作肝损伤动物模型较多,而现在每年小鼠的使用量仍占实验动物总量的一半以上,而且小鼠的基因组研究的最透,实验相关的试剂和材料来源最广,所以,使用低毒性的药物建立和复制小鼠慢性肝损伤动物模型非常重要。本研究使用低浓度四氯化碳制备更加安全便捷的慢性肝损伤动物模型。本实验使用0.5% CCl4给予小鼠连续腹腔注射6周(1次/3天),发现血清ALT、AST浓度极显著性增高(P<0.01)、肝上皮细胞呈广泛性空泡样变及大量坏死,肝小叶内出现明显的条索样纤维增生,其纤维化程度评分显著性升高(P<0.05),纤维显色积分光密度值极显著性增高(P<0.01)。低剂量CCl4诱导后,小鼠呈现明显肝损伤改变,现将本实验结果报道如下。
1 材料与方法
1.1 实验动物
SPF级B/C雄性小鼠20只,体重18~20 g,购于北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】。饲养在首都医科大学实验动物部【SYXK(京)2010-0020】,室温20~25℃之间,空气流通,相对湿度40%~70%,正常光照条件,自由进食进水。
1.2 实验试剂
CCl4,溶液购自北京现代东方精细化学品有限公司。Masson染色试剂盒购自南京建成科技有限公司,20100318。
1.3 动物分组与模型制备
将B/C小鼠随机分为正常对照组(6只)、油对照组(6只)、CCl4模型组(8只)。正常对照组给以正常饮食,饲养6周;油对照组腹腔注射法注射鲁花花生油,10 μL/g,1次/3天,连续6周; CCl4模型组腹腔注射法注射0.5% CCl4注射液(0.75 mL CCl4原液加入149.25 mL花生油配成0.5%的慢性CCl4注射液),10 μL/g,1次/3天,连续注射6周。
1.4 样本处理
连续腹腔注射第6周,各组小鼠麻醉后(10%水合氯醛,0.35 mL/100 g)眼眶动静脉采血法采血。采血时间为每日上午8:30-10:30,时间固定,离心取血清。采血后颈椎脱臼处死,取出肝脏,用滤纸吸干血迹,将最大叶1/3剪下,置于4%甲醛溶液中固定,经脱水、透明、包埋后制成蜡块并切片(0.5 μm)。
1.5 血清检测
使用日立7180全自动血生化仪检测血清AST、ALT剂量。
1.6 肝组织HE及Masson染色
使用Leica Autostainer XL自动染色仪水化并HE染色,使用Masson染色试剂盒行Masson染色,使用Nikon数字显微照相机观察并拍摄照片。。
1.7 肝纤维化程度评判
(1)采用盲评法,HE染色切片,40×10倍光镜下,每组随机选取5个视野。标准如下:“-”无成纤维细胞增生,计0分;“+”汇管区扩大,有少量成纤维细胞增生,计1分;“++”汇管区成纤维细胞增生并向小叶内延伸,呈较窄较短的纤维素条,计2分;“+++”汇管区成纤维细胞大量增生并向小叶内明显延伸,形成纤维隔伴有小叶结构紊乱,计3分。
(2)Masson染色半定量分析,Masson染色切片,40×10倍光镜下,每组随机选取6个视野使用Nikon数字显微照相机观察并经行积分光密度测量。
1.8 统计学处理方法
数据以平均值 ± 标准差( mean ± SD) 表示,实验结果用 SPSS 13.0 软件进行处理,各组数据采用单因素方差分析,并作两两比较。取P<0.05有统计学意义。
2 实验结果
2.1 血清ALT、AST变化
如表1示,第6周CCl4模型组B/C小鼠血清ALT浓度与正常对照组、油对照组比较极显著性增高(P=0.00);AST浓度与正常对照组、油对照组比较极显著性增高(P=0.00)。
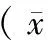
表1 第6周CCL4肝损伤B/C小鼠血清ALT、AST浓度组间比较±s)
2.2 病理学特征
小鼠肝组织HE、Masson染色结果(图1、2,见彩插6):HE染色可见,正常对照组小鼠肝小叶结构完整,肝窦清晰、较宽,肝上皮细胞排列整齐,呈多边型,细胞质均匀红染,细胞核清晰,未见明显肿胀变性,枯否氏细胞分布均匀,未见局部大量聚集;油对照组与正常对照组比较,小叶结构、细胞形态、分布未见明显差异;10倍镜下可见CCl4模型组小鼠肝小叶结构异常紊乱,肝上皮细胞呈广泛性空泡样变,出现明显的结节性增生和大量坏死点,40倍镜下可见坏死的肝上皮细胞明显空泡样变,大量上皮细胞核浓缩、溶解、坏死,坏死细胞处出现枯否氏细胞聚集并相互融合形成多核巨细胞,对坏死细胞进行吞噬,血窦在肿胀的上皮细胞相互挤压下变细或消失。Masson染色可见,正常对照组肝组织10倍镜下可见均匀的淡蓝色细条索状染色,40倍镜下可见,蓝染部位为肝上皮细胞间质;油对照组与正常对照组比较,染色性状与部位未见明显改变;CCl4模型组肝组织出现大面积广泛蓝染,局部区域出现粗大条索样蓝色深染,特别是在肝上皮细胞大量变性坏死区域,蓝色深染充斥整个区域,细碎偏淡的条状蓝染已经融合成粗大、深蓝的结节样改变。
2.3 肝纤维化程度评价
6周时(见图2),CCl4模型组小鼠肝组织汇管区成纤维细胞大量增生并向小叶内明显延伸,形成纤维隔伴有小叶结构紊乱。经盲评法评判肝纤维化程度(见图3-a),CCl4模型组小鼠与油对照组小鼠比较,其肝组织纤维化程度评分显著性升高(P=0.00);经Masson染色后积分光密度值比较(见图3-b),CCl4模型组小鼠与油对照组小鼠比较,其积分光密度极显著性增高(P=0.00)。

图3 肝组织纤维化程度评分结果(a)和肝纤维化吸光度结果(b)
3 讨论
CCl4进入机体后,经肝脏细胞色素P450激活,生成CCL3·。CCL3·生成后,能够与细胞膜上的不饱和脂肪酸反应生成脂肪酸原子团,从而引起脂质过氧化而导致细胞膜、细胞器损伤。CCl4致肝损伤主要表现为血清中AST、ALT含量增加和肝上皮细胞脂质过氧化或坏死,在病理上主要表现为上皮细胞肿胀、脂肪变性,继而破裂坏死,大量枯否氏细胞聚集吞噬,随着损伤程度加深,肝细胞增殖减弱,胶原纤维大量堆积,形成条索状增生。
本实验结果显示:第6周时,HE染色后,10倍镜下可见CCl4模型组小鼠肝小叶结构紊乱,出现明显的结节性增生和大量坏死点,40倍镜下可见坏死的肝上皮细胞肿胀,大量上皮细胞核浓缩、溶解、坏死,坏死细胞处出现枯否氏细胞聚集并相互融合形成多核巨细胞,对坏死细胞进行吞噬,血窦在肿胀的上皮细胞相互挤压下变细或消失。而在相同部位Masson染色可见,CCl4模型组肝组织出现大量结节样蓝色深染,特别是在肝上皮细胞大量变性坏死区域,蓝色深染充斥整个区域,细碎偏淡的条状蓝染已经融合成粗大、深蓝的结节样改变(见图1、2)。同时,CCl4模型组连续腹腔注射6周时,与正常对照组比较其血清ALT、AST浓度均大幅升高。AST升高10倍以上,而ALT升高100倍以上,提示在6周时,CCl4模型组小鼠出现了明显的肝损伤(见表1)。
有关肝损伤模型的研究结果不尽相同,原因在于肝损伤过程中药物浓度与给药时间对模型成功与否影响重大。较强的药物刺激能够迅速导致肝损伤发生,但其死亡率偏高。而较低的药物刺激能够较好的保障模型动物的存活率,但其造模时间较长[4]。因而,如何能在较低强度药物刺激下,缩短成模时间,既提高实验动物存活率,降低实验动物使用量,又能缩短成模时间,减轻实验动物痛苦与科研物力财力消耗,是目前肝损伤模型研究的现实意义所在,亦是动物福利3R原则的体现。根据张海燕实验提示:①当四氯化碳溶液的浓度超过50%或给予剂量大于2.5 mL/(kg·bw)以上时,肝损伤明显但易导致动物急性中毒而死亡。②给药间隔时间,1~2d注射一次容易导致动物中毒死亡,而给药间隔超过4~5d 时动物肝脏损伤不明显。原因在于肝脏再生能力强,给药间隔较长时肝脏能够通过肝细胞再生等修复机制迅速恢复肝功能。因此,为了能在有效维持四氯化碳致肝损伤效果的基础上降低死亡率,应采用小剂量四氯化碳注射且给药间隔时间为3d的造模方法。其实验结果显示,每3d注射一次20%四氯化碳持续8周后,大鼠血清ALT和AST水平显著升高,肝细胞出现典型的胞质疏松化、气球样变,可见散在的点状、碎片状坏死及炎性细胞浸润,还伴有明显的纤维化改变[5],肝损伤明显。基于以上实验思路与报道,我们将该方法移用在B/C雄性小鼠身上,并选用更低剂量CCl4(0.5%)1次/3天连续注射6周,观察其肝损伤情况。结果在第6周发现与正常对照组比较模型小鼠血清ALT、AST浓度均极显著性升高,HE、Masson染色显示大量肝细胞脂肪变性、坏死及条索样胶原纤维形成(见表1,图1、图2)。对于胶原纤维增生的评价,我们采用了人工盲评和积分光密度统计两种方法,两种方法均显示CCl4模型组小鼠与油对照组小鼠比较,其胶原纤维增生显著性升高(见图3)。由此可见,对于B/C雄性小鼠而言,每3天注射一次0.5% CCl4的低强度药物刺激方式,在6周时可以出现明显的肝损伤及纤维样变。
本实验通过分析肝脏病理形态结构和血清生化指标对低剂量CCl4诱导B/C小鼠肝损伤模型进行评价,结果显示:低浓度四氯化碳通过腹腔注射法可以复制小鼠肝损伤动物模型,降低了四氯化碳的毒副作用,具有推广意义和应用价值。
(本文图1、2见彩插6。)
[1] 卫生部.保健食品功能学评价程序及检验方法规范 [S].2003版,133-135.
[2] 王宇,程薇波,张银柱,等.10%四氯化碳致大鼠慢性肝损伤的研究 [J].现代预防医学,2006,33(5):701-703.
[3] 林琳,刘汉锋.40%四氯化碳大鼠慢性肝损伤模型稳定性的研究 [J].广西医学,2009,31(7):922-924.
[4] 张孝卫,耿秀兰,黄丽华,等.四氯化碳致大鼠、小鼠肝损伤的对比实验 [J].基础医学与临床,2003,23(3):351-352.
[5] 张海燕,温韬,卢静,等.四氯化碳诱导大鼠慢性肝损伤模型方法的探讨 [J].实用肝脏病杂志,2009,12(3):161-163.
