2A97 Al-Cu-Li合金在铝酸盐和磷酸盐电解液中等离子电解氧化膜的性能
2014-08-13曹金晖程英亮左安蕾彭昭美
曹金晖,程英亮,左安蕾,彭昭美,梁 兵
(1. 湖南大学 材料科学与工程学院,长沙 4100082;2. 国防科学技术大学 指挥军官基础教育学院,长沙 410072)
Al-Cu-Li合金因其低密度、高比强度、高比刚度而在航空工业上具有非常广泛的应用[1−3],正因为这种应用的特殊性,所以对它的耐腐蚀性及其耐磨性能提出更高的要求。
等离子电解氧化技术(Plasma electrolytic oxidation,PEO),又称微弧氧化或阳极火花沉积, 是在传统阳极氧化基础上发展起来的一种高压表面处理技术,可以在 Al[4−6]、Ti[7−8]、Mg[9−10]、Zr[11−13]等金属形成具有耐磨、耐蚀及生物相容性等的功能性涂层。该技术是在合金表面原位生长,成膜速度快、与基体附着力强,且反应过程中对环境几乎不产生污染等优点而在国内外成为表面工程领域近年研究的热点。
关于铝合金的等离子电解氧化的研究开展较早,已有广泛的文献报道[14−19]。但由于等离子电解氧化技术的复杂性,牵涉到电极溶液界面的化学反应、电化学反应、等离子热化学反应等多个过程,关于等离子放电过程及膜层的生长机理、微观结构的研究远未完善[19]。而且具体到Al-Cu-Li合金,有关PEO的研究很少[20],最近,本文作者开展对2A97铝锂合金在直流[21]和脉冲交流条件下PEO的研究[4]。在本文作者前期的研究中[4],报道Al-Cu-Li合金中合金元素Cu对PEO膜层颜色的影响,发现Cu元素以氧化亚铜的形式参与成膜,赋予 PEO膜层暗红色的外观。此外,Al-Cu-Li合金的PEO膜层由内外两层组成,两层之间分布着尺寸很大的微孔。通过纳米压痕和摩擦实验发现,PEO膜层的外层很致密,在摩擦磨损中起到一定的抗磨作用,从而更正了国际上对铝合金外层是疏松层的普遍看法[4]。此外,为了解释PEO膜层的双层结构,提出了一个PEO过程的改进的火花放电模型[4]。
通常用于金属PEO处理的电解液有硅酸盐[12−13]、磷酸盐[9]和铝酸盐[22]体系。在前期的研究工作中,本文作者采用硅酸盐电解液[4,21],对于硅酸盐电解液中获得的Al-Cu-Li合金PEO膜层[4],在低浓度时得到如前所述的双层结构,而高浓度时,得到的是以莫来石为主的膜层,此膜层的耐磨性比低浓度时的膜层的小得多。这是因为低浓度时得到以γ-Al2O3为主的膜层,其硬度远高于莫来石的硬度(高浓度时的膜层主要成分)。为了进一步研究在其他电解液体系中 Al-Cu-Li合金的等离子电解氧化行为以及得到的膜层性能,本文作者开展铝酸盐和磷酸盐电解液中 Al-Cu-Li合金的 PEO的研究,并对两种不同电解液体系得到的膜层性能进行了比较,对其产生的差别进行了深入的分析。
1 实验
实验材料采用的是 2A97铝锂合金板材,板材经过热处理[4],线切割成20 mm×10 mm×4 mm的样品,试样的一面与铜导线相连,然后用环氧树脂进行包封,制成面积为 2 cm2的试样,试样依次用80号到2000号的SiC砂纸打磨,并用酒精、蒸馏水擦洗,再进行等离子氧化处理。
等离子氧化过程采用5 kW的交流微弧氧化电源(MAO-5D,Pulsetech Electrical Co., Ltd),用样品做阳极,80 cm2的钢板做阴极,电解槽为1 L烧杯,采用磁力搅拌电解液,同时,烧杯外通冷水进行冷却,使PEO处理过程中电解液保持温度在30 ℃以下。电源参数设置频率为1 kHz,正、负占空比为20%,正电流为 0.4 A,负电流为 0.3 A,电解液分别用 8 g/L NaAlO2+1 g/L KOH和10 g/L (NaPO3)6+1 g/L KOH,分别处理不同时间,然后分析在不同电解液体系制得的等离子电解氧化陶瓷膜的性能。
采用 TT260履层测厚仪(北京时代之峰科技有限公司)测量等离子电解氧化膜层的厚度;膜层表面和截面形貌检测用环境扫描电子显微镜(SEM,QUANTA2000,FEI,USA);通过 X 射线衍射仪(Rigaku D/MAX 2500)检测膜的相组成。
2A97铝锂合金PEO膜层的耐蚀性通过动电位极化曲线来评价。电化学测试在CHI660C电化学工作站上进行, 采用三电极体系,将2A97铝锂合金或经PEO处理的试样作为工作电极, 铂片为辅助电极, 饱和甘汞电极(SCE)为参比电极, 在3.5%中性NaCl溶液中进行测试,试验中先将电极浸泡10 min,待体系稳定后进行极化曲线测量,从开路电位−500 mV向正向扫描,扫描速度为1 mV/s。
等离子氧化膜的耐磨性用CETR UMT−3摩擦仪进行评价,采用球−块式摩擦方式。此方法是用直径为9.5 mm,硬度为62 HRC的Cr钢球在经PEO处理的试样表面做往复式运动,行程为7.2 mm,分别使用载荷为10 N和30 N的力,频率为5 Hz。摩擦试验后,使用光学轮廓仪对磨痕深度及磨痕形貌进行分析。
2 结果与讨论
2.1 时间与电位关系
图1所示为正向电流密度和负向电流密度分别为200和150 mA/cm2时,在铝酸盐和磷酸盐电解液中的时间与槽电压关系图(槽电压为电源控制面板输出值)。由图1可知,不管是在磷酸盐电解液还是在铝酸盐电解液中,总体趋势是正负电压随着时间的延长而增加。当在低电压时,电压不足以击穿其在表面生成的氧化膜,电极表面的氧化膜以普通阳极氧化的方式生长。当电压升至400 V时,在阳极表面可以看到明显的火花放电现象,并伴有大量的气体冒出。当经过电压快速上升的初始阶段后,电位—时间曲线出现拐点,此后,曲线进入缓慢上升的阶段,在此阶段,火花放电的密度有所降低,但火花放电的强度增强。对比磷酸盐和铝酸盐的正向时间—电位曲线,磷酸盐中曲线拐点的电位(约 516 V)高于铝酸盐中拐点出现的电位(约467 V),文献[23]中把拐点对应的电位定义为等离子电解氧化过程的击穿电位(Breakdown voltage)。处理3600 s 后,磷酸盐中的终止电位为666 V,高于铝酸中的终止电位 649 V。 在两种电解液中的负向电位低于相应的正向电位,PEO处理的负向终止电位分别为 151 V(铝酸盐)和91 V(磷酸盐)。
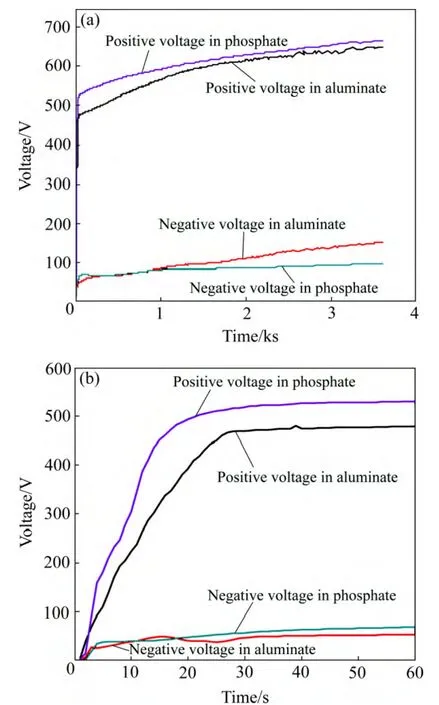
图1 Al-Cu-Li合金在不同电解液中时间—电位曲线Fig. 1 Voltage—time curves of PEO treatment of Al-Cu-Li alloy in different electrolytes
2.2 膜层的生长动力学曲线
图2所示为2A97铝锂合金微弧氧化膜层的厚度与时间的关。从图2中可以看出,在两种电解液体系中,随着反应时间的增加,膜层厚度逐渐增加,几乎呈线性增长关系。在铝酸盐电解液中,PEO处理60 min时,膜层厚度达到97.9 μm,其平均增长速率约为1.6 μm/min;当反应时间超过30 min后,由于火花数目减小、强度增强,且其移动性减弱,强烈的火花将导致膜层标准差增大,膜层变得粗糙。在磷酸盐电解液中,膜层也大致呈现线性增长关系,但其成膜速度远远不如铝酸盐,在前 60 min时,平均成膜速率约为 1.3 μm/min,但在磷酸盐电解液中,火花放电强度稍弱,所以成膜均匀,光滑度比较好。

图2 在不同电解液下膜层生长厚度与时间的关系Fig. 2 Relationship between coating thickness and time for PEO treatments of Al-Cu-Li in aluminate and hexametaphosphate electrolyte
2.3 PEO膜层的表面与截面形貌
图3所示为在铝酸盐电解液中不同PEO处理时间所得膜层的表面的二次电子图像。图3(a)为处理2 min的试样的表面形貌。此时对应于火花放电的初期,火花的尺寸很小,但数量众多。等离子电解氧化过程和普通的阳极氧化的不同点在于前者工作于氧化膜层的击穿电位之上。氧化膜击穿之后,在电极表面形成火花(即等离子体),火花的分布、尺寸对得到的膜层形貌有重要的影响。氧化膜的击穿由局部的热效应所引发,通常发生于氧化膜表面的宏观或微观缺陷处(如电解液所填充的缝隙、微孔和缺陷等处)[23]。图3(a)显示,氧化膜表面存在大量的微孔,这些微孔应是PEO过程火花放电通道冷凝后所形成。由于对应于放电初期,火花尺寸小、密度大,氧化膜表面由单个火花放电所引起的特征尺寸较小,相应氧化膜也比较平整(氧化膜的厚度标准差很小)。当处理时间为10 min时,氧化膜表面出现明显的饼状结构(Pancake structure)(见图3(b)),这种饼状结构是 PEO膜层的典型微观结构之一,常发现于铝合金、锆合金 PEO膜层微观结构中[4,11]。每个饼状结构的中心都存在着单个放电微孔,在扫描电镜观察中,微孔有可能为开放或闭合状态,它是PEO过程物质传输的通道,阳离子成分(如Al3+)从微孔喷射而出,与电解液接触遇冷在微孔周围凝固,同时电解液中的阴离子在强大电场力的作用下也可以从微孔被拖进氧化膜的内部参与成膜[4]。随着处理时间延长到30 min,饼状结构的尺寸增大,图3(b)中饼状结构直径约为15 μm,而处理30 min的PEO膜层中,饼状结构的直径可达约40 μm左右。饼状结构尺寸的增加和 PEO过程火花放电的尺寸的变化相关。根据HUSSEIN等[24]提出的等离子氧化过程中的放电模型,饼状结构由B型火花放电引起,这是一种从金属−氧化膜界面开始,穿过氧化膜直到膜层−电解液界面的火花放电模型。通常,火花放电源于氧化膜的电介击穿,而这种击穿往往在氧化膜的薄弱处发生,随着PEO过程的进行,膜层的厚度增加,氧化膜的薄弱处数量降低,因此,发生在电介击穿处的阳极电流增大,相应的火花尺寸也增大[23],作为火花放电引起的饼状结构的尺寸也随着增大。
图4所示为PEO处理30 min和60 min的氧化膜的截面SEM像。从图4看出,铝酸盐中得到的膜层在微观结构上分为内外两层,两层之间分布着横向尺寸达100 μm以上、纵向尺寸为20~40 μm左右的微孔。随着反应时间的延长,内层厚度有所增加(对比图4(b)和(d))。这种结构与本文作者先前研究 Al-Cu-Li合金在硅酸盐中得到的膜层的截面结构类似[4]。PEO膜层微观结构中大尺寸微孔的形成机理在文献[24]中已经进行了详细的探讨,其原因是PEO过程大量气体的释放有关,PEO过程中,电解液可以通过放电微孔进入膜层的内部,在等离子放电的高温高压下(放电通道温度可达4000~7000 K[24],压力可达100 MPa[25]),电解液气化,同时由于阳极过程还要产生大量的氧气,这些都是等离子氧化过程气体的来源[4]。关于内层膜层的生长,本文作者在文献[4]中提出了D类型火花放电模式来解释这个现象。
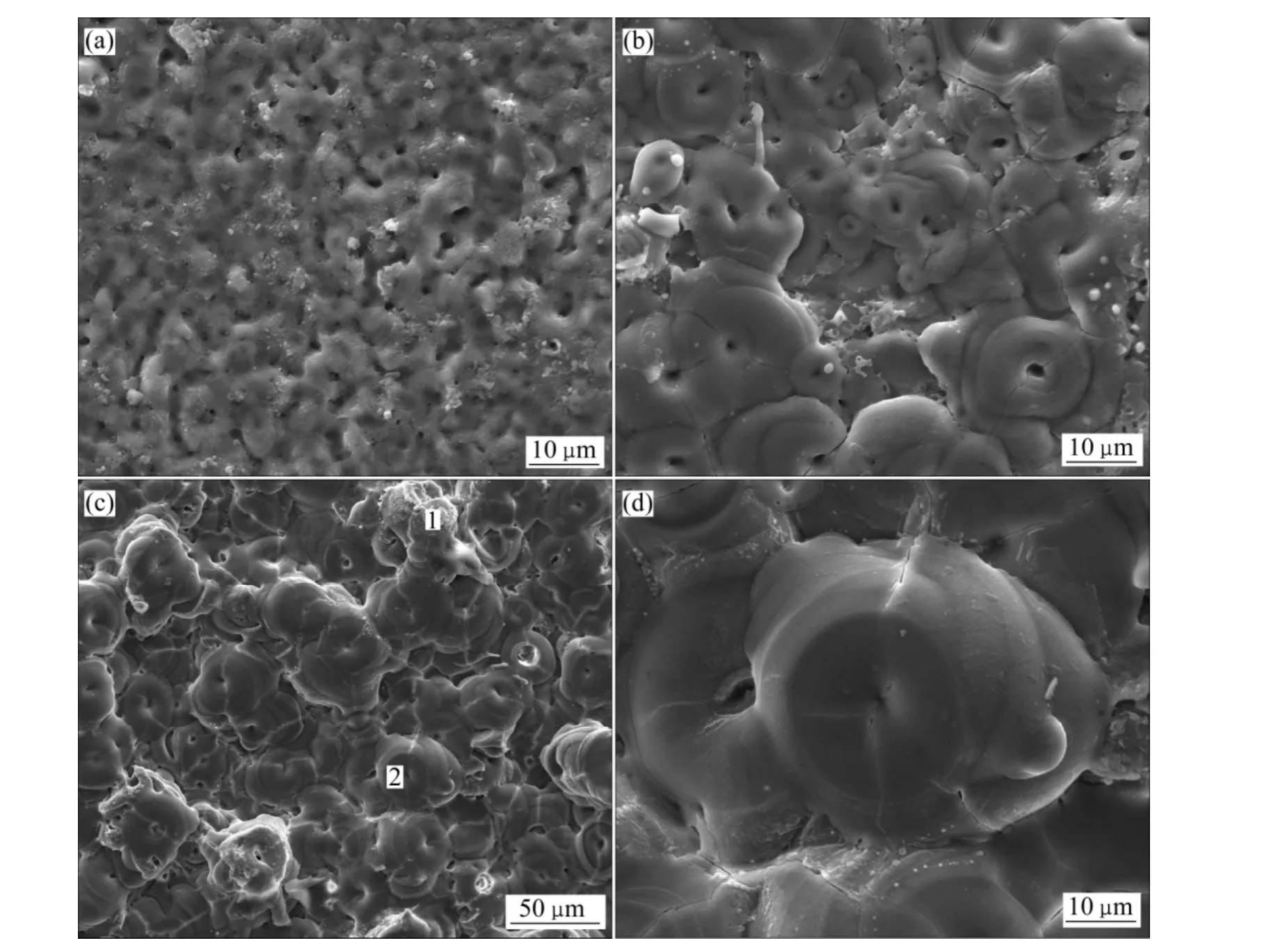
图3 铝酸盐溶液中处理不同时间的PEO膜层表面形貌Fig. 3 Surface morphologies of coating formed in aluminate electrolyte for different times: (a)2 min; (b)10 min; (c), (d)30 min
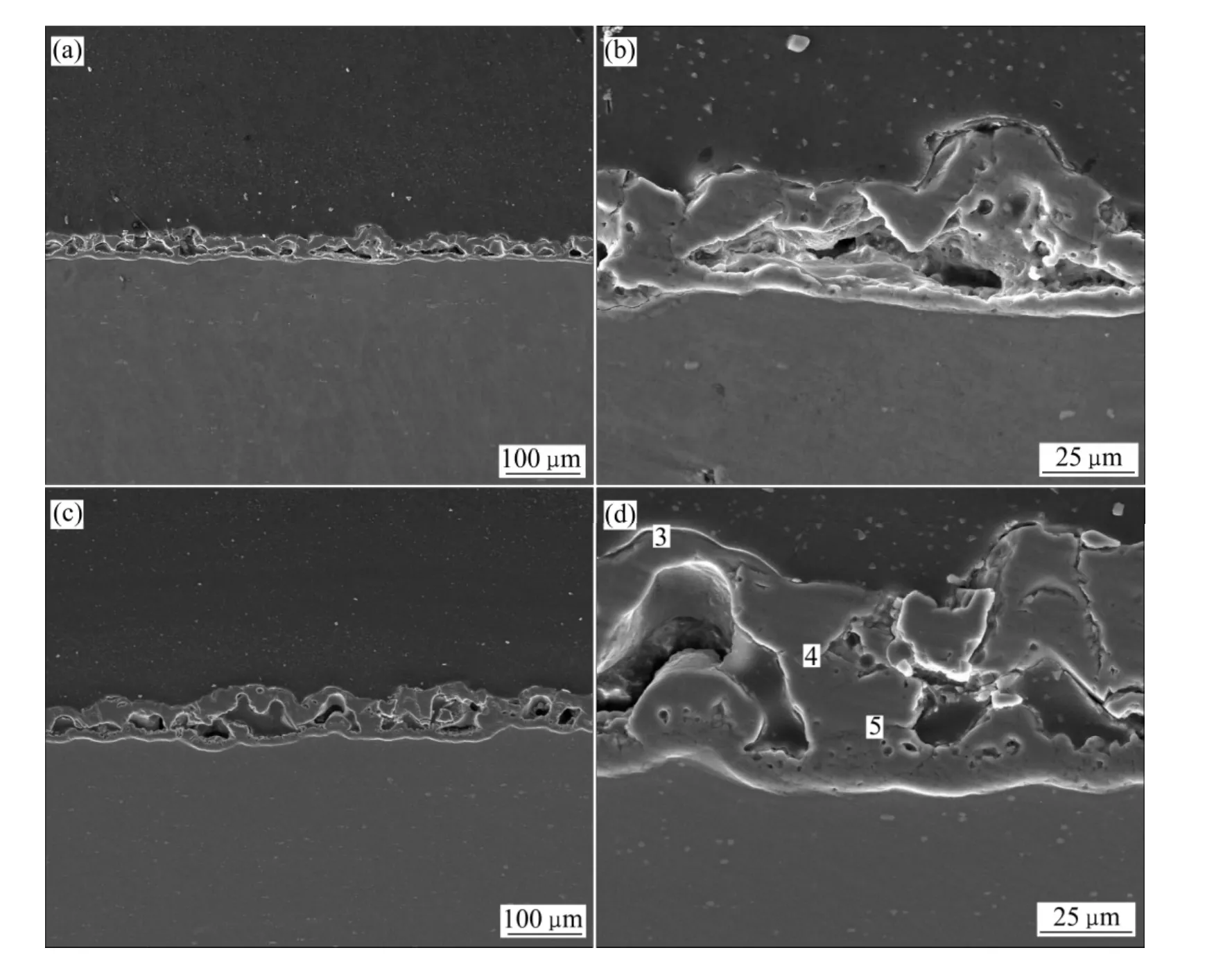
图4 铝酸盐电解液中处理不同时间的PEO膜层截面形貌Fig. 4 Cross sectional morphologies of coating formed in aluminate electrolyte for different times: (a), (b)30 min; (c), (d)60 min
表1所列为铝酸盐中得到的PEO膜层的EDS分析结果(对应于图3、4中用数字标定的位置)。从表1看出,由于电解液使用的是铝酸盐溶液,氧化膜的成分主要为Al和O,氧化膜中也探测到了少量的Cu(来源于合金元素)。
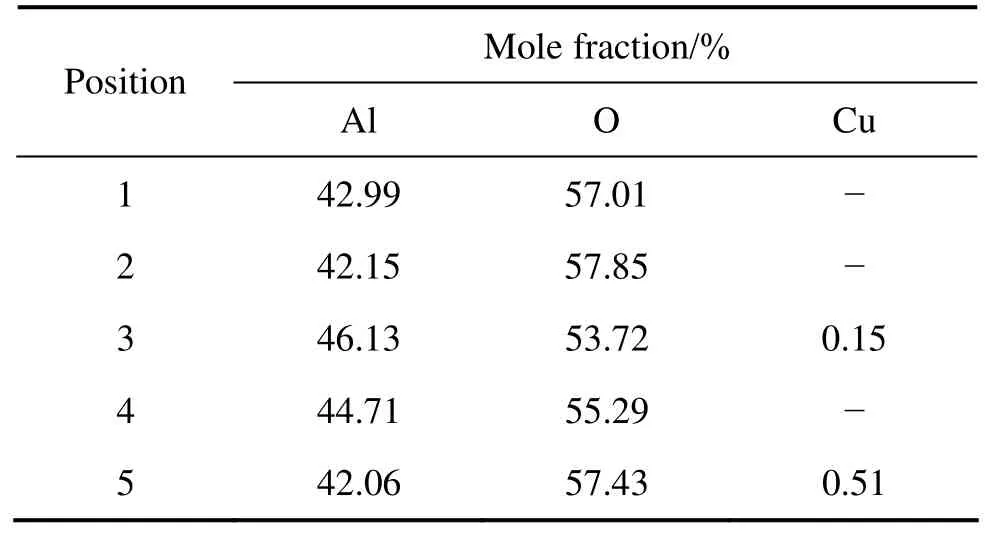
表1 图3和4中不同位置处铝酸盐膜层EDS能谱分析Table 1 EDS analyses of PEO coatings from aluminate electrolyte at different positions in Figs. 3 and 4
图5所示为磷酸盐电解液中得到的PEO膜层在不同处理时间的表面和截面形貌。与铝酸盐中得到的膜层微观形貌相比较,Al-Cu-Li合金在磷酸盐电解液中得到的膜层结构和前者基本类似。图5(a)和(b)表明,磷酸盐电解液中的 PEO膜层的表面也由饼状结构构成,且饼状结构的尺寸随处理时间的延长而增大。图5(c)和(d)分别为处理30 min的试样的截面不同倍数的形貌,从截面可以看出,PEO膜层依然大致分为两层,内外层之间分布着大尺寸的孔洞。对处理60 min试样的表面和处理 30 min试样的截面的不同区域进行了能谱分析,其结果列于表2中。与铝酸盐中得到的膜层不同的是,在磷酸盐中得到的膜层中有一定量的电解液成分(P)参与了成膜。图5(b)中的区域1显示的是饼状结构的表面组成,约有0.77%(摩尔分数)P。对30 min试样截面的EDS分析表明,氧化膜截面外层(区域2)的P含量与表面(区域1)接近。在氧化膜的孔洞和内层(对于图5中区域3和4)处,P含量分别为3.33%和3.87%,其含量反而比氧化膜的外层有所升高。对于这种现象的解释是含有P的阴离子成分通过放电通道进入膜的内层,在膜的内层分解、发生热化学反应而参与成膜,因此,内层和孔洞处的P含量反而比作为饼状结构外层的P含量高。

图5 Al-Cu-Li合金在磷酸盐电解液中处理不同时间的PEO膜层表面和截面形貌Fig. 5 Surface and cross section morphologies of coatings formed on Al-Cu-Li alloy treated for different times in hexametaphosphate electrolyte: (a)Surface, 10 min; (b)Surface, 60 min; (c), (d)Cross section, 30 min
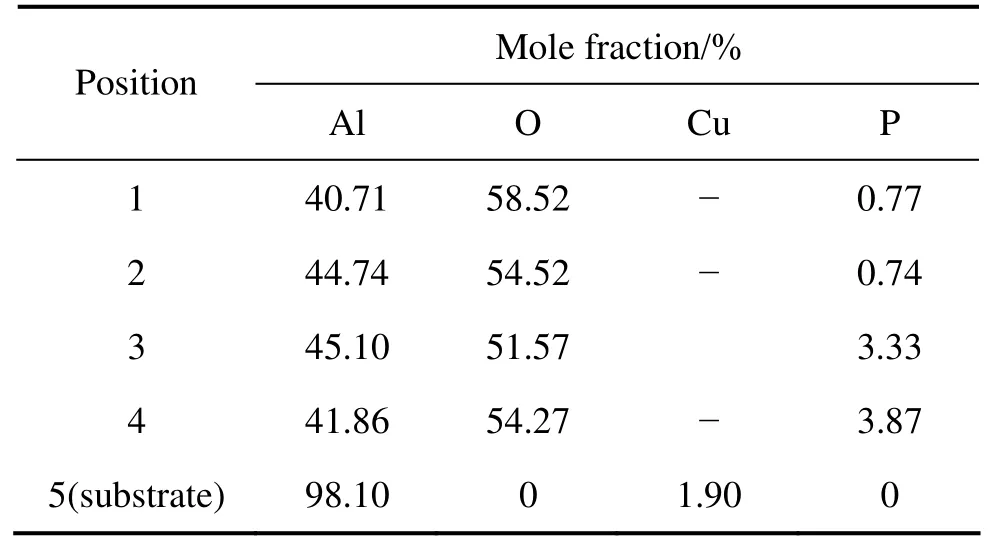
表2 图5中不同位置磷酸盐膜层EDS能谱分析Table 2 EDS analysis results of PEO coatings from hexametaphosphate electrolyte at different positions in Fig. 5
2.4 膜层的相组成
图6所示为铝酸盐体系下和磷酸盐体系下PEO处理30 min膜层的XRD谱。根据前面EDS能谱分析知膜层主要成分为Al和O,此外,从磷酸盐电解液中得到的膜层中还有少量的P。而从XRD谱上可以看出,两种体系下PEO膜层的衍射峰十分类似,其主要相为α-Al2O3和 γ-Al2O3,还含有少许的 δ-Al2O3和 Al基体。图6中还可以看出,在铝酸盐体系下,α-Al2O3相的衍射峰强度高于磷酸盐电解液体系得到的膜层中的α-Al2O3的衍射峰强度,因此,在铝酸盐中形成 PEO膜层中 α-Al2O3的含量可能要高于磷酸盐中所形成膜层中的。在磷酸盐电解液中得到的膜层中没有发现和P有关的物相存在,这可能是含磷的物相含量很少,或者以非晶态存在。
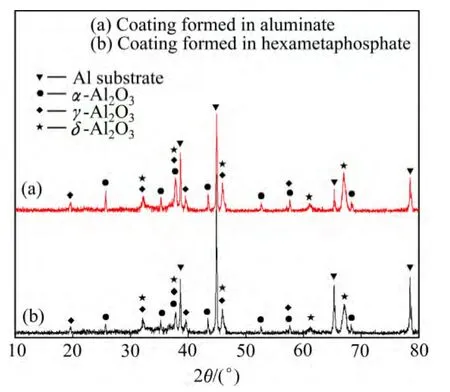
图6 铝酸盐和磷酸盐电解液中得到的膜层的XRD谱Fig. 6 XRD patterns of samples treated by aluminate and phosphate electrolyte, respectively
2.5 极化曲线实验结果
图7所示为不同条件下 PEO处理样品以及Al-Cu-Li合金基体的极化曲线。从图7中明显可以看出,磷酸盐体系中得到的PEO膜层耐蚀性高于铝酸盐体系中得到的PEO膜层的耐蚀性。而且,在两种不同的电解液体系中,处理时间30 min的试样耐蚀性均高于处理时间为10 min的试样。PEO膜层的耐蚀性和膜层中的缺陷的多少有关,通常认为耐蚀性决定于氧化膜的内层[26]。采用塔菲尔外推法对图7中各种条件下的试样的极化曲线进行处理,得到自腐蚀电流密度,列于表3中。从表3中可以看出,经过PEO处理后都能很大程度上提高合金的耐腐蚀性能,但磷酸盐体系下其自腐蚀电流与铝酸盐相比提高了一个数量级,这可能跟其涂层的形貌有关。根据PEO处理30 min试样的截面照片(见图4(a)与5(c))可知,磷酸盐体系下形成的氧化膜中的大型孔洞比铝酸盐中形成的氧化膜的要少,因而,腐蚀液不容易透过孔洞进入基体内部,故磷酸盐体系下耐腐蚀性能比在同一条件下铝酸盐的强。

图7 在不同电解液中处理不同时间的 PEO膜层以及Al-Cu-Li基体的条件下的极化曲线Fig. 7 Polarization curves of Al-Cu-Li alloy substrate and PEO treated in different electrolytes for different times: (a)Hexametaphosphate electrolyte, 30 min; (b)Aluminate electrolyte, 30 min; (c)Hexametaphosphate electrolyte, 10 min;(d)Aluminate electrolyte, 10 min; (e)Al-Cu-Li alloy substrate

表3 不同条件下试样的腐蚀电流(对应图7)Table 3 Corrosion current of samples at different conditions(corresponding to Fig. 7)
2.6 摩擦试验结果
图8所示为两种电解液中处理30 min得到的膜层在不同载荷下摩擦因数与时间的关系。从图8中可以看出,在磷酸盐电解液中得到的膜层的摩擦因数要低于在相同条件下铝酸盐电解液中得到的膜层的摩擦因数,这可能是磷酸盐电解液中得到的膜层中含有少量的 P,导致膜层有一定的自润滑作用,使摩擦因数降低。对于在10 N载荷下的铝酸盐电解液中PEO膜层的摩擦曲线(曲线 c),摩擦初期,摩擦因数从最初的0.4左右迅速上升,在95 s左右达到约0.5,此后,摩擦曲线缓慢上升,摩擦因数在0.55到0.63之间波动。对于相同载荷下的磷酸盐膜层的摩擦因数曲线,摩擦因数从初期的 0.4左右缓慢上升,在试验终止时摩擦因数为0.57。在30 N的载荷下,PEO膜层的在初期表现出比低载荷下更高的摩擦因数,然而,经历一段时间后,摩擦因数突然下降到0.40到0.45之间。摩擦因数突然下降的点称为转化点(Transition point)[7,22],对应于 PEO膜层的磨穿。在此实验中,铝酸盐 PEO膜层转化点出现的时间是499 s,而磷酸盐PEO膜层转化点出现的时间是413 s,表明铝酸盐中得到的膜层的耐磨性略好于磷酸盐中得到的膜层。
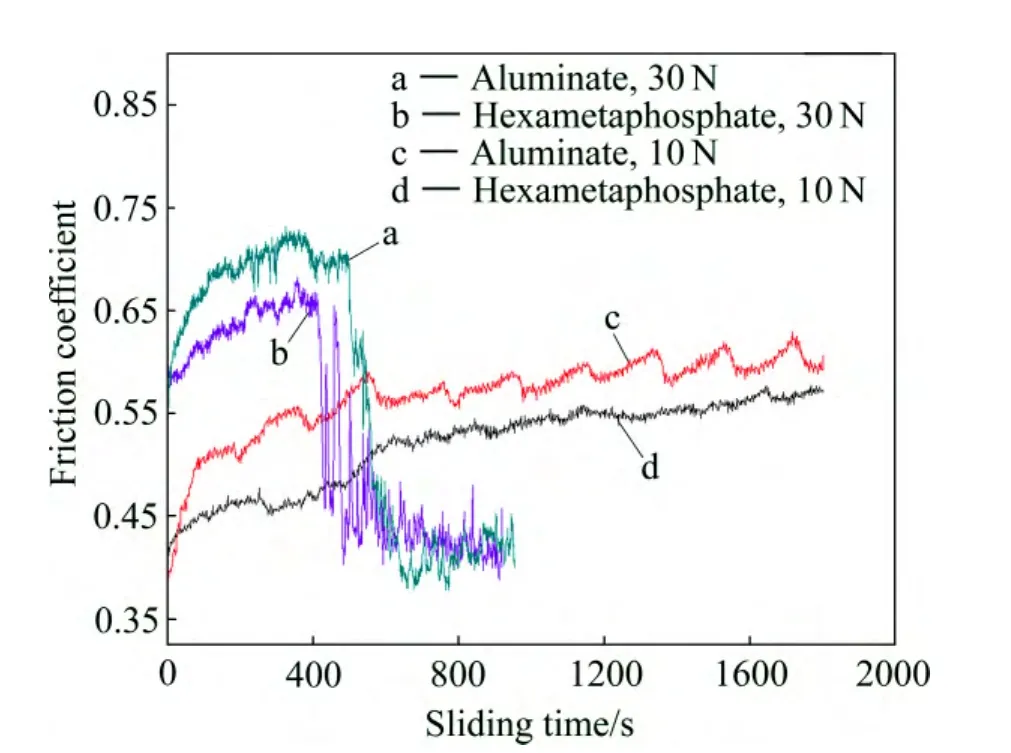
图8 在铝酸盐和磷酸盐电解液中处理30 min的试样在不同载荷下摩擦因数与时间的关系Fig. 8 Relationship between friction coefficient and sliding time of samples formed in aluminate and hexametaphosphate electrolyte under different loads for 30 min

图9 不同电解液中得到的膜层在10 N下摩擦30 min得到的磨痕三维视图Fig. 9 3-dimensional displays of wear scars under 10 N dry sliding for 30 min of coatings formed in different electrolytes:(a)Aluminate, (b)Hexametaphosphate
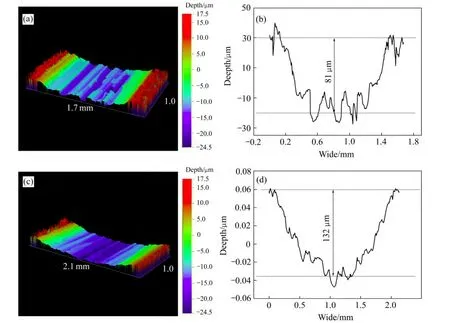
图10 不同电解液中处理30 min得到的膜层在30 N载荷下的磨痕检测结果Fig. 10 Optical profiler tests results of wear scars under 30 N dry sliding of coatings formed in different electrolytes for 30 min:(a), (b)Aluminate, 3-D displays, cross section profile; (c), (d)Hexametaphosphate, 3-D displays, cross section profile
图9所示为铝酸盐电解液和磷酸盐电解液中得到的膜层在10 N载荷下摩擦30 min得到的磨痕的轮廓仪检测三维图像。从图9中可以看出,磨痕的深度都很浅,而且宏观肉眼也可看出膜层未磨穿。相比较而言,磷酸盐中得到的膜层的磨痕深度要大一些,可以从图 9(a),(b)的色差对比可以看出。图 10 为更高载荷下的磨痕检测结果,摩擦时间为950 s左右(对应于图8),从图10看出,两种溶液中得到的PEO膜层在30 N下都被磨穿,由轮廓仪检测出的磨痕深度显示,磷酸盐 PEO膜层的深度为 132 µm 左右,而铝酸盐PEO膜层的磨痕深度为81 µm 左右。因此,从摩擦试验可以看出,铝酸盐电解液中得到的膜层耐磨更强,其原因是,铝酸盐电解液中得到的膜层基本是氧化铝,氧化铝具有很高的硬度,而磷酸盐电解液中得到的膜层有少量P的成分(由EDS检测结果给出),P虽然使膜层的摩擦因数下降,但可能降低膜层的硬度,从而导致耐磨性能有所下降。此外,XRD结果表明,铝酸盐中得到的PEO膜层的α-Al2O3含量较高,而α-Al2O3是所有氧化铝的晶型中硬度最高的(α-Al2O3硬度 26 GPa,γ-Al2O317 GPa)[27],因此,这一点也可解释铝酸盐电解液中的膜层耐磨性高于相应的磷酸盐 PEO膜层。
4 结论
1) 在两种电解液下形成的氧化膜表面主要由饼状结构组成,膜层为双层结构,内外层之间分布着尺寸较大的孔洞。
2) 铝酸盐和磷酸盐电解液体系中形成的涂层的主要成分都为氧化铝,以α-Al2O3、γ-Al2O3和δ-Al2O33种晶型存在。铝酸盐电解液中得到的膜层中α-Al2O3的含量高于相应的磷酸盐电解液中得到的膜层。EDS在磷酸盐电解液中得到的膜层中检测到少量的 P,P可能以非晶态的形式存在于膜层中。
3) PEO处理大大地提高了Al-Cu-Li合金的耐腐蚀性能,磷酸盐电解液中得到的膜层的耐蚀性高于铝酸盐电解液中的膜层的耐腐蚀性能,这与磷酸盐膜层微观结构中微孔较少有关。
4) 磷酸盐电解液得到的 PEO膜层具有较小的摩擦因数,其原因是与膜层中P的存在有关。
5) 铝酸盐电解中得到的 PEO膜层具有较高的耐磨性,其原因是铝酸盐PEO膜层中含有更多的高硬度α-Al2O3。
[1]RIOJA R J. Fabrication methods to manufacture isotropic Al-Li alloys and products for space and aerospace applications[J].Materials Science and Engineering A, 1998, 257(1): 100−107.
[2]XU Yue, WANG Xiao-jing, YAN Zhao-tong, LI Jia-xue.Corrosion properties of light-weight and high-strength 2195 Al-Li alloy[J]. Chinese Journal of Aeronautics, 2011, 24(5):681−686.
[3]高英俊, 黄创高 ,莫其逢. Al-Li合金时效初期的价键分析[J].中国有色金属学报, 2005, 15(7): 1069−1074.GUO Ying-jun, HUANG Chuang-gao, MO Qi-feng. Calculation on valence electronic structures of Al-Li alloy under earlier aging condition[J]. The Chinese Journal of Nonferrous Metals,2005, 15(7): 1069−1074.
[4]CHENG Y L, XUE Z G, WANG Q, WU X Q, MATYKINA E,SKELDON P, THOMPSON G. E. New findings on properties of plasma electrolytic oxidation coatings from study of an Al-Cu-Li alloy[J]. Electrochimica Acta, 2013, 107: 358−378.
[5]MELHEM A, HENRION G, CZERWIEC T, BRIANÇON J L,DUCHANOY T, BROCHARD F, BELMONTE T. Changes induced by process parameters in oxide layers grown by the PEO process on Al alloys[J]. Surface and Coatings Technology, 2011,205(S): s133−s136.
[6]XU F T, XIA Y, LI G. The mechanism of PEO process on Al-Si alloys with the bulk primary silicon[J]. Applied Surface Science,2009, 255(23): 9531−9538.
[7]CHENG Y L, WU X Q, XUE Z G, MATYKINA E, SKELDON P,THOMPSON G E. Microstructure, corrosion and wear performance of plasma electrolytic oxidation coatings formed on Ti-6Al-4V alloy in silicate-hexametaphosphate electrolyte[J].Surface and Coatings Technology, 2013, 217: 129−139.
[8]MONTAZERI M, DEHGHANIAN C, SHOKOUHFAR M,BARADARAN A. Investigation of the voltage and time effects on the formation of hydroxyapatite-containing titania prepared by plasma electrolytic oxidation on Ti-6Al-4V alloy and its corrosion behavior[J]. Applied Surface Science, 2011, 257(16):7268−7275.
[9]BARCHICHE C E, VEYS-RENAUX D, ROCCA E. A better understanding of PEO on Mg alloys by using a simple galvanostatic electrical regime in a KOH-KF-Na3PO4electrolyte[J]. Surface and Coatings Technology, 2011,205(17/18): 4243−4248.
[10]CAKMAK E, TEKIN K C, MALAYOGLU U, SHRESTHA S.The effect of substrate composition on the electrochemical and mechanical properties of PEO coatings on Mg alloys[J]. Surface and Coatings Technology, 2010, 204(8): 1305−1313.
[11]CHENG Y L, WU F, DONG J L, WU X Q, XUE Z G,MATYKINA E, SKELDON P, THOMPSON G E. Comparison of plasma electrolytic oxidation of zirconium alloy in silicateand aluminate-based electrolytes and wear properties of the resulting coatings[J]. Electrochimica Acta, 2012, 85: 25−32.
[12]CHENG Y L, WU F, MATYKINA E, SKELDON P,THOMPSON G E. The influences of microdischarge types and silicate on the morphologies and phase compositions of plasma electrolytic oxidation coatings on zircaloy-2[J]. Corrosion Science, 2012, 59: 307−315.
[13]XUE W B, ZHU Q Z, JIN Q, HUA M. Characterization of ceramic coatings fabricated on zirconium alloy by plasma electrolytic oxidation in silicate electrolyte[J]. Materials Chemistry and Physics, 2010, 120(2/3): 656−660.
[14]VOEVODIN A A, YEROKHIN A L, LYUBIMOV V V,DONLEY M S, ZABINSKI J S. Characterization of wear protective Al-Si-0 coatings formed on Al-based alloys by micro-arc discharge treatment[J]. Surface and Coatings Technology, 1996, 86/87: 516−521.
[15]LUKIYANCHUK I V, RUDNEV V S, KURYAVYI V G,BOGUTA D L, BULANOVA S B, GORDIENKO P S. Surface morphology, composition and thermal behavior of tungstencontaining anodic spark coatings on aluminium alloy[J].Thin Solid Films, 2004, 446(1): 54−60.
[16]RAMA KRISHNA L, SOMARAJU K R C, SUNDARARAJAN G. The tribological performance of ultra-hard ceramic composite coatings obtained through microarc oxidation[J]. Surface and Coatings Technology, 2003, 163/164: 484−490.
[17]CURRAN J A, CLYNE T W. The thermal conductivity of plasma electrolytic oxide coatings on aluminium and magnesium[J].Surface and Coatings Technology, 2005, 199(2/3): 177−183.
[18]PARFENOV E V, YEROKHIN A L, MATTHEWS A.Frequency response studies for the plasma electrolytic oxidation process[J].Surface and Coatings Technology, 2007, 201(21): 8661−8670.
[19]MONFORT F, BERKANI A, MATYKINA E, SKELDON P,THOMPSON G E, HABAZAKI H, SHIMIZU K. Development of anodic coatings on aluminium under sparking conditions in silicate electrolyte[J]. Corrosion Science, 2007, 49(2): 672−693.
[20]刘一洋, 赵志龙, 阎光明, 侯军占. 铝锂合金微弧氧化陶瓷膜层特性的研究[J]. 电镀与环保, 2007, 27(2): 25−27.LIU Yi-yang, ZHAO Zhi-long, YAN Guang-ming, HOU Jun-zhan. Properties research of ceramic coating on Al-Li alloy by microarc oxidation[J]. Electroplating and Pollution Control,2007, 27(2): 25−27.
[21]薛志刚, 程英亮, 吴湘权, 吴有伍, 李劲风. 2A97 铝锂合金等离子电解氧化膜的制备和耐蚀性能[J]. 中国有色金属学报,2013, 23(7): 1914−1922.XUE Zhi-gang, CHENG Ying-liang, WU Xiang-quan WU You-wu, LI Jing-feng. Preparation and corrosion resistance of plasma electrolytic oxidation coatings on 2A97 aluminium lithium alloy[J]. The Chinese Journal of Nonferrous Metals,2013, 23(7): 1914−1922.
[22]MARTINI C, CESCHINI L, TARTERINI F, PAILLARD J M,CURRAN J A. PEO layers obtained from mixed aluminatephosphate baths on Ti-6Al-4V: Dry sliding behaviour and influence of a PTFE topcoat[J]. Wear, 2010, 269(11/12):747−756.
[23]STOJADINOVIC S, VASILIC R, BELCA I, PETKOVIC M,KASALICA B, NEDIC Z, ZEKOVIC L J. Characterization of the plasma electrolytic oxidation of aluminium in sodium tungstate[J]. Corrosion Science, 2010, 52(10): 3258−3265.
[24]HUSSEIN R O, NIE X, NORTHWOOD D O, YEROKHIN A,MATTHEWS A. Influence of process parameters on electrolytic plasma discharging behaviour and aluminum oxide coating microstructure[J]. Surface and Coatings Technology, 2010,205(6): 1659−1667.
[25]YEROKHIN A L, NIE X, LEYLAND A, MATTHEWS A,DOWEY S J. Plasma electrolysis for surface engineering[J].Surface and Coatings Technology, 1999, 122(2/3): 73−93.
[26]HUSSEIN R O, NORTHWOOD D O, SU J F, NIE X. A study of the interactive effects of hybrid current modes on the tribological properties of a PEO (plasma electrolytic oxidation)coated AM60B Mg-alloy[J]. Surface and Coatings Technology,2013, 215: 421−430.
[27]KHAN R H U, YEROKHIN A, LI X, DONG H. Surface characterisation of DC plasma electrolytic oxidation treated 6082 aluminium alloy: Effect of current density and electrolyte concentration[J]. Surface and Coatings Technology, 2010,205(6): 1679−1688.
