促红细胞生成素对压力超负荷大鼠心肌NADPH氧化酶表达的影响
2014-08-13王丽萍
王丽萍, 范 妤, 韩 曼
(1河北联合大学基础医学院生理学系,河北 唐山 063000; 2陕西中医学院基础医学院,陕西 咸阳 712021)
心肌重构是各种心脏疾病中重要的病理生理改变,与高血压、心肌梗死、病毒性心肌炎及多种心肌病等密切相关,最终诱导心力衰竭的发生,但其机制至今尚未完全阐明。研究显示,由NADPH氧化酶(NADPHoxidase,Nox)诱导的心肌活性氧(reactiveoxygenspecies,ROS)增多,可激活多种与心肌重构有关的信号激酶和转录因子,刺激心肌成纤维细胞增殖,同时激活基质金属蛋白酶,引起细胞外基质重塑,在心脏肥大和心肌成纤维细胞增殖最终导致心肌重构过程中发挥重要作用[1-2]。
促红细胞生成素(erythropoietin,EPO)是由肾脏分泌的一种富含唾液酸的糖蛋白,属于造血生长因子家族。EPO不仅具有促进红细胞生成的作用,大量研究已证实,EPO还可作为一种保护因子,在心脏[3-4]、脑[5-6]、肾和肝脏[7]等多种组织及器官中发挥重要的细胞保护作用。但其在心脏保护作用中与氧化应激的关系还未见明确报道。
本研究在观察EPO对压力超负荷所致的大鼠心功能、心肌纤维化变化影响的基础上,进一步研究EPO对压力超负荷所致的大鼠心肌NADPH氧化酶表达的影响,探讨EPO的心肌保护作用及相关机制。
材 料 和 方 法
1 实验动物和主要试剂
10~12周雄性SD大鼠,体重220~250 g,由陕西中医学院实验中心提供。重组人促红细胞生成素(rhEPO)注射液购自北京四环生物制药股份有限公司;RNA逆转录试剂盒及PCR试剂盒购自Fermentas; Trizol reagent购自Invitrogen;Western blotting 相关试剂购自 Amresco;Masson染液购自南京建成生物有限公司;兔抗Nox2、Nox4多克隆抗体购自Sigma;兔抗CD45、F4/80、TGF-β多克隆抗体购自Abcam。
2 建立压力超负荷动物模型和实验分组
腹腔注射戊巴比妥钠(15 mg/kg)麻醉动物后固定,分离腹主动脉并于动脉下方穿线,将腹主动脉与一根10号针头一起结扎,扎紧后将针头抽出,使腹主动脉形成环形缩窄。检查结扎处搏动正常、腹后壁无出血后逐层缝合腹壁。每只肌注青、链霉素各5×104U,预防感染。假手术组除不结扎腹主动脉外,其余操作均同手术组。术后常规饲养。
将动物随机分为3组,每组12只:腹主动脉缩窄组(model);假手术组(sham); 重组人促红细胞生成素组(EPO):腹主动脉缩窄术前1 h给予重组人促红细胞生成素,腹腔注射4 000 U/kg溶于0.5 mL生理盐水,术后每周2次进行注射。Sham 组及model组分别给予注射等量生理盐水。8周后测量各组动物体重,并对相关指标进行检测。
3 主要实验方法和测定指标
3.1血压的测定 无创动脉血压仪测量各组动物血压。通过USB接口将血压仪主机与电脑相连,接通电源,使保温器温度维持于37 ℃。将大鼠尾根部放入加压感应器中,当血压计感应到适当的鼠尾血流状态时,则开始自动测量,所测数值和感应波形自动存储于电脑。
3.2心脏超声心动图 腹腔注射戊巴比妥钠麻醉动物,使用HpSonos 2500型多功能超声检查仪及7.5 MHz相控阵探头(HD)检测左室收缩末内径(left ventricular end-systolic diameter,LVEDD)和舒张末内径(left ventricular end-diastolic diameter,LVESD),计算左室射血分数(left ventricular ejection fraction,LVEF)和短轴缩短率(left ventricular fractional shor-tening,LVFS)。
3.3血流动力学测定 记录左室收缩末压(leftventricularend-systolicpressure,LVESP)、左室舒张末压(leftventricularend-diastolicpressure,LVEDP)及左室内压最大上升、下降速率(maximalpositive/negativefillingpressurechangeversustime,±dp/dtmax)
3.4心肌肥大指数测定 摘取各组动物心脏,称取全心重和左心室重,计算左心室重与体重的比值即为心肌肥大指数。
3.5观察心肌纤维化程度 取左心室肌组织制成石蜡切片,进行Masson染色。观察各组动物心肌间质及血管周围纤维化的改变。
3.6实时定量PCR法检测各组大鼠心肌组织Nox2和Nox4 mRNA表达的变化 采用Trizol法提取心肌组织中的总RNA,用核酸蛋白分析仪测定其纯度。参照反转录试剂盒说明书,取2 μg总RNA样本于10 μL体系进行逆转录反应,20 μL 体系中进行扩增。
3.7Westernblotting法检测各组大鼠心肌Nox2和Nox4蛋白表达的变化 取100mg心肌组织裂解提取总蛋白。10%SDS-PAGE分离蛋白,300mA转膜2h将蛋白转至PVDF膜。1% 牛血清白蛋白封闭1h。滴加Ⅰ抗(anti-Nox2和anti-Nox4)后,4 ℃过夜。将膜放入密封袋中加Ⅱ抗,室温摇床上轻摇1h,化学发光试剂放射自显影。Westernblotting法检测各组大鼠心室肌炎症因子CD45、F4/80和TGF-β表达变化的方法同上。
4 统计学处理
采用SPSS 16.0统计软件进行统计学分析,计量数据以均数±标准差(mean±SD)表示,组间比较用单因素方差分析,两两比较使用Bonferroni检验。SigmaPlot 9.0软件做统计图。以P<0.05为差异有统计学意义。
结 果
1 血压和心肌肥厚指标的测定
术后8周sham组血压为(101.97±11.24) mmHg,model组为(201.03±14.63) mmHg,较sham组明显升高(P<0.01);测定各组大鼠左心室重与体重的比值,结果显示,model组(4.97±0.72)较sham 组(1.99±0.07)明显升高(P<0.01),证明造模成功。结果还显示,EPO组血压为(131.19 ±21.32) mmHg,左心室重与体重的比值为2.23±0.76,均比model组下降(P<0.05),说明EPO的治疗可改善压力超负荷大鼠的血压及心肌肥厚改变。
2 超声心动图测定心功能的变化
超声心动图结果显示,与sham 组相比,model组大鼠的LVEF和LVFS均降低(P<0.01),LVEDD和LVESD升高(P<0.01);而与model组相比,EPO组的LVEF和LVFS明显升高(P<0.01),LVEDD和LVESD明显下降(P<0.05),见表1。
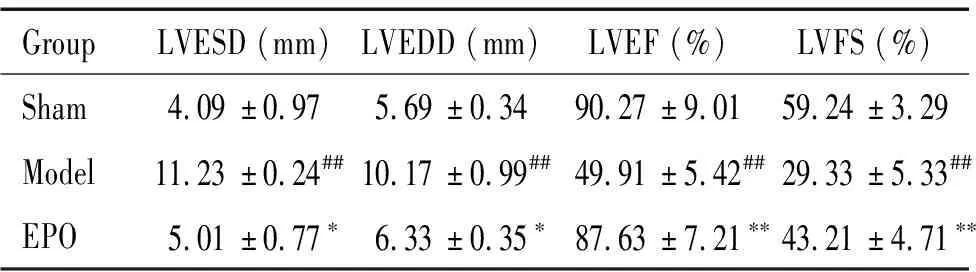
表1 超声心动图指标测定
##P<0.01vssham;*P<0.05,**P<0.01vsmodel.
3 血流动力学指标的变化
血流动力学检测显示,与sham组比较,model组大鼠心脏的±dp/dtmax和LVESP明显降低(P<0.01),LVEDP升高(P<0.01);而EPO的使用能明显逆转这一改变,见表2。结合超声心动图结果表明,EPO能明显改善压力超负荷所致大鼠心功能的变化。
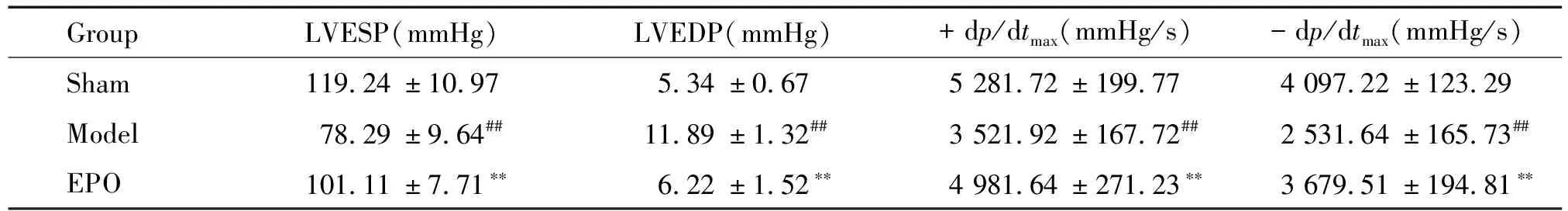
表2 血流动力学指标测定
##P<0.01vssham;**P<0.01vsmodel.
4 心肌纤维化的改变
如图1所示,sham组大鼠心肌血管周围和细胞间有少量的胶原纤维,形似蜂窝;model组大鼠的心肌胶原纤维含量与sham组相比显著增加(P<0.01),分布弥散,排列紊乱。EPO组大鼠心肌胶原纤维含量较model组明显减少(P<0.01)。这一结果表明:EPO能抑制压力超负荷大鼠心肌胶原的沉积。
5 心室肌Nox2和Nox4mRNA及蛋白表达的变化
实时定量PCR 及Western blotting实验结果显示,model组大鼠心肌中的Nox2和Nox4 mRNA及蛋白表达较sham组明显升高(P<0.05 或P<0.01),使用EPO治疗可显著降低压力超负荷所致大鼠心肌中Nox2和Nox4 的mRNA及蛋白表达的升高(P<0.05 或P<0.01),见图2、3。这一结果表明,EPO可抑制心肌Nox2和Nox4的表达。
6 心室肌CD45、F4/80和TGF-β表达的变化
研究证实,众多炎症因子在MF的进展过程中起重要作用。我们采用Western blotting法观察压力超负荷大鼠心肌炎症因子表达的变化以及EPO对其的影响,结果见图4。压力超负荷导致大鼠心肌中白细胞分化抗原CD45、巨噬细胞表面标记物F4/80和细胞因子TGF-β表达增多(P<0.05 或P<0.01),提示心肌中有血液源性的炎症细胞,包括T淋巴细胞、巨噬细胞等的浸润。而EPO抑制了上述指标的升高(P<0.05 或P<0.01)。表明EPO可抑制心肌内炎性反应的发生。

Figure 1. Abdominal aortic constriction induced cardiac fibrosis and EPO reversed this change (Masson’s staining, ×400). Mean±SD. n=12. ##P<0.01 vs sham; ** P<0.01 vs model.
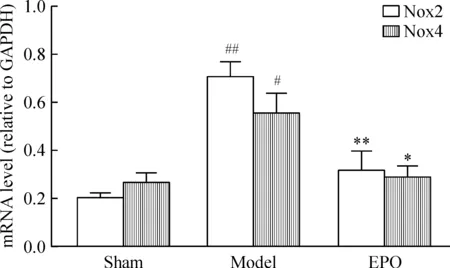
Figure 2. Effects of EPO on mRNA expression of Nox2 and Nox4 in rat left ventricular myocardium. Mean±SD. n=6. #P<0.05, ## P<0.01 vs sham; *P<0.05, ** P<0.01 vs model.

Figure 3. Effects of EPO on protein expression of Nox2 and Nox4 in rat left ventricular myocardium. Mean±SD. n=6. ## P<0.01 vs sham; *P<0.05 vs model.

Figure 4. Effects of EPO on protein expression of CD45,F4/80 and TGF-β in rat left ventricular myocardium. Mean±SD. n=3. #P<0.05, ## P<0.01 vs sham;*P<0.05, ** P<0.01 vs model.
讨 论
研究显示,ROS诱导心肌细胞凋亡及由机械拉伸或神经激素性刺激诱发的心肌肥厚性反应,并由此引发心血管疾病。NADPH氧化酶是细胞内一组具有氧化活性的蛋白,是心肌ROS的主要来源,包括Nox1、Nox2(gp91phox)、Nox3、Nox4、Nox5、Duox1和Duox2,也称为Nox蛋白家族。研究表明,Nox2和Nox4大量表达于心肌细胞、内皮细胞和成纤维细胞。与正常鼠相比,Nox2基因敲除小鼠基础血压降低,并可完全阻止血管紧张素Ⅱ诱导的血管过度增生同时清除过多的氧化剂。C57/BL小鼠心梗后,梗死心肌Nox2表达明显增强,梗死部位有大量巨噬细胞和肌成纤维细胞堆积,并有炎症因子及胶原的沉积;而敲除Nox2基因后,这些改变明显减轻[8]。也有研究证实,Nox4在压力超负荷小鼠的心肌肥大、间质纤维化和心肌细胞凋亡及心脏的老龄化过程中发挥重要作用[9-11]。本研究结果显示,压力超负荷导致大鼠心肌Nox2和Nox4表达明显增多,与以上证据相符合,说明Nox2和Nox4在心肌重构过程中发挥重要作用。
EPO是由肾脏分泌的一种多效性细胞因子,主要作用于骨髓造血细胞,与其特异性受体结合,促进红系祖细胞的存活、增殖和分化,并可抑制其凋亡。近年来的大量研究显示,EPO还具有广泛的非造血作用[12]。在心脏,研究显示,EPO通过调节基质金属蛋白酶2/金属蛋白酶组织抑制因子2之间的平衡进而在抗肿瘤药物导致的心脏中毒过程中发挥保护作用[13]。EPO还可促进高胆固醇所致心肌梗塞大鼠心肌的复原[14]。EPO和依那普利联合应用可抑制心肌纤维化和微血管的损伤[15]。在缺血性心脏病,EPO可抑制心肌细胞的凋亡,同时具有抗炎、抗氧化及改善心功能的作用[16]。我们的研究结果显示,压力超负荷导致大鼠血压升高、心肌肥大并出现纤维化症状,在给予EPO干预治疗后,这些变化均减轻,提示EPO有抵抗压力超负荷导致的心肌纤维化的作用。
研究显示,EPO可上调超氧化物歧化酶等抗氧化酶的表达,使其活性增强,进而抑制氧化应激产物的生成;另外,EPO与其受体结合后可抑制线粒体氧自由基的产生,从而减轻血管损伤。本研究中,我们检测了模型组大鼠心肌Nox2和Nox4mRNA及蛋白水平的表达,结果显示,压力超负荷导致大鼠心肌Nox2和Nox4表达增强;而使用EPO干预治疗后,Nox2和Nox4mRNA及蛋白水平的表达均下降,这一结果表明,EPO可抑制压力超负荷所致的大鼠心肌Nox2和Nox4表达,进而抑制心肌氧化应激反应。我们同时检测了各组大鼠心肌炎症相关因子表达的变化,结果显示,压力超负荷导致大鼠心肌中白细胞分化抗原CD45、巨噬细胞表面标记物F4/80和细胞因子TGF-β表达增加,提示炎症细胞在心肌中的浸润,而EPO抑制了这种浸润,表明EPO可抑制心肌内的炎症反应。
[参 考 文 献]
[1]SantosCX,AnilkumarN,ZhangM,etal.Redoxsignalingincardiacmyocytes[J].FreeRadicBiolMed, 2011, 50(7):777-793.
[2] Touyz RM, Briones AM. Reactive oxygen species and vascular biology: implications in human hypertension[J]. Hypertens Res, 2011, 34(1):5-14.
[3]MociniD,LeoneT,TubaroM,etal.Structure,productionandfunctionoferythropoietin:implicationsfortherapeticaluseincardiovasculardisease[J].CurrMedChem, 2007, 14(21):2278-2287.
[4] Ohori K, Miura T, Tanno M, et al. Ser9 phosphorylation of mitochondrial GSK-3β is a primary mechanism of cardiomyocyte protection by erythropoietin against oxidant-induced apoptosis[J]. Am J Physiol Heart Circ Physiol, 2008, 295(5):H2079-H2086.
[5]PrunierF,PfisterO,HadriL,etal.Delayederythropoietintherapyreducespost-MIcardiacremodelingonlyatadosethatmobilizesendothelialprogenitorcells[J].AmJPhysiolHeartCircPhysiol, 2007, 292(1):H522-H529.
[6] Keller BA, Mcpherson RJ, Juul SE, et al. A comparison of high-dose recombinant erythropoietin treatment regimens in brain-injured neonatal rats[J]. Pediatr Res, 2007, 61(4):451-455.
[7]SchmedingM,NeumannUP,Boas-KnoopS,etal.Erythropoietinreducesischemiareperfusioninjuryintheratliver[J].EurSurgRes, 2007, 39(3):189-197.
[8] Zhao WY, Zhao D, Yan R, et al. Cardiac oxidative stress and remodeling following infarction: role of NADPH oxidase[J]. Cardiovasc Pathol, 2009,18(3): 156-166.
[9]KurodaJ,AgoT,MatsushimaS,etal.NADPHoxidase4 (Nox4)isamajorsourceofoxidativestressinthefailingheart[J].ProcNatlAcadSicUSA, 2010, 107(35): 15565-15570.
[10] Ago T, Kuroda J, Pain J, et al. Upregulation of Nox4 by hypertrophic stimuli promotes apoptosis and mitochondrial dysfunction in cardiac myocytes[J]. Circ Res, 2010,106(7):1253-1264.
[11]AgoT,MatsushimaS,KurodaJ,etal.TheNADPHoxidaseNox4andagingintheheart[J].Aging, 2010, 2(12):1012-1016.
[12] Rui frok WP, de Boer RA, Westenbrink BD, et al. Erythropoietin in cardiac disease: new features of an old drug[J]. Eur J Pharmacol, 2008, 585(2-3):270-271.
[13]ChenX,GuoZ,WangP,etal.Erythropoietinmodulatesimbalanceofmatrixmetalloproteinase-2andtissueinhibitorofmetalloproteinase-2indoxorubicin-inducedcardiotoxicity[J].HeartLungCirc, 2014, 23(8):772-777.
[14] Abo-Gresha NM, Abel-Aziz EZ, Greish SM. Evening primrose oil ameliorates platelet aggregation and improves cardiac recovery in myocardial-infarct hypercholesterolemic rats[J]. Int J Physiol Pathophysiol Pharmacol, 2014, 6(1):23-36.
[15]GutN,PiechaG,AldebssiF,etal.ErythropoietincombinedwithACEinhibitorpreventsheartremodelingin5/6nephrectomizedratsindependentlyofbloodpressureandkidneyfunction[J].AmJNephrol, 2013, 38(2):124-135.
[16] Jiang HL, Zhu YC, Chen XH, et al. The myocardium protective effects of erythropoietin (EPO) in a rat model of asphyxia-induced cardiac arrest/cardiopulmonary resuscitation (CPR) [J]. Zhongguo Wei Zhong Bing Ji Jiu Yi Xue,2011, 23(10):608-612.
