白藜芦醇联合放疗对肝癌Bel-7404细胞体外凋亡的影响
2014-08-11韦智丹武军驻
艾 旭,朱 倩,马 旭,龙 舟,韦智丹,梅 丹,武军驻
(1. 湖北省荆门市第一人民医院,湖北 荆门 448000;2. 武汉大学基础医学院,湖北 武汉 430072)
白藜芦醇联合放疗对肝癌Bel-7404细胞体外凋亡的影响
艾 旭1,朱 倩1,马 旭1,龙 舟1,韦智丹1,梅 丹1,武军驻2
(1. 湖北省荆门市第一人民医院,湖北 荆门 448000;2. 武汉大学基础医学院,湖北 武汉 430072)

目的 探讨不同剂量白藜芦醇联合不同剂量放疗对肝癌Bel-7404细胞凋亡的影响。方法 用MTT法检测不同浓度白藜芦醇(0,25,50,100 μmol/L)对肝癌Bel-7404细胞增殖的影响,用荧光显微镜检测不同浓度白藜芦醇细胞凋亡情况,寻找恰当的白藜芦醇的浓度进行下一步实验。按照不同的放射治疗剂量分组如下:A组予单纯白藜芦醇干预组;B组行放射治疗剂量2 Gy+白藜芦醇干预;C组行放射治疗剂量4 Gy+白藜芦醇干预;D组行放射治疗剂量6 Gy+白藜芦醇干预;检测肿瘤细胞的增殖、运动侵袭、细胞凋亡及各组细胞MMP-2、VEGF的表达情况。结果 检测结果显示,白藜芦醇可以有效抑制肝癌Bel-7404细胞生长、促进肝癌Bel-7404细胞凋亡, 呈浓度依赖关系。根据实验结果,选择25 μmol/L白藜芦醇进行体外放疗的实验。与A组相比,B、C、D组对肝癌Bel-7404细胞的增殖凋亡作用均有显著性差异(P均<0.05);B组与C、D组有显著性差异(P均<0.05),C组与D组无显著性差异(P>0.05)。结论 不同剂量放疗联合25 μmol/L白藜芦醇均可提高放射治疗后肝癌Bel-7404细胞凋亡率,降低肿瘤侵袭性;白藜芦醇可能具有放疗增敏的作用。
白藜芦醇;细胞凋亡;肝癌Bel-7404细胞;放疗增敏
原发性肝癌(简称肝癌)发病率呈逐渐升高趋势,且死亡率高,手术治疗是目前最主要的治疗手段,对于无手术及局部化疗(经肝动脉化疗栓塞)条件的患者,放疗能取得显著疗效。而如何更进一步增加放疗的效果,探索肝癌放疗的增敏剂无疑是个新途径。研究发现,白藜芦醇(Res)在肿瘤的启动、促进及发展三个阶段均表现出抑制甚至逆转肿瘤作用[1]。且白藜芦醇对人体多种癌细胞(肝癌、胃癌、结肠癌、乳腺癌等)均具抑制作用及细胞毒活性[2-7]。本研究旨在探索白藜芦醇对肝癌Bel-7404细胞体外放疗的影响,进而影响肝癌患者的预后。
1 实验资料
1.1 细胞株 肝癌Bel-7404细胞株:购自武汉大学典型生物保藏中心。
1.2 主要试剂 RPMI1640培养基,Fibronectin,胎牛血清,胰蛋白酶,青霉素-链霉素溶液,重组人工基底膜Matrigel,二甲基亚砜(DMSO),四甲基偶氮唑盐(MTT),兔抗人β-actin抗体,辣根过氧化物酶(HRP)标记的羊抗兔抗体,兔抗人MMP-2抗体,兔抗人VEGF抗体,Transwell侵袭小室,Annexin Ⅴ-FITC细胞凋亡检测试剂盒,SDS-PAGE凝胶制备试剂盒,超敏ECL化学发光试剂盒(BeyoECL Plus),蛋白提取试剂盒等。
1.3 主要溶液的配制 ①Res:纯度>95%,无血清1640培养液稀释至浓度为0.01 mol/L,密封保存于4 ℃冰箱中备用,每次使用前取适量以无血清1640培养液调配至所需浓度;②MTT 的配制:将5 g MTT溶于1 L PBS液中,经0.22 μm 微孔滤膜抽滤除菌,配置成5 mg/mL MTT 液-20 ℃保存备用。
1.4 药物浓度选择实验
1.4.1 分组及Res处理 培养肝癌Bel-7404细胞后,将其分为实验组和对照组共4组,第一组为未加Res的空白对照组,第二组为加Res 25 μmol/L ,第三组为加Res 50 μmol/L,第四组为加Res 100 μmol/L。
1.4.2 MTT比色法检测Res对肝癌Bel-7404细胞增殖的影响 将处于对数生长期的肝癌Bel-7404细胞,用0.25%胰酶消化,以10%胎牛血清RPMI-1640培养液制成单细胞悬液,用血球计数板将细胞稀释成1×107mL-1,取100 μL细胞悬液加入含有盖玻片的96孔板内,5% CO2,37 ℃孵育,至细胞单层铺满孔底,分别加入100 μL含有0, 25, 50, 100 μmol/L Res的培养液,5% CO2,37 ℃孵育24 h,每孔加入20 μL MTT溶液(浓度为5 mg/mL),继续培养4 h后小心吸去孔内MTT溶液,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪OD 490 nm处测量各孔的吸光值,每组设5个重复孔。结果显示,作用于肝癌Bel-7404细胞48 h后, Res浓度分别为25, 50, 100 μmol/L时对肝癌Bel-7404细胞增殖影响所测OD值分别为0.522±0.006,0.451±0.018,0.265±0.016,0.117±0.009, 提示各浓度Res作用48 h后均能明显降低肝癌Bel-7404细胞增殖(P<0.05), 故本实验选择25 μmol/L Res作为基准浓度。
1.4.3 Annexin V检测Res诱导肝癌Bel-7404细胞凋亡 取对数生长期细胞,用0.25%胰酶消化,以10%胎牛血清RPMI1640培养液制成单细胞悬液,计数后种于含有盖玻片的多孔板内,每孔含106~108个细胞,再每孔加入2 mL含血清培养液。培养24 h 后去培养液并加药,分别加入2 mL含有0,25,50,100 μmol/L Res的培养液。培养24 h 后,用冷PBS洗涤盖玻片上的细胞2次;在500 μL的Binding Buffer 中加入5 μL AnnexinⅤ-FITC、5 μL PI,混匀;将上述溶液滴加在盖玻片表面,使长有细胞的盖玻片表面均匀覆盖;轻轻混匀于2~8 ℃避光条件下孵育5 min;将盖玻片倒置于载玻片上,在荧光显微镜下用双色滤光片观察,AnnexinⅤ-FITC 荧光信号呈绿色,PI 荧光信号呈红色。结果显示本方法能准确显示各组细胞凋亡情况,而25 μmol/L Res更适合对凋亡率进行观察。
1.5 联合实验
1.5.1 分组及处理 将正常条件下培养的肝癌Bel-7404细胞分为实验组和对照组共4组:A组为仅25 μmol/L白藜芦醇的空白对照组;B组为25 μmol/L白藜芦醇+2 Gy放疗组;C组为25 μmol/L白藜芦醇+4 Gy放疗组;D组为25 μmol/L白藜芦醇+6 Gy放疗组,各组均按要求给予相应剂量Res和放疗。
1.5.2 MTT比色法检测Res对肝癌Bel-7404细胞增殖影响 各给Res剂量均为25 μmol/L,并同时给予相应剂量化疗。操作步骤同1.4.2。
1.5.3 Transwell小室实验检测Res对肝癌Bel-7404细胞趋化运动及侵袭能力的影响 将Matrigel凝胶铺于培养小室滤膜(注意孔径大小)上,每孔20 μL, 37 ℃过夜。在膜的另一面涂上纤维粘连蛋白。把约1×105mL-1细胞200 μL加入到小室内。.培养箱培养24 h后,擦去膜上层细胞,将膜取下。甲醛室温固定30 min,,苏木素染色5 min,乙醇逐级脱水, 二甲醛透明后, 用刀片裁下膜, 置于载玻片上, 封片观察。
1.6 Annexin V荧光染色检测Res诱导肝癌Bel-7404细胞凋亡 各组Res剂量均为25 μmol/L并同时给予相应剂量化疗。操作步骤同1.4.3。
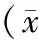
2 结 果
2.1 Res联合放疗对肝癌Bel-7404细胞增殖的影响 Res作用于肝癌Bel-7404细胞48 h后,A、B、C、D OD值分别为0.451±0.018,0.315±0.016,0.227±0.009,0.154±0.012。与A组相比,联合放疗干预48 h后均能明显降低肝癌Bel-7404细胞增殖(P均<0.05),其抑制肝癌Bel-7404细胞增殖随放疗治疗剂量的增加逐渐增强。见图1。

图1 Res联合放疗抑制肝癌Bel-7404细胞增殖作用
2.2 Res对肝癌Bel-7404细胞趋化运动性影响 不同干预措施作用于肝癌Bel-7404细胞48 h后,结果Res联合放疗能够抑制肝癌Bel-7404细胞的趋化运动性,A、B、C、D组肝癌Bel-7404细胞的穿膜细胞数分别为(188.33±24.51)个,(173.00±15.57)个,(167.67±12.51)个和(169.67±19.69)个。与A组相比,联合放疗干预作用48 h后能明显降低肝癌Bel-7404细胞的趋化运动性(P均<0.05),且随放疗治疗剂量的增加,其抑制肝癌Bel-7404细胞趋化运动性也逐渐增强。见图2。

图2 Res联合放疗对肝癌Bel-7404细胞趋化运动性影响
2.3 Res对肝癌Bel-7404细胞侵袭能力的影响 Transwell小室侵袭实验检测不同浓度Res对肝癌Bel-7404细胞侵袭能力变化,在Res浓度分别为0,25,50,100 mg/L时结晶紫染色肝癌Bel-7404细胞的穿膜细胞数(表3.3)分别为(136.62±16.25)个,(133.50±12.25)个,(99.25±14.02)个和(54.25±6.50)个,与单用Res组相比,联合放疗干预作用48 h后可以明显抑制肝癌Bel-7404细胞侵袭能力(P均<0.05),且随放疗治疗剂量的增加,其抑制肝癌Bel-7404细胞的侵袭能力逐渐增强。见图3。

图3 Res联合放疗对肝癌Bel-7404细胞侵袭的影响
2.4 Res诱导肝癌Bel-7404细胞凋亡情况 AnnexinⅤ-FITC 荧光信号呈绿色,PI 荧光信号呈红色。细胞染色呈单纯的绿色表明为早期凋亡,绿色和红色兼有表明为晚期凋亡,呈单纯的红色为死亡。检测结果见如图4。
2.5 MMP-2、VEGF蛋白的表达变化 与对照组相比,随着放疗剂量逐渐增加肝癌Bel-7404细胞内MMP-2蛋白及VEGF蛋白表达逐渐降低,呈剂量依赖性。见图5及图6。
3 讨 论
由于肿瘤细胞不表达COX-1,仅有COX-2的异常表达,而正常组织中少有COX-2表达,故选择性COX-2抑制剂可靶向性地作用于肿瘤组织,降低肿瘤细胞内的前列腺素水平,而不影响正常组织的COX-1及前列腺素水平,因此无因抑制COX-1及前列腺素水平而造成的正常细胞组织功能障碍,如因COX-1受抑及前列腺素水平降低所致的胃肠道毒副作用。因此,应用选择性的COX-2抑制剂可作为理想中的放疗增敏药。

图4 荧光显微镜检测Res联合放疗诱导肝癌Bel-7404细胞凋亡
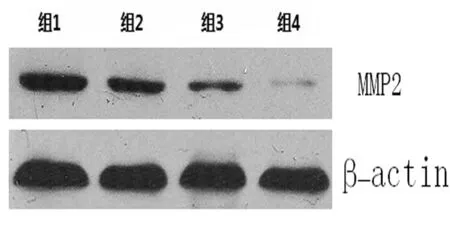
图5 Westernblot检测各组干预后对肝癌Bel-7404细胞MMP-2蛋白表达的影响
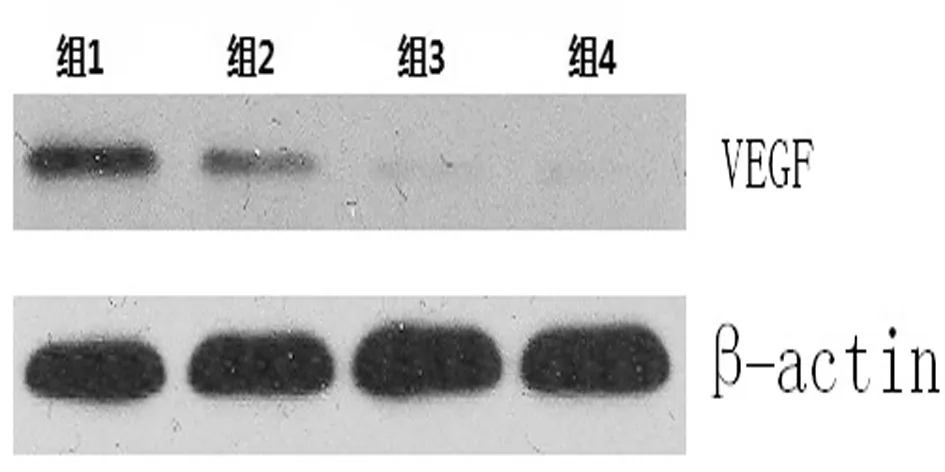
图6 Westernblot检测各组干预后对肝癌Bel-7404细胞VEGF蛋白表达的影响
Delmas等[8]进行的体外实验表明,白藜芦醇对人HepG2及鼠Fao细胞的增殖均有抑制作用,尤其鼠Fao细胞更为敏感,在实验中,向2组细胞中加入乙醇后,增殖抑制作用增强,这提示白藜芦醇可以促使更多的细胞滞留于Sand G2/M 期。同时,荷瘤大鼠实验[9]发现,其对肿瘤的抑制作用与G2/M时相细胞数增多及肿瘤细胞凋亡数增多有很大关系。
本研究采用白藜芦醇作为放疗增敏剂,观察联合放疗应用时,对肝癌Bel-7404细胞的增殖、侵袭、凋亡的影响,结果显示在放疗时联合应用白藜芦醇可以有效增强放射治疗的效果,肝癌Bel-7404细胞的增殖受抑、侵袭减弱、凋亡增加。
基质金属蛋白酶(MMPs)是一组溶解细胞外基质及基底膜的依赖锌离子的内源性蛋白水解酶,能够对细胞外基质产生有效的作用,破坏肿瘤侵袭的组织学屏障。目前较为一致的观点认为基质金属蛋白酶主要通过降解细胞外基质(ECM)、释放或激活生长因子在肿瘤血管生成、生长和转移中起作用[10]。关于MMPs的分类至少有20多种,本实验所研究涉及的MMP-2属于MMPs的重要组成部分,国外研究已经证实MMP-2在胃癌组织中高表达,并与肿瘤进展和淋巴结转移密切相关[11],关于MMP-2促进肿瘤侵袭和转移的机制主要有[12]:①MMP-2通过调节细胞粘附的作用,建立新的细胞与细胞之间、细胞与细胞外基质之间的粘附关系。②MMP-2的作用底物是Ⅳ型胶原,能直接分解基底膜中的纤维连接蛋白和层粘连蛋白。③通过调节EGF、FGF-1等因子的合成和释放促进肿瘤新生血管的形成。
与肿瘤侵袭、转移密切相关的另一个重要因素是肿瘤血管的形成[13],肿瘤血管的形成不仅为肿瘤的生长提供必需的营养物质,还为肿瘤细胞进入血液循环进而远处转移提供了通道,可以说肿瘤的生长、侵袭和转移的各个阶段均有赖于新生血管的形成。目前关于肿瘤血管形成的具体机制尚不详,其涉及复杂的生物学过程,在恶性肿瘤生长过程中,由于组织增长过快,造成局部组织缺血、缺氧,从而诱导VEGF蛋白的表达,VEGF是血管生成的关键调节器[14],研究已经证实在肺癌、胃癌、宫颈癌等恶性肿瘤组织中均有VEGF过表达现象,是目前已知发现的最重要的血管生长因子之一,其主要以旁分泌的方式与血管内皮上的相关受体结合来发挥相关的生物学功能[15],通过增加血管内皮细胞的增殖,促进新生血管的形成,加速肿瘤的生长,增加血管的通透性,从而促使肿瘤细胞侵入及穿透血管,此外还能促进其他凋亡蛋白的表达,VEGF通过上述作用参与了肿瘤细胞的侵袭和转移。
运用Westernblot检测Res联合放疗对肝癌Bel-7404细胞MMP-2、VEGF蛋白的表达变化,不同干预措施处理48 h后肝癌Bel-7404细胞内MMP-2、VEGF蛋白的表达变化明显,随着放疗剂量逐渐增加,肝癌Bel-7404细胞内MMP-2、VEGF蛋白含量逐渐降低,呈剂量依赖性。由此可见,Res联合放疗可以降低肝癌Bel-7404细胞的MMP-2、VEGF蛋白的表达量,其抑制肝癌Bel-7404细胞的侵袭性与MMP-2、VEGF蛋白的表达相关。
总之,本研究结果提示Res能增强肝癌Bel-7404细胞对放疗的敏感性。其原因与其可联合降低MMP-2、VEGF蛋白的表达有关。本研究为肝细胞肝癌的放疗治疗提供了一种新的启示,为开发与研究肝细胞肝癌放疗增敏药物提供了理论依据。
[1] Jang M,Cai L,Udeani GO,et al. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes[J]. Science,1997,275(5297):218-220
[2] Kraft TE,Parisotto D,Schempp C,et al. Fighting cancer with red wine? Molecular mechanisms of resveratrol[J]. Crit Rev Food Sci Nutr,2009,49(9):782-99
[3] Pisani P,Parkin M,Bray F,et al. Estimates of the worldwide moratlity from 25 cancers in 1990[J]. Int J Cancer,1999,83(1):18-29
[4] Kishi Y,Saiura A,Yamamoto J,et al. Significance of anatomic resection for early and advanced hepatocellular carcinoma[J]. Langenbecks Arch Surg,2012,397(1):85-92
[5] Bismuth H,Majno P. Hepatobiliary surgery[J]. J Hepatol,2000,32:208-224
[6] Stuart KE,Anand AJ,Jenkins RL. Hepatocellular carcinoma in the United States:prognostic features,treatment,outcome and survival[J]. Cancer 1996,77:2217-2222
[7] Shimada K,Sakamoto Y,Esaki M,et al. Analysis of prognostic factors affecting survival after initial recurrence and treatment efficacy for recurrence in patients undergoing potentially curative hepatactomy for hepatovellular carcinoma[J]. Ann Surg Oncol,2007,14(8):2337-2347
[8] Delmas D,Jannin B,Cherkaoui Malki M,et al. Inhibitory effect of resveratrol on the proliferation of human and rat hepatic derived cell lines[J]. Oncol Rep,2000,7(4):847-52
[9] Carbó N,Costelli P,Baccino FM. Resveratrol, a natural product present in wine, decreases tumour growth in a rat tumour model[J]. Biochem Biophys Res Commun,1999,27,254(3):739-743
[10] Klein G,Vellenga E,Fraaije MW,et al. The possible role of matrix metalloproteinase (MMP)-2 and MMP-9 in cancer, e.g. acute leukemia[J]. Crit Rev Oncol Hematol,2004,50(2):87-100
[11] Mönig SP,Baldus SE,Hennecken JK,et al. Expression of MMP-2 is associated with progression and lymph node metastasis of gastric carcinoma[J]. Histopathology,2001,39(6):597-602
[12] Trudel D,Fradet Y,Meyer F,et al. Significance of MMP-2 expression in prostate cancer:an immunohistochemical study[J]. Cancer Res,2003,63(23):8511-8515
[13] Kluetz PG,Figg WD,Dahut WL. Angiogenesis inhibitors in the treatment of prostate cancer[J]. Expert Opin Pharmacother,2010,11(2):233-247
[14] Tang N,Wang L,Esko J,et al. Loss of HIF-1 alpha in endothelial cells disrupts a hypoxia-driven VEGF autocrine loop necessary for tumorigenesis[J]. Cancer Cell,2004,6(5):485-495
[15] Dong Y,Lu B,Zhang X,Cucurbitacin E,et al. a tetracyclic triterpenes compound from Chinese medicine, inhibits tumor angiogenesis through VEGFR2-mediated Jak2-STAT3 signaling pathway[J]. Carcinogenesis,2010,31(12):2097-2104
Influence of Resveratrol combined with radiotherapy on apoptosis of liver cancer cells Bel-7404
Ai Xu1, Zhu Qian1, Ma Xu1, Long Zhou1, Wei Zhidan1, Mei Dan1, Wu Zhujun2
(1.The First People’s Hospital of Jingmen City, Jingmen 448000, Hubei, China; 2.Wuhan University, Wuhan 430072, Hubei, China)
Objective It is to approach the influence of radiotherapy combined with Resveratrol on apoptosis of liver cancer cells Bel-7404. Methods The influence of different concentrations of Resveratrol (0, 25, 50 and 100 μmol/L) on apoptosis and proliferation of liver cancer cells Bel-7404 was detected by MTT, the cell apoptosis states was observed by using fluorescence microscopy and to find the appropriate Resveratrol concentration, and then continue to the next step of the experiment with linear accelerator 6 MV X-ray. According to different doses of radiation therapy to divide into 4 groups as follows: Group A, intervened with Resveratrol only; Group B, intervened with radiation dose 2 Gy and Resveratrol; Group C, intervened with radiation dose 4 Gy and Resveratrol; Group D, intervened with radiation dose 6 Gy and Resveratrol. The apoptosis and proliferation and the expression of MMP-2 and VEGF of cells in all groups were detected.Results The detected results showed that Resveratrol could effectively inhibited the growth of liver cancer Bel-7404 cells, inhibition effect was concentration-dependent manner. According to the above experimental results, the selection of 25 μmol/L Resveratrol was used to the experiment of radiotherapy vitro. There were significant differences between Group A with the other groups (allP<0.05) and Group B with Group C or D (allP<0.05). There was no significant difference between Group C and D (P>0.05). Conclusion Different doses of radiotherapy combined with 25μmol/L Resveratrol can increase the apoptosis rate of hepatocellular carcinoma after radiotherapy, reduce tumor invasiveness. Resveratrol may be play the role of sensitizer on radiotherapy.
Resveratrol; apoptosis; hepatocelluler Bel-7404 cells; radiotherapy sensitization
艾旭,男,副主任医师,从事普外临床结直肠肛门外科工作。
10.3969/j.issn.1008-8849.2014.30.06
R735.7
A
1008-8849(2014)30-3321-04
2014-04-10
