没食子酸抑制人脐静脉血管内皮细胞增殖作用研究
2014-08-10郗艳丽张洋婷马洪波武祥群牛凤兰王舒然
郗艳丽,张洋婷,马洪波,刘 敏,武祥群,牛凤兰*,王舒然*
(1.吉林医药学院营养与食品卫生教研室,吉林 吉林 132013;2.吉林大学公共卫生学院,长春 吉林 130021)
·论 著·
没食子酸抑制人脐静脉血管内皮细胞增殖作用研究
郗艳丽1,2,张洋婷1,马洪波1,刘 敏1,武祥群2,牛凤兰2*,王舒然1*
(1.吉林医药学院营养与食品卫生教研室,吉林 吉林 132013;2.吉林大学公共卫生学院,长春 吉林 130021)
目的 探讨没食子酸对人脐静脉血管内皮细胞(HUVECs)增殖的抑制作用。方法 MTT比色法检测没食子酸对HUVECs增殖的抑制作用;用AO/EB荧光双染色法检测细胞凋亡和坏死;激光共聚焦显微镜检测没食子酸对F-actin和细胞核的影响。结果 浓度为40、60、80和100 μg/mL的没食子酸明显抑制了HUVECs细胞增殖,与对照组相比差异有统计学意义(P<0.05);荧光双染色法结果显示没食子酸诱导HUVECs发生凋亡和坏死,且随没食子酸浓度的增加,死亡细胞的比例显著增多;荧光染色显示细胞骨架蛋白F-actin的细丝发生断裂或重排,细胞核发生边集。结论 没食子酸具有显著抑制HUVECs增殖,诱导其凋亡和坏死的作用;此外,没食子酸还能破坏细胞骨架蛋白F-actin,这与抑制细胞迁移密切相关。
没食子酸 ;血管内皮细胞;细胞增殖;细胞迁移
没食子酸(Gallic acid),化学名3,4,5-三羟基苯甲酸(3,4,5-Trihydroxy benzoic acid),是一种资源丰富的多酚类化合物,广泛存在于茶叶、葡萄浆果类水果、红酒、橡树、栗子等植物中[1]。研究证实,没食子酸对宫颈癌[2]、乳腺癌[3]、肺癌[4]、前列腺癌[5]等多种肿瘤都有很好的抑制作用,此外,没食子酸对正常细胞的毒性比较低[6-7],因此被认为是一类理想的低毒高效的抗肿瘤化合物。没食子酸在抗肿瘤方面的作用备受关注[8-9],但是对于肿瘤血管的影响一直少有报道。血管内皮细胞的增殖和迁移是肿瘤血管生成的必要条件。抑制血管内皮细胞的增殖和迁移是控制肿瘤细胞浸润和转移的关键[10]。本研究旨在探讨没食子酸对血管内皮细胞增殖和迁移能力的影响。
1 材料与方法
1.1 仪器与试剂
Tecan infinite M200 型多功能酶标仪(瑞士帝肯公司),Olympus XSP-63XD激光共聚焦显微镜(日本奥林帕斯公司)。没食子酸,噻唑蓝(methyl thiazolyl tetrazolium,MTT),吖啶橙(acridine orange,AO),溴化乙锭(ethidium bromide,EB),罗丹明标记的鬼笔环肽,4′6-二脒基-2-苯基吲哚(4′6- diamidino-2-phenylindole,DAPI),DMEM高糖培养液,磷酸盐缓冲液(PBS),胎牛血清,胰蛋白酶和青霉素/链霉素溶液(购于Sigma公司),细胞培养瓶,激光共聚焦培养皿,96孔培养板和巴氏消毒管(购于BD公司)。二甲基亚砜(DMSO)为分析纯。人脐静脉血管内皮细胞(Human umbilical vein endothelial cells,HUVECs)(购于中国科学院上海生命科学研究院细胞资源中心)。
1.2 HUVECs的传代培养
将HUVECs复苏后,加入全成分DMEM高糖培养液(含10%胎牛血清,100 U/mL的青霉素和100 μg/mL链霉素),传至培养瓶中,置于37 ℃、5% CO2培养箱中培养。当细胞融合达80%时,加入胰蛋白酶进行消化并置于显微镜下观察,待细胞变圆后,用含血清的培养液终止消化。用巴氏消毒管吹打直至细胞变成单细胞悬液,移入10 mL离心管中,1 000 rpm离心5 min。吸弃上清,加入新鲜培养液混匀后接种孔板继续培养。
1.3 没食子酸的制备
没食子酸存储液:没食子酸粉末,用PBS配成浓度为10 mmol/L的存储液,0.22 μm针头式滤膜过滤分装,4 ℃避光保存。
MTT存储液:将MTT粉末50 mg溶于10 mL PBS中,配成浓度为5 mg/mL的存储液,0.22 μm针头式滤膜过滤分装,-20 ℃避光保存。DAPI溶液:储存液浓度为10 mg/mL,-20 ℃避光保存,用时按照1∶1 000的比例稀释。
1.4 剂量分组
将细胞分成5个样品组和1个对照组,样品组没食子酸的浓度分别为20、40、60、80和100 μmol/L。将培养好的细胞以1×105个/mL的浓度接种于96孔板,每孔100 μL,培养过夜后吸弃旧培养液,加入不含胎牛血清的DMEM培养液,继续培养4 h。对照组每孔加入100 μL DMEM高糖培养液,药物组每孔分别加入100 μL不同浓度的没食子酸处理24 h后终止培养。
1.5 观察指标
1.5.1 MTT比色法
没食子酸处理24 h 后,吸弃96孔板中旧的培养液,每孔加入100 μL不含胎牛血清的新鲜培养液,然后每孔加入MTT 储存液20 μL,继续培养4 h,终止培养,吸弃孔内液体,每孔加入DMSO 150 μL,37 ℃震荡反应10 min。置于连续光谱多功能酶标仪中震荡1 min,在490 nm波长处测定吸光度值(A),并记录结果,每个样品设三个复孔。
1.5.2 AO/EB荧光染色法
HUVECs细胞以2.5×105个/mL的浓度接种于6孔板,每孔接种2 mL。置于二氧化碳培养箱中培养过夜,待细胞全部铺展以后,吸弃旧培养液,每孔加入不含胎牛血清的DMEM高糖培养液,继续培养4 h后,加入没食子酸,没食子酸的终浓度分别为40、60和80 μmol/L。对照组加入不含胎牛血清的等体积培养液继续培养24 h。吸弃旧培养液,用PBS充分洗去未结合的药物,加入AO/EB混合荧光染色液400 μL(AO的浓度为0.1 mg/mL,EB的浓度为10 μL/mL)。染色5 min中后,吸弃染色液,加入PBS洗涤2次,荧光显微镜下观察并记录。
1.5.3 F-actin的测定
细胞以2×104个/mL的浓度接种于激光共聚焦培养皿,每皿接种2 mL。置于二氧化碳培养箱中培养过夜。待细胞完全铺满后吸弃旧的培养液,加入新鲜不含胎牛血清的培养液继续培养4 h,加入不同浓度的没食子酸处理24 h,对照组加入等体积的培养液。终止实验后,吸弃培养液,用PBS洗去未结合的药物,加入4%多聚甲醛固定30 min,PBS洗2次,每孔加入浓度为50 μg/mL的罗丹明标记的鬼笔环肽100 μL,室温避光反应30 min后,用PBS洗2次,每孔加入浓度为10 μg/mL的DAPI染色液100 μL,室温避光孵育5 min,用PBS洗去未结合的荧光染色液,置于荧光显微镜下观察并记录。
1.6 统计学处理
实验数据以均数±标准误差(mean±SEM)表示,所得实验数据采用SPSS13.0统计软件包进行方差分析。
2 结果与讨论
2.1 细胞活力测定
不同剂量的没食子酸作用于血管内皮细胞后,对血管内皮细胞增殖有明显的抑制作用,结果见图1。细胞存活率的降低与药物剂量之间有良好的剂量反应关系,随着药物浓度的增加,细胞存活率逐渐降低。这表明随着药物浓度的增加,细胞死亡的数量也逐渐增多。由表1可见,经过方差分析统计之后发现,用40 μmol/L的没食子酸处理血管内皮细胞时,就已经引起了明显的细胞死亡,与对照组相比差异有统计学意义(P<0.05)。用20 μmol/L的没食子酸处理细胞后,引起的细胞死亡与对照组相比差异无统计学意义(P>0.05)。高于40 μmol/L的没食子酸处理组所引起的细胞死亡与对照组相比差异均有统计学意义(P<0.05)。上述结果表明,没食子酸能有效地抑制血管内皮细胞的增殖。
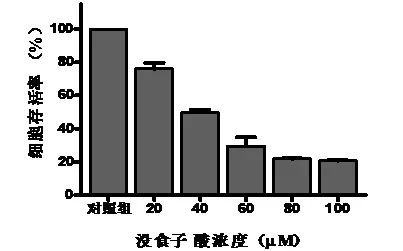
图 1 没食子酸对HUVECs存活率的影响

组 别n细胞存活率(μmol/L)对照组3100.00±0.0020μmol/L组377.93±6.3640μmol/L组351.90±4.68*60μmol/L组329.49±9.19*80μmol/L组322.34±1.30*100μmol/L组320.88±0.96*
*与对照组比较,P<0.05
2.2 细胞凋亡测定
AO能够穿透完整的细胞膜,与DNA结合发出绿色的荧光,而EB仅能透过受损的细胞膜并与DNA结合发出红色荧光。凋亡细胞呈现荧光染色增强,核染色质呈绿色固缩状或圆珠状结构,或者呈红色正常结构。正常细胞的细胞膜完整,因此无法被染成红色。此外,正常细胞的核染色质呈绿色且结构正常。通过颜色和形态可区分正常细胞和凋亡细胞[11]。由图2可知,对照组经染色后,多数细胞呈均匀的绿色荧光。核染色质呈绿色且结构正常,几乎无被染成红色的细胞,这一结果表明对照组均为活细胞。与对照组相比,40、60和80 μmol/L没食子酸剂量组绿色荧光均有所增强,核染色质有的呈固缩状或圆珠状。随着剂量的增加,发生核染色质固缩的细胞数量增多,核染色质呈红色且有正常结构的细胞数量也逐渐增多。这一结果表明,随着没食子酸浓度的增加,发生早期凋亡和晚期凋亡的细胞数量逐渐增多。没食子酸很有可能是通过诱导细胞凋亡的方式抑制血管内皮细胞增殖。在没食子酸的高剂量组,出现了核染色质为红色并呈固缩状或圆珠状的细胞,这表明在高剂量组出现了细胞坏死的现象。没食子酸在高浓度下会诱导细胞坏死,这也可能是其抑制细胞增殖的方式。

对照组 没食子酸(40 μmol/L)

没食子酸(60 μmol/L) 没食子酸(80 μmol/L)
图 2 荧光显微镜观察没食子酸诱导的凋亡和坏死细胞形态学变化(100×)
2.3 激光共聚焦显微镜分析F-actin 的变化
图3 结果表明,没食子酸作用于血管内皮细胞以后,对照组细胞骨架蛋白F-actin 在细胞质中分布均匀,F-actin被染成红色的长条细丝清晰可见,细胞轮廓清晰,细胞核完整并且饱满,细胞处于正常状态。与对照组相比,没食子酸处理组的细胞体积变小,细胞内的F-actin的细丝发生断裂或重排,细胞核边集,部分细胞膜与细胞核的界限模糊。这一结果表明,没食子酸对F-actin有明显的破坏作用,F-actin的破坏会损伤细胞的骨架结构,目前已知细胞骨架结构与细胞的运动有关[12],骨架结构的破坏表明没食子酸对血管内皮细胞的迁移可能也有抑制作用。细胞核的变化表明,没食子酸诱导的细胞死亡很有可能是由于核物质的变化引起的。

对照组 没食子酸(40 μmol/L)

没食子酸(60 μmol/L) 没食子酸(80 μmol/L)
图 3 荧光显微镜观察没食子酸诱导的F-actin和细胞核的变化(200×)
3 结 论
众所周知,肿瘤的生长需要新生血管为其提供充足的氧和营养物质,新生血管的形成是肿瘤生长和转移的必要条件,并贯穿肿瘤转移的全过程。研究表明,当肿瘤出现血管化后,血管中肿瘤细胞数量与肿瘤血管密度及肿瘤转移数目相关[12]。此外,血管内皮细胞的增殖和迁移是形成血管的必要条件。因此,抑制血管内皮细胞的增殖可影响肿瘤血管的生成,从而有效地阻止肿瘤的侵袭性生长。本实验发现没食子酸能够抑制血管内皮细胞的增殖,其作用机制可能是通过诱导细胞凋亡或坏死的方式而实现的。此外,研究还发现没食子酸具有抑制细胞迁移的能力。说明没食子酸在抑制肿瘤的新血管形成 、转移以及复发中均可发挥重要作用,可以作为抗肿瘤药物使用。如若进一步研究,有望为没食子酸在抗肿瘤方面的应用提出新思路。
[1] Kim N S,Jeong S I,Hwang B S,et al.Gallic acid inhibits viability and induces apoptosis in human monocytic cell line U937[J].J Med Food,2011,14(3):240-246.
[2] Faried A,Kurnia D,Faried L S,et al.Anticancer effects of gallic acid isolated from Indonesian herbal medicine,Phaleria macrocarpa (Scheff.) Boerl,on human cancer cell lines[J].Int J Oncol,2007,30(3):605-613.
[3] Hsu J D,Kao S H,Ou T T,er al.Gallic Acid Induces G2/M Phase arrest of breast cancer cell MCF-7 through stabilization of p27Kip1 attributed to disruption of p27Kip1/Skp2 complex[J].J Agric Food Chem,2011,59(5):1996-2003.
[4] Kawada M,Ohno Y,Ri Y,et al.Anti-tumor effect of gallic acid on LL-2 lung cancer cells transplanted in mice[J].Anticancer Drugs,2001,12 (10):847-852.
[5] Kaur M,Velmurugan B,Rajamanickam S,et al.Gallic acid,an active constituent of grape seed extract,exhibits anti-proliferative,pro-apoptotic and anti-tumorigenic effects against prostate carcinoma xenograft growth in nude mice[J].Pharm Res,2009,26(9):2133-2140.
[6] Inoue M,Suzuki R,Koide T,et al.Antioxidant,gallic acid,induces apoptosis in HL-60RG cells[J].Biochem Biophys Res Commun,1994,204(2):898-904.
[7] Inoue M,Suzuki R,Sakaguchi N,et al.Selective induction of cell death in cancer cells by gallic acid[J].Biol Pharm Bull,1995,18(11):1526-1530.
[8] Inoue M,Sakaguchi N,Isuzugawa K,et al.Role of reactive oxygen species in gallic acid-induced apoptosis[J].Biol Pharm Bull,2000,23(10):1153-1157.
[9] You B R,Moon H J,Han Y H,et al.Gallic acid inhibits the growth of HeLa cervical cancer cells via apoptosis and/or necrosis [J].Food Chem Toxicol,2010,48(5):1334-1340.
[10] 杨 帆,冉 芳,郭丹丹,等.维康醇诱导A549人肺癌细胞凋亡作用研究[J].石河子大学学报:自然科学版,2013,3(3):365-370.
[11] 尹崇高,李 平,李洪利,等.NUAK1通过影响F-actin聚合促进乳腺癌的侵袭转移[J].中国生物化学与分子生物学学报,2013,29(10):978-982.
[12] 马 飞,张志庸.肿瘤转移中血管生成的作用与抗血管生成治疗[J].中国医学文摘:肿瘤学,2002,16(2):165-167.
Study of gallic acid inhibited cell proliferation of human umbilical vein endothelial cells
XI Yan-li1,2,ZHANG Yang-ting1,MA Hong-bo1,LIU Min1,WU Xiang-qun2*,NIU Feng-lan2,WANG Shu-ran1*
(1.Department of Nutrition and Food Hygiene,School of Public Health,Jilin Medical College,Jilin City,Jilin Province,132013;2.School of Public Health,Jilin University,Changchun city,Jilin Province,130021,China)
Objective To investigate the inhibition of cell proliferation induced by gallic acid on human umbilical vein endothelial cells (HUVECs). Methods The proliferation inhibition rates of gallic acid on HUVECs were measured by MTT assay.The morphology changes of apoptotic and necrotic cells were observed by AO/EB double staining.The changes of F-actin and nucleus were detected by a laser confocal microscope. Results Gallic acid significantly inhibited the proliferation of HUVECs cells at the concentration of 40,60,80 and 100 μg/mL,compared with the control group (P<0.05).The double staining showed that gallic acid could induce the apoptosis and necrosis of HUVECs,and the ratios of death were obviously increase when the concentration of gallic acid increased.The F-actin fluorescence assay results showed that the filaments of F-actin broke or rearranged,and the nucleus edge set. Conclusion Gallic acid could inhibit the proliferation and induce apoptosis and necrosis in HUVECs cells.Furthermore,the cytoskeleton protein F-actin is destroyed by gallic acid which related to cell migration inhibition.
gallic acid;vein endothelial cells;cell growth;cell migration
1673-2995(2014)01-0001-04
郗艳丽(1981-),女(汉族),讲师,博士.
牛凤兰(1951-),女(汉族),教授,本科.
通讯作者: 王舒然(1968-),男(汉族),教授,博士.
R68
A
2013-12-17)
