LiCl-NaCl熔融盐体系镁铝合金电化学共沉积的实现
2014-08-10孙宁磊朱鸿民
孙宁磊, 朱鸿民
(1.中国恩菲工程技术有限公司, 北京 100038; 2.北京科技大学冶金与生态工程学院, 北京 100083)
LiCl-NaCl熔融盐体系镁铝合金电化学共沉积的实现
孙宁磊1, 朱鸿民2
(1.中国恩菲工程技术有限公司, 北京 100038; 2.北京科技大学冶金与生态工程学院, 北京 100083)
采用循环伏安法、电位扫描法和阶跃电流法在973 K的LiCl-NaCl-MgCl2-AlCl3熔融盐体系中,对Mg-Al共沉积的可行性进行探讨。结果表明,当Al3+阴极电化学过程为极限扩散控制时,Mg和Al可以在相同的电位下在阴极共同析出,合金理论沉积电压稳定在氯化镁的分解电压附近,随着电解的进行,阴极极化程度逐渐减小,导致槽电压降低。
镁合金; 电解共沉积; 熔融盐; 阴极过程; 成分控制
镁合金被称为“绿色合金”,具有密度低、机械性能及化学性质优良、可回收利用等优点,广泛应用于汽车工业、电子产品、航空等领域,并且其用量有大幅度增加的趋势。Mg-Al系合金是目前应用最广泛的镁基合金[1]。传统的镁铝合金制造方法,如金属熔炼、提前加入液态铝为阴极电解镁等方法,存在着流程长、能耗高、金属损耗大、环境污染严重等一系列问题[2-4]。1996年,美国通用汽车公司的Ram Sharma发明了一种有别于传统方法的合金生产方法[5]:在电解液中添加液态铝作为阴极,电解氧化镁或氯化镁,使镁在Al上沉积获得镁铝合金。这种方法需要预先准备纯金属铝,依然存在流程长的问题,而且需要定时取出合金,难以连续化生产。类似的使用液态或固态镁或镁合金作为阴极沉积金属获得合金的研究也非常广泛,如AZ-Li合金[6]、Mg-Li合金[7]等,但是这些方法都存在与上述方法相同的问题。
近年来,利用熔盐电解共沉积制备合金得到了广泛应用,但一直没有共沉积镁铝合金的报道,主要是由于MgCl2与AlCl3的分解电压相差太大,约为0.9V,为达到共沉积,单纯从热力学角度出发是非常困难的,这必须要求Al以极限扩散电流形式析出。所以,研究这两种离子的动力学过程,尤其是获得Al3+的电极过程参数,对于制定合理的电解方案是十分必要的。针对上述现状,本课题组以密度比较小的LiCl-NaCl(质量比5∶1)熔盐体系为电解质电解MgCl2、AlCl3,通过共沉积获得镁铝合金。相比于以上传统方法,此法大大缩短了流程,而且合金可以沉积在熔盐底部加以保护[8-9]。
本文主要应用电化学测试的手段对Mg-Al共沉积的行为进行深入探讨,并对电解过程中阴极、阳极电位变化进行了测定。
1 实验部分
1.1 原料准备
本研究中使用的所有无水氯化物包括LiCl-NaCl、MgCl2、AlCl3都需要经过精制处理。其中LiCl-NaCl和MgCl2通过一个石英反应装置在熔融状态下通HCl精制; AlCl3通过一个双室玻璃反应装置进行蒸馏精制[10]。精制后的盐在石英或玻璃瓶中使用火枪熔封,放入手套箱中备用。
1.2 电解槽设计
实验用石墨坩埚作为电解槽,采用两端开口的电阻炉加热,电阻炉两端用不锈钢盖子密封,电极从上盖的电极孔插入。采用三电极体系,钼棒作为阴极,石墨作为对极,参比电极采用莫来石管封装的Ag/AgCl电极,使用前对氯气进行标定。
用一根石英管通过上盖电极孔加料。加料管构造如下:首先将直径10 mm的石英管与直径25 mm的石英管用火枪熔接,再通过一玻璃三通及附带压头组装,侧口通入Ar气,上口通过直径10 mm玻璃管与橡皮管连接,另一端插入准备好的玻璃加料试管,橡皮管用夹子夹住。加料过程中,开放夹子,把料倒入,此时Ar气气流不断,而后关闭夹子,更换加料管。实验在氩气的气氛下进行,尾气通过下盖孔导出。
1.3 电化学实验及产物分析
所有电化学实验通过Potentiostat/Calvanostat (PAR EG & G, 263A)完成,数据由计算机控制的Powersuite软件包采集。实验采用循环伏安法、电位扫描法以及阶跃电流法进行电化学分析。
2 结果与讨论
2.1 Mg-Al共沉积的实现
图1为LiCl-NaCl-MgCl2-AlCl3体系循环伏安测试结果,在阴极负向扫描中,出现了A、B两个还原峰,依次对应了Al3+与Mg2+在阴极上的还原过程,而B′、A′为正向扫描时出现的对应的氧化峰,两种离子皆为一步放电。

图1 973 K下LiCl-NaCl-MgCl2(280 mmol/L)-AlCl3(90 mmol/L)循环伏安图谱
从图1中可以看出,Al在浓度90 mmol/L时析出电位为-1.8 V;Mg在浓度280 mmol/L时析出电位为-2.6 V,两者相差约0.8 V。一般来讲,当两种离子的析出电位相差不大时,由于合金形成的去极化作用,会在同一电位下放电析出。实际中,可以根据能斯特方程通过调整离子在母液中的浓度,使它们析出电位相同。
对于Al3+与Mg2+离子,其析出电位可用能斯特方程表示为:
(1)
(2)
当T=923 K,Al、Mg金属活度为1,Al3+、Mg2+活度用浓度代替,R=8.31 J/(K·mol),F=96 500 C/mol,联立(1)、(2)计算得:
aAl3+/aMg2+≈Exp(12)
(3)
由式(3)可知,若要两者在电势上达到同一水平,则需调整Mg2+的浓度为Al3+的1012倍,这在实际生产中是无法实现的,所以单纯通过改变浓度达到平衡电势的接近是非常困难的。
由于单纯从改变浓度上很难找到共沉积的条件,所以必须考虑动力学因素的影响。图2为Mg2+和Al3+阴极极化曲线图。
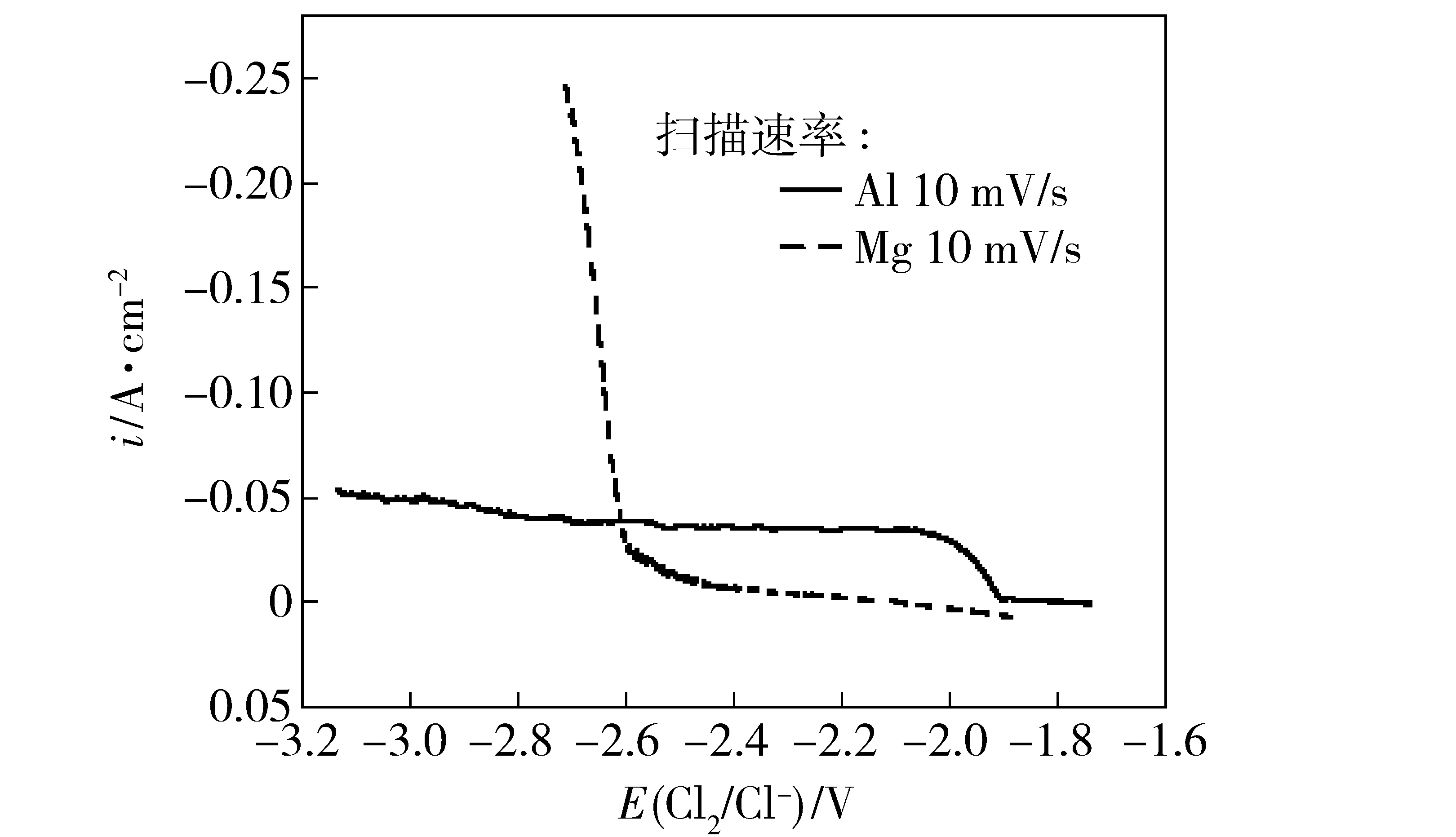
[Mg2+]=10%,[Al3+]=0.1%
可以看出,如果将氯化铝的浓度调节到适当低的水平,使铝析出的电极反应达到极限电流,电极电位极化到镁的析出电位附近,即可实现镁、铝的同时沉积。这时,电解时电极电势始终处在镁能析出的范围而对于铝则处于较高的过电势。此时Al的析出受极限扩散控制,而Mg2+的放电完全可以提供电流的平衡,这时认为Mg与Al共同放电析出。如果在实际电解体系中提高Mg2+的浓度,施加合适的电流,使离子析出情况与上述一致,则可以实现电解共沉积。实际电解过程中,随着电解的进行,Mg2+、Al3+含量均不断减小,为保证电解的连续进行,必须按以上计算进行加料。由于合金中铝的成分远高于电解液中氯化铝的相对成分,随着电解的进行,氯化铝的浓度下降比较快,可能会带来合金成分的波动。但合金的平均浓度取决于原料添加料中氯化镁和氯化铝的比例,只要电解液的浓度范围合理,合金的浓度就会在添加料的浓度附近波动,而且会自动调节,如图3。
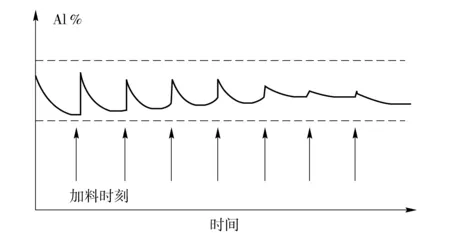
图3 合金中Al的含量波动示意图
控制MgCl2浓度1%,阴极电流密度0.8 A/cm2,此时与工业镁电解的工艺条件类似。在电解实验过程中加料频率为10 min/次,加料量根据法拉第定律计算。电解电位基本稳定于Mg的析出电位负一些,并且加料后电位并未跳跃到Al的析出电位附近,进一步说明Mg2+和Al3+在同一电位下同时放电,即Mg-Al共沉积。
2.2 电解过程槽电压的影响因素
电解共沉积过程中槽电压(Ecell)包括合金的平衡沉积电压(Ee)、阴极和阳极的过电位(ηc,ηa)以及回路中的电压降(Ec),可以用下式表示:
Ecell=Ee+ηc+ηa+Ec
(4)
本文对电解体系中各个影响因素进行测定。设定电解电流为1.5 A,阴极电流密度为0.8 A/cm2,阳极电流密度为0.025 A/cm2,通电时间为5 s,5 s末断电,持续时间5 s,此过程一直记录电位的变化。
图4为两电极体系在上述过程中的阴阳极两端电压值,通电过程中记录的电位值可以认为是槽电压(Ecell),数值为2.95 V。断电瞬间,电流消失,随之回路欧姆电压降也消失,阴阳极极化消失,电位第一个数据点显示了阴阳极平衡电位差,也即合金平衡沉积电压,数值为-2.65 V。
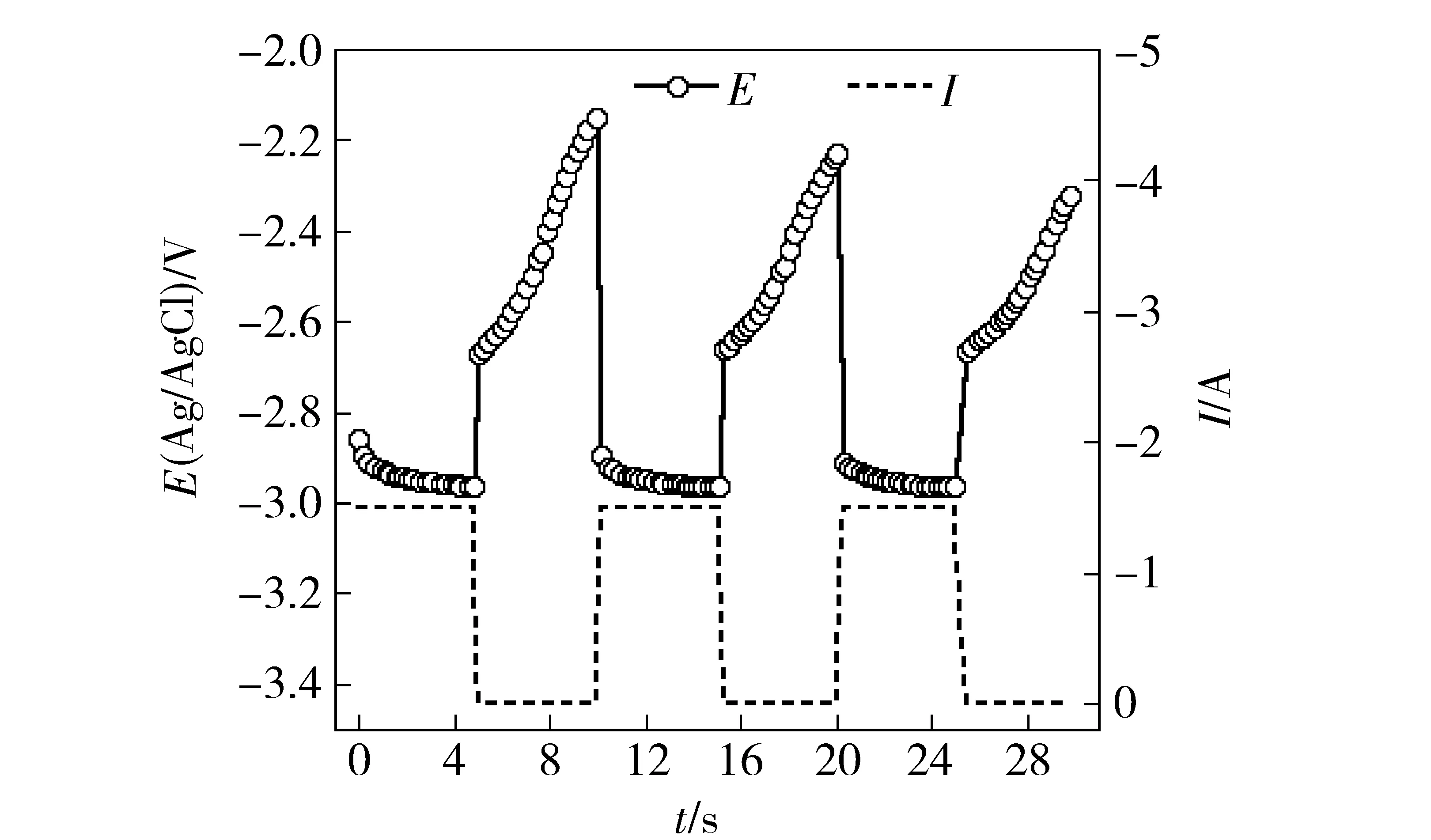
图4 合金平衡沉积电压的测量
在上述条件下的三电极体系中,对阴极的极化程度进行测量,测量方法同上,结果见图5。

图5 阴极极化值的测量
可以看出,通电时,阴极电位稳定在-1.77 V(Ag/AgCl)左右,当断电时阴极电位回到了平衡电位附近,其值为-1.59 V(Ag/AgCl),可以看出,阴极的极化程度为ηc=0.18 V。
同理,可以测得阳极的极化程度,见图6。

图6 阳极极化值的测量
可以看出,通电时阳极电位稳定在1.25 V(Ag/AgCl)附近,断电瞬间的平衡电位为1.08 V(Ag/AgCl),故阳极的极化程度为ηa=0.17 V。合金析出平衡电压也可以由分别测量的阴阳极平衡电位计算得出,结果为2.67 V,与两电极体系测试结果2.65 V非常接近。
可以认为,在上述电解条件,某个时刻,构成槽电压的ηa=0.17 V,ηc=0.18 V,合金析出平衡电压为2.65 V。
此外,对槽电压的贡献还有回路中的欧姆降,包括外电路中金属导线欧姆降以及熔盐体系的电阻。
图7为某电解过程中槽电压的变化记录值。可以看出,槽电压随着电解过程的进行趋于下降。当阴极上开始沉积合金时,电极尚为钼电极,随着电解的进行,电极表面逐渐被液态金属覆盖,并且电极面积有所减小,随后的合金沉积发生在液态合金之上,这些都有减小阴极极化的作用。对于阳极来讲,使用面积大的阳极其极化程度要明显小于小阳极。
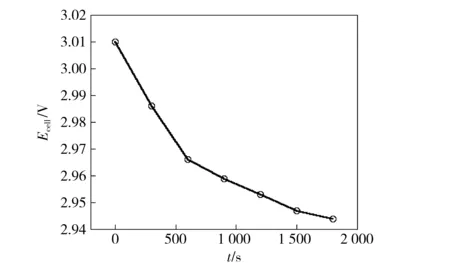
图7 槽电压随电解时间的变化
3 结论
循环伏安法、电位扫描法测试结果表明,当Al3+阴极电化学过程为极限扩散控制时,Mg和Al可以在相同的电位下共同在阴极析出。阶跃电流法结果测试结果,合金理论沉积电压稳定在氯化镁的分解电压附近,影响槽电压的主要因素有阴极极化、阳极极化,随着电解的进行,阴极极化程度逐渐减小,导致了槽电压的降低。
[1]Govind, et al. Development of Rapidly Solidified (RS) Magnesium-aluminum-zinc Alloy[J]. Materials Science and Engineering A, 304-306(2001), 1-2: 520-523.
[2]Cashion S P, Ricketts N J, Hayes P C. The mechanism of protection of molten magnesium by cover gas mixtures containing sulfur hexafluoride[J]. Light Metals, 2(2002), 1:37-42.
[3]Couling S L, Bennett F C, Leontis T E. Melting magnesium under air/SF6Protective Atmospheres[J]. Light Metal Age, 1977(10): 12-16.
[4]Hillis J E. New alternatives for magnesium melt protection[J]. Magnesium Industry, 1(2000), 1: 37-39.
[5]Sharma R A. Electrolytic Production Process for Magnesium and its Alloy[P], (1996), EP0747509.
[6]Lin M C, Uan J Y. Preparation of Mg-Li-Al-Zn Master Alloy in Air by Electrolytic Diffusing Method[J]. Materials Transactions (Japan), 46 (2005), 6:1354-1359.
[7]Zhang M L, et al. An electrochemical method for the preparation of Mg-Li[J]. Journal of Alloys and Compounds, 440(2007), 1-2: 362-366.
[8]X. Zhang, S.Q. Jiao and H.M. Zhu, Electrochemical Co-Deposition of Magnesium-aluminum Alloys in Alkali Chloride Melts[J].Journal of Metal, 56 (2004),11: 30.
[9]Sun N L, Ren J L, Liu H Y, Zhu H M. Electrochemical Co-Deposition of Magnesium Based Alloy from Molten Salts[J]. Transactions of Nonferrous Metals Society of China, 17(2007), s1:432-435.
[10]佐藤 譲.溶融塩の精製法と取り扱い技術[J].小特集/溶融塩と表面技術,1998,49(4):331-335.
RealizationofMg-Alalloypreparationbyelectrochemicalco-depositioninLiCl-NaClmoltensaltsystem
SUN Ning-lei, ZHU Hong-min
The feasibility of Mg-Al co-deposition by adopting cyclic voltammetry(CV), linear sweep voltammetry(LSV) and current step technique in LiCl-NaCl-MgCl2-AlCl3molten salt system at 973K was investigated. The test result shows that Mg and Al could be co-deposited on cathode under the same potential as long as electrochemical process of Al3+on cathode was controlled by diffusion limit. Alloy theoretical deposition voltage was detected stable near the decomposition voltage of MgCl2. The cell voltage was decreased during the process of electrolysis because of the declining of cathode polarization degree.
Mg alloy, co-deposition of electrolysis, molten salt, cathode process, composition control
孙宁磊(1980—),男,河北宣化人,博士,研究方向:有色金属冶金。


