新生大鼠高胆红素血症及脑病模型的建立与评价*
2014-08-09王晓丽郭明星梁俊晖张常娥
王晓丽, 郭明星, 梁俊晖, 张常娥
(广州医科大学病理生理学教研室, 广东 广州 510182)
新生儿高胆红素血症是由胆红素产生增加或排泄减少所致,其临床主要症状是黄疸[1]。新生儿黄疸发生率为80%[1],其中发生在出生后0~6 d的占64%[2]。胆红素脑病指新生儿出生1周内,血清中胆红素的浓度升高所致的急性脑损伤[3]。胆红素的毒性作用导致永久性的脑损伤称之为核黄疸,其死亡率为10%,并且存活的70%患儿留有神经系统后遗症[4]。胆红素脑病对家庭和社会都造成了巨大的负担[5],因发病机制仍未阐明,临床上也无特效的治疗措施,故胆红素介导的神经系统损害仍是研究的热点。胆红素脑病研究的疾病模型有很多种,包括先天基因缺失型,后天代谢损伤型等,但各自研究的侧重点不同,目前尚无统一的疾病研究模型。本文以3 d龄SD新生大鼠为研究对象,利用新生鼠血脑屏障不完善[6]的特点,腹腔注射胆红素,制作一种既不改变基因型,又不改变体内正常物质代谢的高胆红素血症新生大鼠,并对其进行相关指标测定和评价,以期为该领域的研究建立和确定稳定的高胆红素血症及胆红素脑病动物模型。
材 料 和 方 法
1 动物与材料
1.1动物 3 d龄新生SD大鼠,SPF级,体重(7.79 ±0.74)g,由广东省实验动物中心提供。合格证号为44007200000384/440720929,在室温环境和50%湿度[7]的条件下,新生鼠避光、母鼠哺育。
1.2药品及试剂 胆红素购自Sigma,血清总胆红素测试盒购自南京建成生物工程研究所,DC蛋白定量试剂盒购自Bio-Rad,ATP检测试剂盒购自碧云天生物技术研究所,其余生化试剂均为进口分装或国产分析纯。
1.3主要仪器 电子天平(Denver instrument),照相机(SAMSUNG),匀浆器(FLOKO),离心机(Eppendorf 5810R),多功能全波长酶标仪(Thermo),振荡切片机(Leica2000),显微镜(Olympus BX51)。
2 方法
2.1胆红素的配制 避光称取晶体胆红素66.7 mg,溶于1 mL 0.5 mol/L NaOH中,加入双蒸水9 mL,用0.5 mol/L HCl 调节pH至8.5,浓度为6.67 g/L。
2.2胆红素脑病动物模型的建立[8]将新生SD大鼠按窝别和体重随机均分为7组:腹腔注射生理盐水(Con 组),以及胆红素6.25 μg/g组(T1 组)、12.5 μg/g组(T2 组)、25 μg/g组(T3 组)、50 μg/g组(T4 组)、100 μg/g组(T5 组)和200 μg/g组(T6 组),每天2次,共注射6次,室温环境下避光哺育,第1次注射前(0 h)及末次注射12 h后(72 h)拍照、称重并取材。
2.3测定指标
2.3.1动物一般情况 每次注射胆红素及取材前,观察新生鼠一般情况,包括:皮肤颜色、精神状态、吃奶情况、呼吸、运动、对外界的刺激反应等,并称重。记录死亡新生鼠的数量,并计算生存率和死亡率,停止注射后再延续观察记录1周。
2.3.2血清总胆红素浓度和游离胆红素浓度 新生鼠末次注射12 h后,断头取血, 4 ℃ 3 000 r/min离心10 min,取上清暂时避光储存于-20 ℃ 冰箱备用。用重氮化反应法,用酶标仪在600 nm波长处,分别测定血清总胆红素及结合胆红素的吸光度(A)值,根据标准曲线[9]计算出血清总胆红素和游离胆红素的浓度,具体操作步骤按试盒说明书进行。
2.3.3胃内容物重量及其指数 新生鼠断头后,将鼠尸体置于冰上片刻,待胃内容物冷却凝固,取出全胃,去除胃表面系膜后,称胃全重。沿胃小弯纵向剪开,将胃内容物挤出,观察胃内容物颜色并称胃湿重,计算胃内容物重量(胃全重-胃湿重)及胃内容物指数(胃内容物重量/胃湿重)。
2.3.4肝/体重百分比 末次注射胆红素12 h后,新生鼠称重,断头,剖开腹腔,分离肝脏,去除血管蒂、表面系膜等,观察肝脏结构及颜色,称肝重,并计算肝/体重百分比(肝重/体重×100%)。
2.3.5脑组织胆红素的含量 新生鼠断头后,用眼科剪将颅骨从枕骨大孔开始,沿矢状缝向前剪开,并充分暴露大脑,弯镊将大脑前极轻轻翻开,夹断视神经交叉,取出全脑,4 ℃生理盐水漂洗,滤纸去血迹吸干,用氯仿微量抽提脑组织中的胆红素,重氮化反应法[10]进行测定。在570 nm波长处,测定脑组织胆红素的A值,同时制作标准曲线,并计算脑组织胆红素含量。
2.3.6脑组织ATP的含量 新生鼠断头后取出脑组织,用ATP试剂盒的裂解液将脑组织制成10%的组织匀浆, 4 ℃、12 000×g离心10 min,取上清检测ATP浓度,具体操作步骤按试剂盒说明书进行。用Lowry 法定量脑组织蛋白质的含量,并计算脑组织ATP的含量。
2.3.7脑组织的含水量 新生鼠断头后取出脑组织称脑湿重后,将脑放于62 ℃电热恒温鼓风干燥箱中,待其恒重后称干重,计算脑组织含水量=(湿重-干重)/湿重×100%。
2.3.8脑组织形态学检测 新生鼠末次注射12 h后,将大鼠麻醉,开胸开腹,充分暴露心脏及肝脏,去除心包膜,用眼科剪将肝脏剪破,将事先改造好的注射器针头,由左心室心尖部小心刺入心腔,顺着主动脉走行方向将弯针头小心地插入主动脉。用预热37 ℃肝素生理盐水灌流,待肝脏流出清亮液体1 min左右停止,共灌注大约10 mL; 再用4%多聚甲醛溶液灌流。停止灌流后,断头,将大鼠脑组织轻轻取出,于10%多聚甲醛中进行后固定约24 h。振荡切片机连续切片,厚度为20 μm。常规乙醇梯度脱水,苏木素-伊红(hematoxylin and eosin,HE)染色及尼氏染色(Nissl staining),透明、封片,光镜下观察组织病理改变。
3 统计学处理
数据以均数±标准差(mean±SD)表示,对于随机区组设计资料,方差齐,则多重比较采用Bonferroni法,其中重复测量数据首先进行相关性分析,如果相关则采用多元方差分析;如果不相关则采用重复测量设计资料的单变量方差分析;方差不齐,则采用非参数检验的多重比较Bonferroni法。采用SPSS 13.0 统计学软件处理,以P<0.05为差异有统计学意义。
结 果
1 一般情况、皮肤颜色和体重
1.1一般情况 所有的新生鼠经过3 d不同浓度的胆红素注射处理后,Con和T1组皮肤颜色红润,弹性好,活动正常;T2和T3 组皮肤出现轻度黄染,弹性一般,T2 组可见轻度精神萎靡、肌张力减低,T3 组活动减少,允吸不佳,有肌张力降低所致的轻度翻滚和俯伏症状出现;T4组皮肤中度黄染,弹性差,活动显著减少;T5组皮肤重度黄染,甚至发绿,皮肤弹性极差,吃奶次数明显减少,对外界刺激的反应明显减弱,甚至不活动;T6组皮肤呈现黄绿色,色泽晦暗,拒奶,随着注射次数的增加出现呼吸减慢,甚至昏迷,末次注射12 h后,基本全部死亡,故后续实验未设置T6组,见图1。

Figure 1. The skin color of neonatal rats at the time points of 0 h(A) and 72 h (B) after the first injection.
1.2新生鼠体重 为了消除不同窝别新生鼠的体重差异对实验结果的影响,我们按窝别随机区组分配,每组12只,每次注射胆红素前称重。随着注射次数的增多,Con和T1组新生鼠体重也随之增加,2组间无显著差异(P>0.05);T3 组在注射6次后(72 h)、T4 组在5 次注射后(60 h)、T5和T6组注射2次后(24 h),新生鼠体重与Con 组相比有显著差异(P<0.05); T5 组新生鼠从注射开始到结束体重无增长。T6 组注射2次后,体重增长开始抑制,随着注射次数增加,呈负增长,与Con和T1组相比,体重差异显著(P<0.01),见图2。

Figure 2. The changes of body weight of rats at different time points.Mean ±SD.n=12.*P<0.05, **P<0.01 vs Con; #P<0.05, ##P<0.01 vs T1; $P<0.05 vs T2.
2 新生鼠生存率的比较
新生大鼠经过3 d胆红素注射后,对参与实验的部分存活大鼠进行统计和拍照,并计算大鼠生存率。Con、T1和T2 组生存率分别为100%、100%和97.62%,组间差异无统计学意义(P>0.05)。T3 组生存率为86.57%,T4 组65.00%,T5 组46.15%,T6 组2.70%。与Con和T1 组相比,T3 组生存率显著降低(P<0.05),T4和T5 组分别与其它任意组相比,生存率均有显著差异(P<0.01),且依次递减。经过6 次注射,T6组死亡率接近100%,出于实验可行性及统计学的考虑,不参与其它指标的比较。停止胆红素注射后,继续观察和记录,1周后,T2 和T3组大鼠的生存率分别维持在 97.6%和86.5%,没有进一步的大鼠死亡;而T4组为53.2%,T5组为10.1%。T4和T5组1周后的死亡率与其它各组比较差异有统计学意义,见图3。
3 胃内容物重量及胃内容物指数
经过3 d胆红素注射后,72 h处死新生鼠,取全胃称重,清除胃内容物后称胃湿重,计算出胃内容物的重量。观察发现:Con、T1、T2和T3组胃内容物呈乳白色,T4 组呈黄色,T5 组呈黄绿色。随着胆红素注射浓度的加大,新生鼠进食的奶量明显减少,与Con和T1组比,T3、T4 和T5组胃内容物重量显著降低(P<0.05或P<0.01),见表1。
随着胆红素注射剂量和次数的增加,胃内容物指数整体呈现降低趋势。与Con和T1组相比,T2~T5 组胃内容物指数显著降低(P<0.05或P<0.01);与T2和T3 组相比,T5 组胃内容物指数显著降低(P<0.05),见表1。
4 肝/体重百分比
新生鼠胆红素末次注射72 h后,剖腹取肝,称肝重,并切开肝脏观察。 Con、T1、T2和T3 组肝脏色泽红润,结构完整,T4 组色泽黄染,结构尚完整,T5 组色泽暗黄,结构不完整。与Con和T1 组相比, T5 组肝/体重百分比显著升高(P<0.05),见表1。

Figure 3. The survival rate of rats in each group at different time points.

表1 新生鼠胃内容物重量、胃内容物指数及肝/体重百分比
5 血清总胆红素和游离胆红素的浓度
新生鼠胆红素注射72 h后,处死,取血清检测总胆红素和结合胆红素含量,并计算游离胆红素的量。与Con 组相比,T1 组血清总胆红素和游离胆红素的含量差异均无统计学意义(P>0.05),T2~T5 组显著升高(P<0.05或P<0.01);与T2、T3和T4 组相比,T5 组血清总胆红素和游离胆红素增高(P<0.01),见表2。
6 脑组织胆红素含量
末次注射胆红素72 h后,取出新生鼠脑组织观察,可见T3 组大脑皮层和脑干出现轻度黄染,T4和T5 组大脑皮层、小脑和脑干出现明显的黄染,但均无明显的出血灶。脑组织匀浆后测定胆红素含量,结果显示:与Con 组相比,T3、T4和T5组脑组织胆红素含量显著增高(P<0.05 或P<0.01);与T2和T3 组相比,T4和T5组显著升高(P<0.05 或P<0.01),见表 2。

表2 新生鼠血清总胆红素、游离胆红素浓度和脑组织胆红素含量
7 脑组织ATP含量
取新生鼠脑组织匀浆液,测定ATP的含量。随着注射胆红素浓度的增加,脑组织中ATP的含量增加,T3 组达到最高峰,随后T4和T5 组ATP浓度下降,呈现抛物线式。与Con 组相比,T1、T2和T3组差别无统计学意义,T4和T5组则显著降低(P<0.05 或P<0.01),见表 3。
8 脑组织含水量
新生鼠经过6 次注射胆红素后,72 h取出脑组织,称脑重,经过62 ℃烘烤,待恒重后,称脑组织干重,计算各组新生鼠脑组织含水量,比较发现各组之间均无统计学意义(P>0.05),见表3。
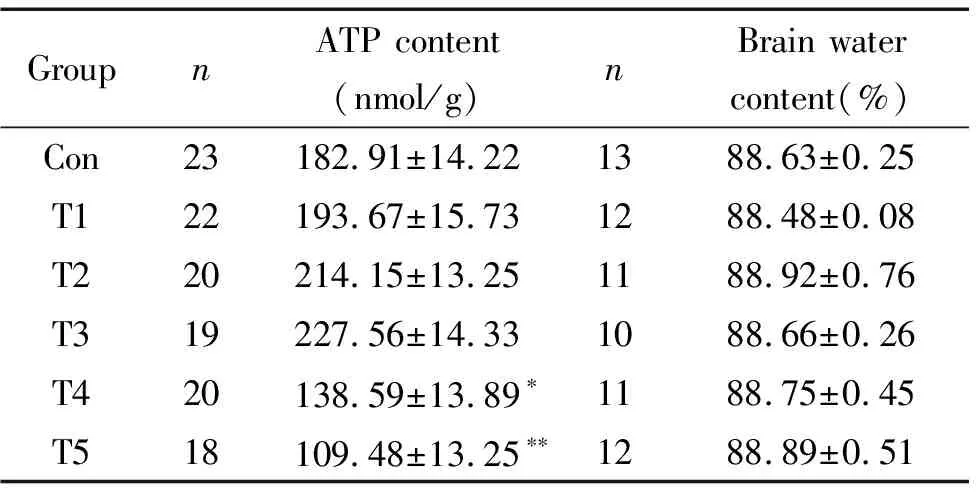
表3 脑组织ATP含量和脑含水量
9 HE染色
对新生鼠进行72 h胆红素腹腔注射后,灌流固定,振荡切片,进行HE染色。光镜下可见:Con组大鼠脑皮质神经元结构清晰完整,细胞排列密集整齐,神经元胞浆丰富淡染,细胞核居中,核仁清楚,细胞浆红染,细胞周围间隙致密没有水肿。随着胆红素浓度的升高,大脑皮层不同部位神经元数量逐渐减少。T4和T5组,神经元结构紊乱,可见细胞肿胀,核固缩、碎裂、溶解等,部分细胞呈嗜酸性变,脑组织胆红素沉积逐渐增多,可见黄染颗粒。大脑皮层可见部分神经元核染色质浓缩,染色加深,甚至核碎裂等现象,推测为凋亡细胞。部分神经元呈均质红染的无结构物质,核染色消失,推测为坏死的细胞,见图4。
10 尼氏染色
末次胆红素注射12 h,灌流固定后取材,振荡切片,进行尼氏染色。普通光镜下,紫色为尼氏小体,皮质神经元的结果显示:随着胆红素浓度的增高,皮质神经元胞体变小,尼氏小体减少,胞质染色逐渐变浅,T5组部分神经元溶解甚至消失,见图5。
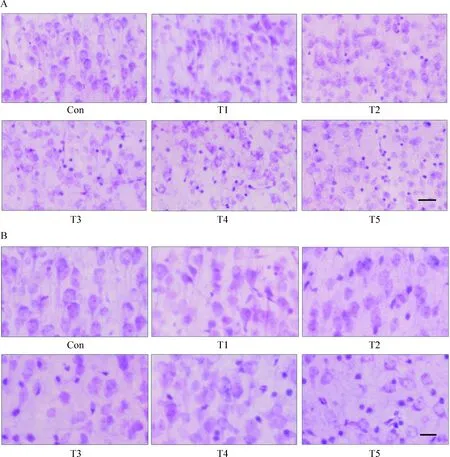
Figure 4. HE staining of cortical neurons in the rats with bilirubin encephalopathy. A: scale bar=50 μm; B: scale bar=20 μm.
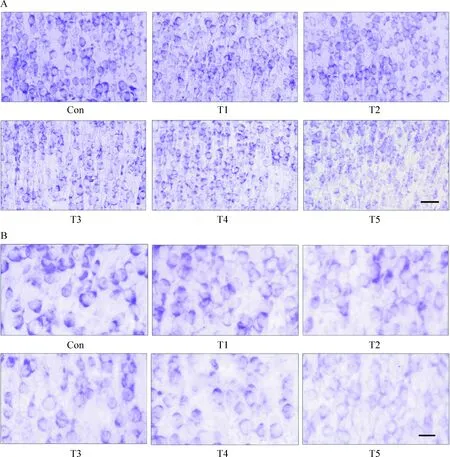
Figure 5. Nissl staining of cortical neurons in the rats with bilirubin encephalopathy.A:scale bar=50 μm; B:scale bar=20 μm.
讨 论
高胆红素血症是新生儿常见的病理过程,主要临床表现是皮肤和黏膜黄染,临床发病率极高。高胆红素血症的程度及持续时间与胆红素脑病的严重程度有关,重者可以出现胆红素脑病或留有永久性神经系统后遗症,因其确切的发病机理未完全明了,目前尚无有效的治疗药物,故死亡率高。为了更好地研究疾病的发生机制,寻找有效的治疗方法和药物,亟需建立一种稳定而有效的动物模型。
目前用于研究高胆红素血症的动物模型品种繁多,包括:(1)胆红素大剂量一次性静脉注射:虽然能成功地复制高胆红素血症模型,病理检查脑干中可见胆红素结晶[11-12],但这种造模方法操作难度相对较大,应用于新生鼠有其局限性,但成年大鼠一次性静脉注射需另外加药物使血脑屏障开放,因而增加了造模过程中其它因素的干扰,更关键的是其与新生儿黄疸发病的时间窗及大脑神经元的发育水平不一致,不利于模拟新生儿核黄疸发病及其对个体长远影响的研究。(2)基因突变(缺陷)模型: 纯合子Gunn大鼠因编码葡萄糖醛酸转移酶的基因缺陷,新生鼠体内游离的胆红素不能转化成结合型胆红素被排泄而出现黄疸,但血液中胆红素的浓度达不到核黄疸的程度[13],需要用药物抑制胆红素与白蛋白结合[14],或破坏红细胞[15]来提高血液中的胆红素浓度。尿苷二磷酸葡萄糖醛酸转移酶1A1(UDP bilirubin glucuronosyl transferase 1A1,UGT1A1) 是调控人类胆红素代谢的关键肝酶[13],新生幼鼠UGT基因突变后体内的胆红素浓度高且稳定,是复制人类先天高胆红素血症的理想模型,但因为存在基因改变的特性,可能会对新生鼠造成一些潜在的影响,同时基因突变所导致的可重复性差也是一大难题。(3)溶血性模型:用药物破坏红细胞,可以成功制作溶血性高胆红素血症动物模型[16],也可以诱导核黄疸,适用于胆红素脑病的研究,但这类药物除损伤红细胞外,也可致白细胞减少,损伤动物的免疫功能。综合起来,各种模型均有利弊,且适合研究的侧重点不同,不利于全面整体的研究。
为了更有利于基础及临床研究,我们参考安丽等[8]方法,利用新生鼠血脑屏障发育不完善的特点,在7d龄新生鼠一次性腹腔注射的基础上进行改进。首次以3 日 龄SD新生鼠为对象,进行胆红素连续6次注射,使其血液胆红素的升高非一过性而是维持一定时间,从而建立一种持续稳定的高胆红素血症模型。
通过本研究发现:新生大鼠经过胆红素注射后,随着胆红素注射次数及浓度的增多,大鼠血清和脑组织中游离胆红素的含量逐渐升高。一般表现为食欲逐渐降低,吃奶量减少,且大鼠活动能力受抑制;体重也逐渐被抑制,到200 μg/g(T6组)剂量时,体重出现负增长,72 h死亡率接近100%,3 d后停止胆红素注射,继续对幸存的新生鼠观察和记录1周后发现,胆红素对新生鼠的影响依然存在,T4和T5组新生鼠因出现高胆红素血症,死亡率随着时间的延长而继续增加,1周后死亡率分别为46.8%和89.9%,其余各组死亡率几乎没变化。同时,浓度越大,皮肤、黏膜和脑组织黄染的程度越严重。并且随着胆红素注射量的升高,肝脏受损伤的程度也加重,但各组新生鼠脑组织的含水量没有显著差异。脑组织的ATP含量呈现先升高后降低的趋势,在浓度为25 μg/g(T3组)时,ATP 的含量达到最高值。有文献表明[17],在神经细胞进行抗损伤过程中,初期的能量代谢是一个代偿过程, 表现为ATP的含量增加,当损伤达到一定程度时,神经元细胞能量代谢呈现失代偿反应,表现为ATP含量降低。另有文献报道[18],在体外进行神经元单独培养时,其抗损伤能力相对较差,胆红素作用后,ATP含量只会降低,而在神经元与胶质细胞共培养,加药4 h检测时,发现ATP的含量会增高达到峰值,随着药物损伤的加重,ATP的含量才会降低,研究者认为,这是高胆红素血症能量代谢增强的佐证,我们的检测结果与其相似。新生鼠作为一个具有完整功能的机体,各种神经细胞之间相互作用、相互协调,在轻度高胆红素血症时,能量代谢代偿性增强,ATP含量会有所增高。严重高胆红素血症和核黄疸时,线粒体损伤严重,细胞能量代谢严重障碍,ATP含量也随之降低,有关能量代谢双向变化的具体机制,有待进一步研究。从脑组织切片HE及尼氏染色发现,随着胆红素注射剂量的增加,各组大鼠大脑皮层及海马等不同部位神经元数量减少逐渐明显,结构紊乱,可见细胞肿胀,核固缩、碎裂、溶解等,部分细胞呈嗜酸性变,脑组织胆红素沉积的颗粒逐渐增多,神经元存在不同程度的凋亡与坏死。随着胆红素注射剂量的增加,神经元内尼氏小体染色亦逐渐变浅,小体数量明显减少,部分溶解甚至消失,说明各实验组神经元受到不同程度的损害。
从我们的实验结果和观察到的现象可以确定,3日龄新生鼠经腹腔注射胆红素12.5、25、50和100 μg/g均可以成功建立高胆红素血症模型,鉴于各组间脑组织ATP含量、HE及尼氏染色等的变化差异,我们认为50和100 μg/g剂量可以成功复制出胆红素脑病的模型,因 100 μg/g 后续死亡率增加,50 μg/g造模更稳定和全面,更适合高胆红素血症、胆红素脑病及其后遗症的长时间研究。
胆红素是亲脂性的,血浆游离胆红素浓度升高,透过血脑屏障进入大脑,致脑组织损伤,产生胆红素脑病,这与新生儿期发生高胆红素血症和核黄疸发病的时间窗及条件相似,可以更精确地模拟早产儿黄疸的发病过程;同时我们多层次、多角度的对该模型进行了测定、观察和评价,成功复制出高胆红素血症和胆红素脑病的新生大鼠模型,为该领域的后续研究建立了稳定的研究模型和具体的研究方法。我们采用腹腔注射胆红素的方式造模,操作难度小,经济易行,不存在因基因型改变所造成的潜在影响,还避免了药物或化学物质注射引起的干扰。通过不同浓度胆红素的注射,还可以灵活控制血液胆红素的浓度,可以达到不同的研究目的。该模型的确定对高胆红素血症,胆红素脑病及其后遗症的研究具有一定的理论和现实意义。
[参 考 文 献]
[1] Burgos AE, Flaherman VJ, Newman TB. Screening and follow-up for neonatalhyperbilirubinemia: a review[J]. Clin Pediatr, 2012, 51(1): 7-16.
[2] Tikmani SS, Warraich HJ, Abbasi F, et al. Incidence of neonatal hyperbilirubinemia: a population-based prospective study in Pakistan[J]. Trop Med Int Health, 2010, 15(5): 502-507.
[3] American Academy of Pediatrics Subcommittee on Hyperbilirubinemia. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation[J]. Pediatrics, 2004, 114(1): 297- 316.
[4] Ip S, Chung M, Kulig J, et al. An evidence-based review of important issues concerning neonatal hyperbilirubinemia[J]. Pediatrics, 2004, 114(1): e130-e153.
[5] Burgos AE, Schmitt SK, Stevenson DK, et al. Readmission for neonatal jaundice in California, 1991-2000: trends and implications[J]. Pediatrics, 2008, 121(4): e864-e869.
[6] Xu J, Ling EA. Studies of the ultrastructure and permeability of the blood-brain barrier in the developing corpus callosum in postnatal rat brain using electron dense tracers[J]. J Anat, 1994, 184 (Pt 2): 227-237.
[7] Tsuchie K, Miyaoka T, Furuya M, et al. The effects of antipsychotics on behavioral abnormalities of the Gunn rat (unconjugated hyperbilirubinemia rat), a rat model of schizophrenia[J]. Asian J Psychiatr, 2013, 6(2): 119- 123.
[8] 安 丽, 王晓琴, 王 平, 等. 高胆红素血症新生大鼠脑组织激活素A、caspase- 3表达的研究[J]. 中华神经医学杂志, 2008, 7(3): 262-266.
[9] 邵 燕, 胡 滨, 孙慧颖, 等. Doumas血清总胆红素参考方法标准曲线的复现[J]. 临床检验杂志, 2013, 31(2):139-141.
[10] Bratlid D, Winsnes A. Determination of conjugated and unconjugated bilirubin by methods based on direct spectrophotometry and chloroform- extraction. A reappraisal[J]. Scand J Clin Lab Invest, 1971, 28(1): 41-48.
[11] Hansen T, Tommarello S, Allen J. Subcellular localization of bilirubin in rat brain afterinvivoi.v. administration of [3H]bilirubin[J]. Pediatr Res, 2001, 49(2): 203- 207.
[12] Mesner O, Miller MJ, Iben SC, et al. Hyperbilirubinemia diminishes respiratory drive in a rat pup model[J]. Pediatr Res, 2008, 64(3): 270-274.
[13] Nguyen N, Bonzo JA, Chen S, et al. Disruption of the ugt1 locus in mice resembles human Crigler-Najjar type I disease[J]. J Biol Chem, 2008, 283(12): 7901-7911.
[14] Daood MJ, McDonagh AF, Watchko JF. Calculated free bilirubin levels and neurotoxicity[J]. J Perinatol, 2009, 29(Suppl 1): S14-S19.
[15] Rice AC, Shapiro SM. A new animal model of hemolytic hyperbilirubinemia-induced bilirubin encephalopathy (kernicterus)[J]. Pediatr Res, 2008, 64(3): 265- 269.
[16] Mejia GB, Sanz CR, Avila MM, et al. Experimental hemolysis model to study bilirubin encephalopathy in rat brain[J]. J Neurosci Methods, 2008, 168(1): 35-41.
[17] Taylor DL, Edwards AD, Mehmet H. Oxidative metabolism, apoptosis and perinatal brain injury[J]. Brain Pathol, 1999, 9(1):93-117.
[18] Falcão AS, Silva RF, Vaz AR, et al. [J]. Cross-talk between neurons and astrocytes in response to bilirubin: early beneficial effects[J]. Neurochem Res, 2013, 38(3):644-659.
