四氯化碳诱导肝纤维化早期大鼠肝窦内皮细胞及基底膜形态改变的动态研究*
2014-08-09黄月红郭杞兰陈治新陈运新张莉娟王小众
黄月红, 郭杞兰, 陈治新, 陈运新, 张莉娟, 王小众
(福建医科大学附属协和医院消化内科,福建 福州 350001)
肝窦是肝细胞与血浆之间进行物质交换的场所。 肝窦壁由肝窦内皮细胞(liver sinusoidal endothe-lial cells, LSECs)组成。生理状态下LSECs远侧胞质有许多窗孔,呈筛状形态,内皮下无基底膜(basement membrane, BM)[1]。病理状态下,LSECs的窗孔减少或消失(失窗孔),内皮下 BM形成,形似连续毛细血管,称为肝窦毛细血管化[2]。肝窦毛细血管化是肝纤维化过程中一个重要的病理改变[3]。研究肝窦毛细血管化的形成过程以及其与肝纤维化、肝硬化的发生关系已经成为肝病研究领域的一个热点。本实验拟通过观察LSECs 与肝窦BM在四氯化碳(carbon tetrachloride, CCl4)诱导形成大鼠肝纤维化早期的变化,探讨四氯化碳诱导大鼠早期肝纤维化时肝窦毛细血管化的形成过程,为进一步抗肝纤维化研究提供实验依据。
材 料 和 方 法
1 动物和材料
清洁级雄性SD大鼠38只,体重(180±20) g,购自上海斯莱克实验动物有限责任公司[许可证号码为SCXK(沪)2007-0005],清洁级条件喂养,自由进食进水。动物实验遵照福建医科大学伦理委员会实验动物管理条例执行,并接受伦理委员会的监督和指导。
CCl4和蓖麻油购自上海凌峰化学试剂有限公司,兔抗大鼠CD31 多克隆抗体购自圣克鲁斯生物技术(上海)有限公司,兔抗大鼠层黏连蛋白(laminin, LN)及IV型胶原(collagen type IV, Col IV)多克隆抗体购自Abcam,枸橼酸盐组织抗原修复液(pH 6.0)、胃蛋白酶消化液、兔超敏二步法免疫组化检测试剂及浓缩型DAB试剂盒均购自北京中杉金桥生物技术有限公司。
2 方法
2.1大鼠肝纤维化模型建立[4]及实验分组 清洁级雄性SD大鼠适应性喂养1周后,苦味酸标记,称体重,平均体重(200±10) g,采用随机数字表法将大鼠随机分为2组:正常对照组(N组,6只),肝纤维化模型组(M组,32只)。M组大鼠腹腔注射50% CCl4蓖麻油混合液,N组大鼠腹腔注射生理盐水2 mL/kg,每周2次,共4周,分别于造模第3天、第1周、第2周和第4周,将各组大鼠用10%水合氯醛(4 mL/kg)腹腔注射麻醉(禁食8 h)后,收集各组大鼠肝组织保存备用。
2.2HE染色观察肝组织病理学改变 收集各组大鼠左叶肝组织,经4%甲醛固定、石蜡包埋,切片常规脱蜡至水,入苏木素液染色5 min,自来水冲洗,盐酸乙醇分化30 s,自来水浸泡15 min或温水(约50 ℃)5 min,置伊红液染色2 min,蒸馏水冲洗,常规脱水,透明,封片,显微镜下观察各组大鼠肝脏组织的炎症及纤维化程度。
2.3Masson染色法观察肝组织中网状纤维的沉积情况 各组大鼠肝组织石蜡切片常规脱蜡至水,Harris苏木素液染色1~2 min,蒸馏水洗3次,丽春红品红液染色5~10 min,蒸馏水洗3次,磷钼酸分化1 min至胶原纤维淡红色,入浅绿液染色,使胶原纤维呈绿色约5~10 min,95%乙醇、无水乙醇脱水,二甲苯透明,中性树胶封固,显微镜下观察各组大鼠肝脏组织的网状纤维沉积情况。
2.4透射电子显微镜观察肝窦内皮细胞及基底膜的改变 取肝左叶部分组织,用锋利的刀片切成1 mm×1 mm×1 mm, 迅速放入固定液(3%戊二醛-1.5%多聚甲醛)中,4 ℃固定2 h以上,用0.1 mol/L PBS (pH 7.2) 漂洗3次,再用含1%锇酸和1.5%亚铁氰化钾的固定液4 ℃后固定1.5 h,再次漂洗3次,脱水,纯618包埋剂35 ℃ 包埋3 h,切片、染色: 超薄切片机切70~80 nm的超薄切片;经醋酸铀、柠檬酸铅分别染色5 min,后蒸馏水水洗。在PHILIPS EM208型透射电镜下观察肝窦内皮细胞及基底膜的改变并摄片。
2.5免疫组织化学法检测大鼠肝组织中CD31、LN与Col IV的表达 采用北京中杉金桥生物技术有限公司超敏SP免疫组化试剂盒进行检测。切片常规脱蜡、水化,枸橼酸盐微波或胰蛋白酶抗原修复,3% H2O2阻断内源性过氧化物酶,Ⅰ抗分别为兔抗大鼠CD31多抗(1∶100)、兔抗大鼠LN多抗(1∶100)和兔抗大鼠Col IV多抗(1∶200),再加入Ⅱ抗,DAB显色,苏木素染液复染。省略Ⅰ抗和Ⅱ抗作为空白对照,以PBS替换Ⅰ抗,作为阴性对照。细胞浆、核或膜有棕黄色颗粒沉着为阳性染色。染色结果根据染色细胞多少及染色深浅判断各指标表达情况,使用Image-Pro Plus 5.0软件检测各组目的蛋白表达的积分吸光度(IA)。
3 统计学处理
数据以均数标准差(mean±SD)表示,组间差异用SPSS 11.5统计分析,采用方差分析,以P<0.01为差异有统计学意义.
结 果
1 CCl4诱导肝纤维化早期大鼠肝脏组织病理形态变化
HE及Masson染色结果显示(图1),正常对照组的大鼠肝组织结构清晰,肝小叶结构正常,肝细胞索以肝小叶中央静脉为中心向四周放射状整齐排列,肝细胞无变性、坏死,肝窦无扩张,少量胶原纤维在汇管区和中央静脉分布, 肝小叶间未见纤维组织增生。CCl4造模3 d后大鼠肝小叶中央静脉及汇管区血管周围可见炎症细胞浸润明显,肝细胞水肿,少数出现点、灶状坏死,个别甚至出现桥接坏死,肝窦略扩张,胶原纤维分布同正常组;造模1周时血管周围炎症细胞浸润较前减少,仍见少数点、灶状坏死及桥接坏死,个别大鼠肝脏桥接坏死范围广,累及多个小叶,类似重症肝炎的表现;汇管区、肝窦扩大,纤维组织开始增生,沿着汇管区及中央静脉向外延伸;造模2周,炎症细胞浸润较1周时有所减轻,但纤维组织增生明显;造模第4周时,可见肝细胞脂肪样变,小叶结构紊乱,纤维条索更加粗大明显,但大部分尚未相互连接,无完整分界形成。
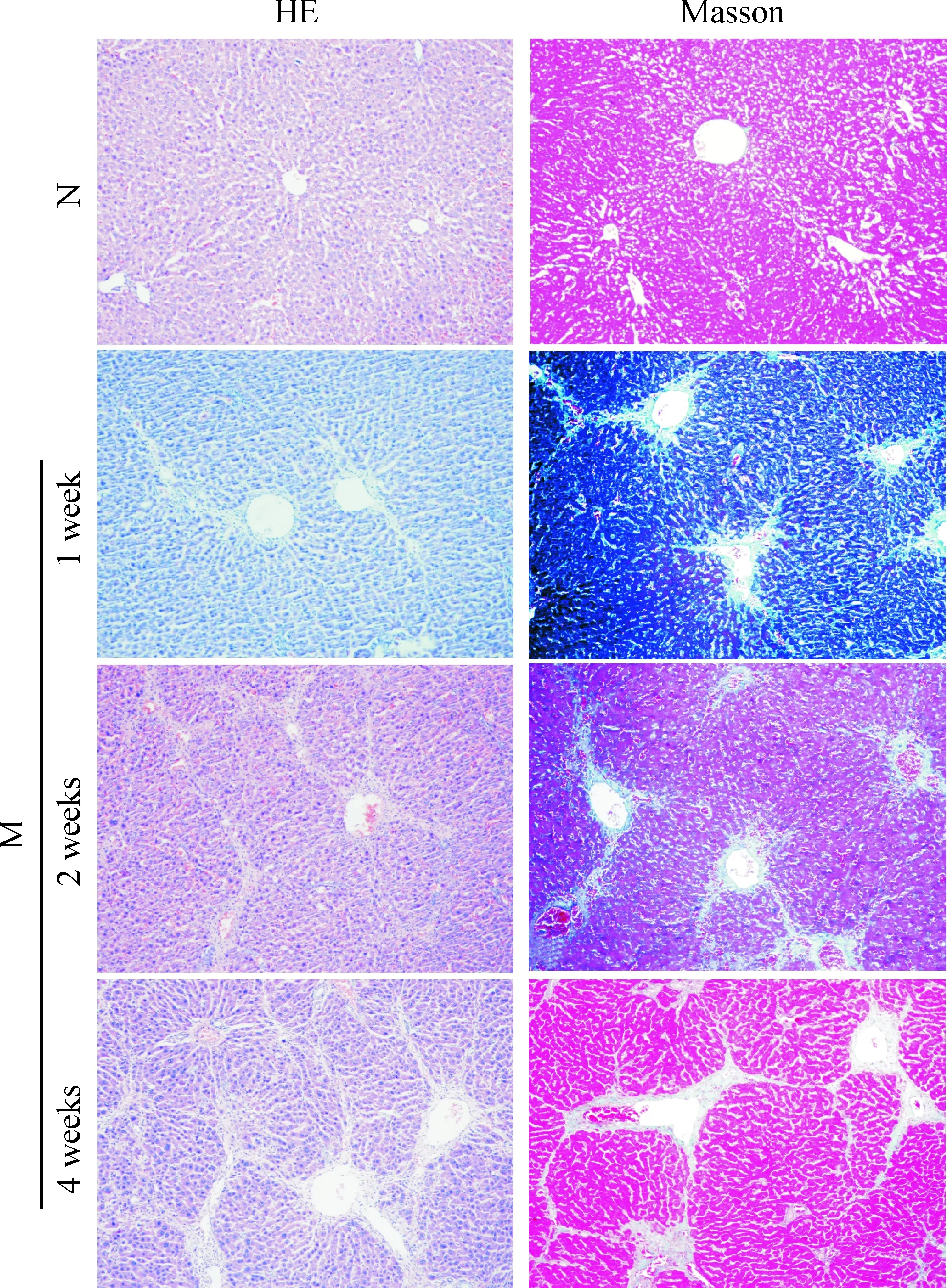
Figure 1. Pathological changes in the livers (HE and Masson staining, ×200). N:normal control group; M:liver fibrotic model group.
2 CCl4诱导肝纤维化早期大鼠肝窦内皮细胞与基底膜的改变
透射电镜结果显示(图2),正常对照组的大鼠LSECs扁平,远侧胞质成薄片状、不连续,有许多窗孔,内皮下未见BM,Disse间隙内有大量伸入的肝微绒毛,偶有少量胶原纤维,肝星状细胞(hepatic stellate cells, HSCs)含有大量脂滴,呈静止状态;CCl4造模3 d后大鼠部分LSECs窗孔数目减少、直径变小,内皮下未见BM;1周和2周时,LSECs窗孔进一步减少甚至消失,内皮下仍未见BM,Disse间隙内肝微绒毛减少,HSCs脂滴变少,粗面内质网增多;4周时,LSECs窗孔减少甚至消失,范围较2周广,间隔内见胶原纤维束,局部内皮下可见连续基底膜。

Figure 2. Fenestration (▶) and basement membrane (→) changes of liver sinusoidal endothelial cells in fibrotic rats observed by transmission electron microscopy. N: normal control group; M: liver fibrotic model group.
3 CCl4诱导肝纤维化早期大鼠肝窦内皮细胞表面标志物CD31的表达
SP免疫组织化学染色结果显示,正常组大鼠肝窦内皮细胞表面标志物CD31阳性染色主要见于中央静脉及汇管区血管壁,部分肝窦可见淡染;CCl4模型组大鼠肝窦CD31阳性染色区域及染色程度随着造模时间延长逐渐加深。阳性表达强度半定量分析显示造模第3天及1周时模型组大鼠肝窦CD31阳性表达较正常大鼠明显增多,差别有统计学意义(P<0.05);而3 d与1周之间肝窦CD31阳性表达没有明显差别(P>0.05);随着造模时间延长,肝窦CD31阳性表达强度逐渐增强,差别有统计学意义(P<0.05),见图3。
4 CCl4诱导肝纤维化早期大鼠肝组织Col IV的表达
SP免疫组织化学染色结果显示,正常组大鼠Col IV阳性染色多位于中央静脉、汇管区血管、胆管内皮细胞的基底膜,肝窦壁染色微弱、断续;CCl4肝纤维化大鼠肝组织Col IV阳性表达强度随着纤维化程度的加重而增强,阳性表达范围从汇管区纤维沉积部位到肝窦壁均有明显阳性着色。阳性表达强度半定量分析显示CCl4诱导肝纤维化早期各时点大鼠Col IV阳性表达较正常对照组明显增强,差别有统计学意义(P<0.05);其中以CCl4造模2周与4周时,大鼠Col IV阳性表达范围及强度均显著增加,与造模1周时比较,差别有统计学意义(P<0.05),见图4。
5 CCl4诱导肝纤维化早期大鼠肝组织LN的表达
SP免疫组织化学染色结果显示肝纤维化早期大鼠肝组织LN阳性着色分布与Col IV类似,但阳性表达强度较Col IV弱。阳性表达半定量分析结果显示大鼠LN表达在CCl4造模后阳性表达明显增强,尤其在造模第4周时LN阳性表达最明显,与CCl4造模2周比较差别有统计学意义(P<0.05),见图5。
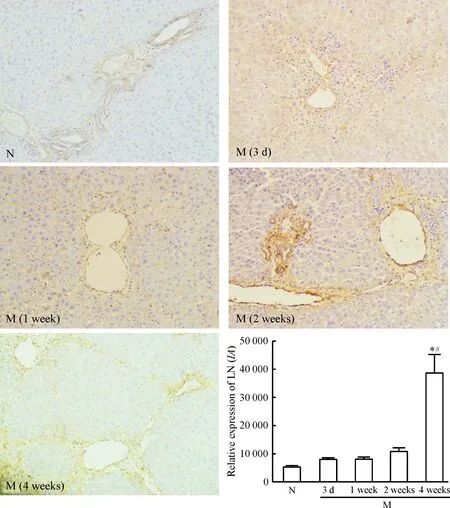
Figure 5. The expression of laminin in the early stage of liver fibrosis (SP immunohistochemistry, ×200). N: normal control group; M: liver fibrotic model group. Mean±SD.n=6.*P<0.05 vs N; #P<0.05 vs 2 weeks.
讨 论
本研究通过CCl4诱导大鼠肝纤维化模型,动态观察肝纤维化形成早期肝窦内皮细胞与基底膜的形态变化过程,实验结果显示在肝纤维化早期(CCl4造模4周后)大鼠局部肝脏组织可形成典型肝窦毛细血管化的改变且肝窦壁上LN的沉积是肝窦毛细血管化连续基底膜形成的关键因素。
肝窦毛细血管化是肝纤维化过程中重要的病理改变, 研究提示肝窦毛细血管化先于肝纤维化的形成[5-6]。LSECs失窗孔和内皮下连续性BM形成是其主要特征。在肝纤维化形成过程中动态观察肝窦毛细血管化的形成有利于后续抗肝窦毛细血管化研究的作用靶点选择。故本实验选用经典肝纤维化造模方法CCl4诱导大鼠肝纤维化以观察肝窦毛细血管化的形成,结果显示当肝组织以炎症反应为主时(造模第3天和1周时)LSECs主要表现为窗孔直径减小与数目的减少,而网状纤维沉积增多与基底膜的形成密切相关并且在早期肝纤维化形成时(造模第4周时)肝脏局部可见典型的肝窦毛细血管化形成(肝窦可见LSECs窗孔消失及连续BM),与国外报道相似[7-8]。
肝窦毛细血管化的特征之一是LSECs表型发生改变,LSECs表达血管内皮标志物明显增强[2]。CD31是常见的血管内皮标记物,正常LSECs不表达CD31,但肝纤维化过程中LSECs表达血管内皮标记物CD31逐渐增强[9-10],有研究显示新分离的LSECs是胞内表达CD31而培养后则形成表面表达,扫描电镜观察通过CD31磁珠分选得到的LSECs 表面末见窗孔[11],提示CD31的表达与LSECs的窗孔状态密切相关。本实验结果显示CCl4诱导肝纤维化大鼠肝脏中CD31阳性染色区域及染色程度与LSECs的窗孔变化密切相关,随着LSECs窗孔逐渐减少至消失而肝窦内皮CD31的表达逐渐增强并在肝窦局部形成毛细血管化时(造模第4周时)表达最明显,提示CD31表达增强反映失窗孔或窗孔数目减少的LSECs增多。
肝窦壁上形成连续的BM是肝窦毛细血管化的另一重要特征。连续的BM的主要成份是糖蛋白和基底膜胶原,其中以LN和Col IV为主。LN是ECM中的一种大分子非胶原黏蛋白, 能与胶原等结合形成BM结构, 影响细胞的黏附,调节细胞的生长与分化, 并与肝纤维化发生及肿瘤的侵袭转移有关[12]。正常的肝窦壁仅见以新合成的不连续的Col IV为主,而无LN[13]。免疫组化染色显示正常大鼠中央静脉、汇管区血管、胆管内皮细胞的基底膜,肝窦壁可见微弱、断续的Col IV及LN阳性着色。有报道肝纤维化早期,以Col IV为主的功能性基底膜破坏,Col IV变为连续性,同时开始出现LN,形成毛细血管化[13],提示肝窦毛细血管化的启动与Col IV密切相关而肝窦毛细血管化的形成与Col IV与LN相互交联密切相关。本实验结果显示造模第2周时肝组织网状纤维沉积增多但肝窦内皮下未见连续的BM,免疫组化显示此时肝窦壁BM成分以Col IV阳性着色显著增多为主,提示Col IV是此时肝窦壁BM的主要成分。随着CCl4损伤的持续,于造模第4周部分肝组织局部的肝窦内皮下可形成连续的BM,此时免疫组化显示肝组织中Col IV沉积持续增多同时伴随着糖蛋白LN表达增多,结果提示肝纤维化早期肝脏局部肝窦毛细血管化形成可见连续的BM是Col IV与LN表达共同作用的结果。
综上所述,CCl4诱导肝纤维化早期大鼠肝脏局部可形成典型的肝窦毛细血管,其主要表现为肝窦内皮细胞窗孔直径的减小、窗孔数量的减少以及由Col IV与LN沉积共同构成连续的基底膜,其中LN的沉积是连续基底膜形成的必要条件之一,本实验为进一步的抗肝窦毛细血管化研究提供了重要的实验参数。
[参 考 文 献]
[1] 阎 明,刘慧敏,张喜红,等. DDR2与MMP2在酒精性肝病肝窦毛细血管化中的协同表达[J]. 中国病理生理杂志, 2010, 26(8):1515-1520.
[2] Xu B, Broome U, Uzunel M, et al. Capillarization of hepatic sinusoid by liver endothelial cell-reactive autoantibodies in patients with cirrhosis and chronic hepatitis[J]. Am J Pathol, 2003, 163(4):1275-1289.
[3] 陆 雄,刘 平. 肝纤维化过程中一个重要的病理改变——肝窦毛细血管化[J]. 中华肝脏病杂志, 2001, 9(1):53-54.
[4] Huang YH, Shi MN, Zheng WD, et al. Therapeutic effect of interleukin-10 on CCl4-induced hepatic fibrosis in rats[J]. World J Gastroenterol, 2006, 12(9):1386-1391.
[5] Deleve LD, Wang X, Guo Y. Sinusoidal endothelial cells prevent rat stellate cell activation and promote reversion to quiescence[J]. Hepatology, 2008, 48(3):920-930.
[6] Xie G, Wang X, Wang L, et al. Role of differentiation of liver sinusoidal endothelial cells in progression and regression of hepatic fibrosis in rats[J]. Gastroenterology, 2012, 142(4):918-927.e6.
[7] Onori P, Morini S, Franchitto A, et al. Hepatic microvascular features in experimental cirrhosis: a structural and morphometrical study in CCl4-treated rats[J]. J Hepatol, 2000, 33(4):555-563.
[8] 王宪波,刘 平,唐志鹏, 等. 肝窦内皮细胞损伤和表型改变在大鼠肝硬化门脉高压发生中的作用[J]. 中国病理生理杂志, 2005, 21(9):1811-1816.
[9] 都金星,刘 平,孙明瑜, 等. 下淤血汤对四氯化碳诱导的肝硬化大鼠肝脏血管新生的抑制作用[J]. 中西医结合学报, 2011, 9(8):878-887.
[10] 潘杰斌,焦作义,张冬红, 等. 肝窦内皮细胞的研究进展[J]. 中国普外基础与临床杂志, 2013, 20(5):579-582.
[11] DeLeve LD, Wang X, McCuskey MK, et al. Rat liver endothelial cells isolated by anti-CD31 immunomagnetic se-paration lack fenestrae and sieve plates[J]. Am J Physiol Gastrointest Liver Physiol, 2006, 291(6):G1187-G1189.
[12] 刘小菁,黄明慧,彭雪梅, 等.YIGSR五肽及RGD三肽对肝窦内皮细胞窗孔的调节作用[J]. 华西医科大学学报, 2001, 32(3):338-340, 375.
[13] 李娟梅,闫 洁,吕文良, 等. 肝窦内皮细胞参与肝纤维化的机制[J]. 大连医科大学学报, 2013, 35(1):81-83, 102.
