免疫抑制剂FK506所致血糖升高副作用的机制研究*
2014-08-09唐丽丽吴存造郑少玲杨亦荣陈必成
张 玲, 孙 萌, 史 波, 唐丽丽, 吴存造, 蔡 勇, 夏 鹏, 郑少玲, 杨亦荣, 陈必成
(温州医科大学附属第一医院,浙江 温州 325000)
移植术后糖尿病(post-transplantation diabetes mellitus,PTDM)是实体脏器移植后常见的并发症之一,严重影响移植受者的长期生存率及移植脏器的存活率。据报道,PTDM的发病率因移植脏器的不同而有所差别,范围波动在4%~50%[1]。大量研究表明[2],免疫调节剂钙调磷酸酶抑制剂(calcineurin inhibitor, CaNI)的大量运用是PTDM的重要危险因素之一。临床常用的CaNI以FK506和环孢霉素A(cyclosporin A, CsA)为主, 且FK506比CsA更易诱导PTDM[3]。目前,多数基础研究主要关注FK506对胰岛细胞的损伤及胰岛素分泌的影响。也有研究表明[4-5],使用CaNI的移植术后患者早期血胰岛素水平普遍会高于正常组。FK506作为胰岛移植术后最常用的免疫抑制剂之一,其诱导PTDM的机制存在矛盾之处。本研究通过建立动物模型,尝试阐述FK506对大鼠脂肪因子分泌谱及其关键信号通路PPAR-γ的影响,以进一步揭示FK506诱导糖耐量损伤的机制。
材 料 和 方 法
1 材料及设备
FK506(国药准字J20090142)购于安斯泰来制药(中国)有限公司;生理盐水购于上海丽臣生物科技有限公司;水合氯醛购于上海京索来宝生物科技有限公司;血糖仪及血糖试纸购于长沙三诺生物传感股份有限公司;Trizol试剂购于Gibco;逆转录试剂盒和SYBR Green I荧光定量试剂盒购自东洋纺(上海)生物科技有限公司;实时荧光定量PCR所用引物由上海生工生物技术有限公司合成(引物序列见表1);PPAR-γ、adiponectin、GAPDH兔抗大鼠Ⅰ抗以及辣根过氧化物酶标记山羊抗兔IgG Ⅱ抗购于Abcam;所用荧光定量PCR仪ABI7500购于ABI。

表1 实时荧光定量PCR引物序列
2 动物分组与模型制备
雄性SD大鼠12只,9周龄,购于北京维通利华实验动物技术有限公司,动物许可证号为SCXK(京)2012-0001,初始体重为(188.65±12.71)g,血糖(4.86±0.44)mmol/L。动物饲养环境:温度(22±2) ℃,保持通风,自然昼夜节律变化,相对湿度40%~60%。给予动物标准饲料,1只1笼喂养。
大鼠适应性喂养1周后,随机分为2组(每组6只)。给药组大鼠给予腹腔注射1 mg·kg-1·d-1FK506 (1 mg溶于2 mL生理盐水);对照组大鼠给予腹腔注射1 mL·kg-1·d-1生理盐水。在禁食不禁水8 h后,每天测空腹体重1次。用药后,用大鼠固定器固定大鼠,断尾取血,每2 d测空腹血糖(fasting blood glucose,FBG)。
3 标本的留取与保存
给药第15天,禁食8 h后,给予10%水合氯醛腹腔注射麻醉(0.3 mL/kg),固定,消毒。经下腔静脉放血后,取大鼠腹腔内脏脂肪及附睾脂肪组织,以预冷生理盐水冲洗干净,滤纸吸干水份后放入冻存管,迅速转入液氮降温,-80 ℃长期保存。
4 实时荧光定量PCR方法检测靶基因表达情况
用 Trizol试剂盒提取给药组和对照组大鼠脂肪组织的总RNA。参照逆转录试剂盒说明书,吸取2 μg RNA样本在10 μL体系中进行逆转录反应。取逆转录产物1 μL进行PCR扩增, PCR扩增体系为:5 μL荧光定量染料2×SYBR荧光定量试剂、2 μL引物(上、下游各1 μL)、2 μL Plus反应液、1 μL cDNA。检测靶基因包括: 氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor γ,PPAR-γ)、脂联素 (adiponectin)、抵抗素 (resistin)、瘦素 (leptin)、内酯素 (visfatin)、视黄醇结合蛋白4 (retinol-binding protein 4, RBP4)。扩增程序为:95 ℃ 3 min后,进行95 ℃ 15 s,62 ℃ 15 s,72 ℃ 45 s,共40个循环扩增。得到的Ct值用2-ΔΔCt法计算mRNA表达的变化(结果为倍数关系)。
5 Western blotting法检测靶蛋白表达情况
裂解液(RIPA)提取给药组与对照组大鼠脂肪组织蛋白。冻融后的脂肪组织100 mg在冰上剪碎,加入1 mL 含1% PMSF的裂解液,作用60 min后吸取提取液; 12 000 r/min 离心30 min,取上清液测蛋白浓度;制备10%聚丙烯酰胺分离胶和5%浓缩胶,样品5×SDS上样缓冲液, 设置恒压100 V, 电泳60 min;设置恒流350 mA,湿法电转移(脂联素30 min,PPAR-γ 55 min), 转膜后的PVDF膜经5% TBST脱脂奶粉室温封闭2 h;然后加Ⅰ抗(稀释在Ⅰ抗稀释液中),4 ℃孵育过夜,加入相应种属Ⅱ抗,室温孵育1.5 h,ECL发光液孵育膜5 min,暗室压片曝光,显影定影后胶片保存。
6 统计学处理
数据以均数±标准差(mean±SD)表示, 采用Microsoft Excel 2003统计软件进行单因素方差分析和IBM SPSS Statistics 19统计软件进行重复测量设计的方差分析。以P<0.05为差异有统计学意义。
结 果
1 一般情况及大鼠体重的变化
在观察时间内,大鼠活动正常,各组大鼠未出现死亡现象。2组大鼠在实验过程中体重缓慢增加,第14天后2组大鼠体重无显著差异(P>0.05),见图1。可排除体重对实验结果的影响。
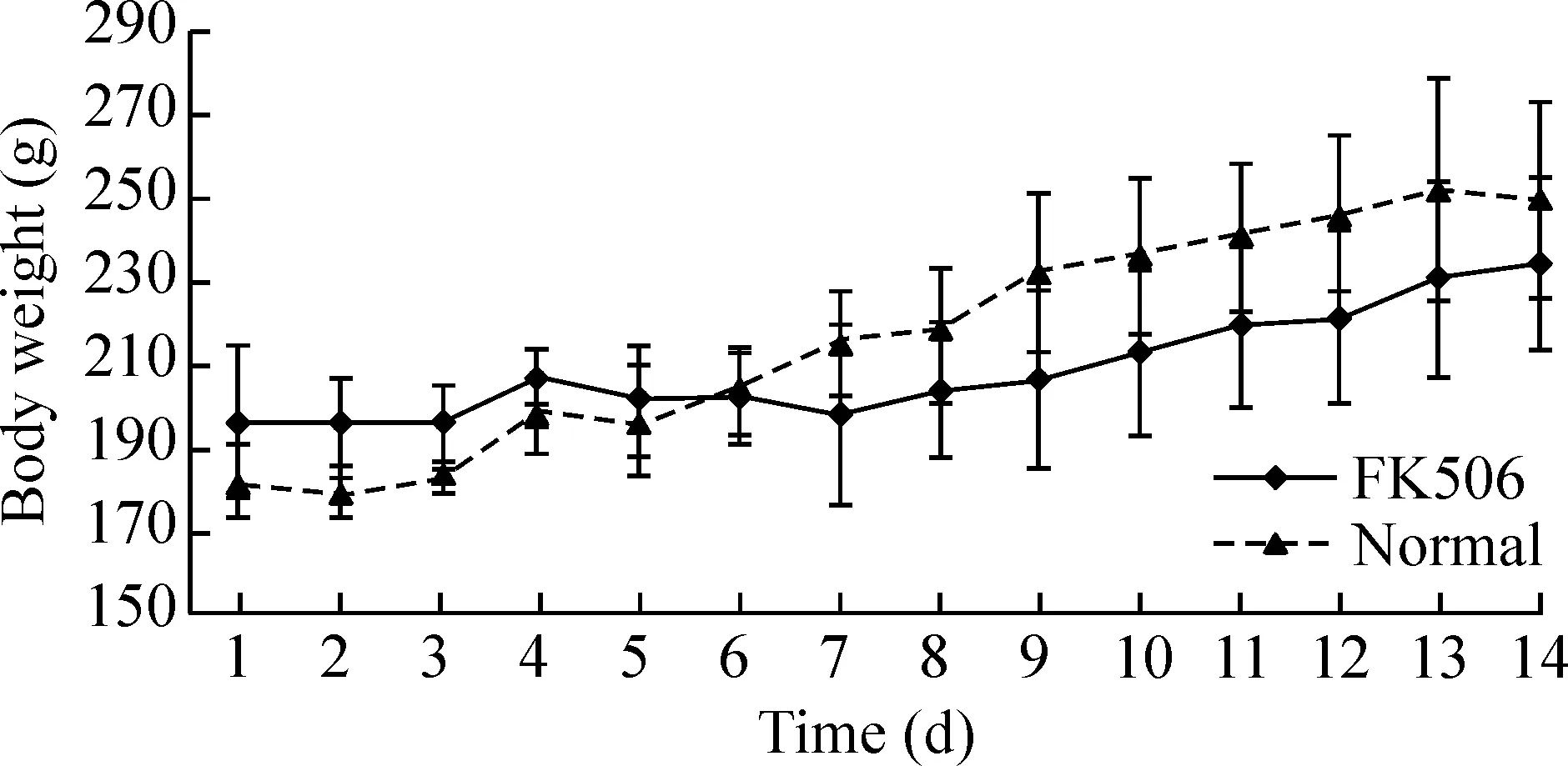
Figure 1. The changes of body weight in the rats fasted for 8 h.Mean±SD.n=6.
2 2组大鼠FBG变化
在实验期间前10 d内,2组大鼠FBG值无明显差异,见图2。在第10天后,给药组大鼠FBG趋势发生变化,第12天的空腹血糖首次大于7 mmol/L。第13天、第15天连续监测FBG,给药组大鼠持续≥7 mmol/L,而对照组大鼠血糖始终<6.5 mmol/L。给药组大鼠FBG显著高于对照组(P<0.05)。对照组大鼠FBG无显著变化(P>0.05)。
3 2组大鼠脂肪组织PPAR-γ mRNA的表达
2组大鼠脂肪组织PPAR-γ mRNA的表达差异显著(P<0.05)。给药组大鼠PPAR-γ mRNA的表达量明显低于对照组(P<0.05),见图3。
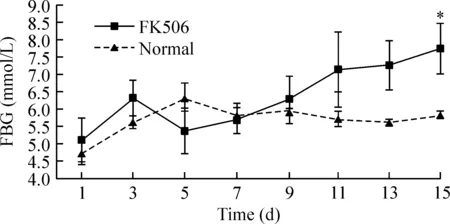
Figure 2. The changes of fasting blood glucose in adult rats observed for 2 weeks.Mean±SD.n=6.*P<0.05 vs normal.

Figure 3. The mRNA expression of PPAR-γ in adipose tissues of the rats treated with FK506 or saline (normal).Mean±SD.n=6.*P<0.05 vs normal.
4 2组大鼠脂肪因子mRNA表达的变化
与对照组相比,给药组大鼠脂联素的表达下降到20%,瘦素的表达下降到60%,差异显著(P<0.05);而内酯素、抵抗素及RBP4的表达相对升高,分别升高至对照组的3倍、2倍及1.6倍(P<0.05),见图4。
5 2组大鼠脂肪组织PPAR-γ及脂联素蛋白的表达变化
2组大鼠脂肪组织PPAR-γ及脂联素蛋白表达差异显著。与对照组相比,给药组大鼠PPAR-γ蛋白的表达量下降到40%,脂联素下降到19%(P<0.05),见图5、6。
讨 论
FK506是目前在临床运用最为广泛的CaNI免疫抑制剂,主要通过calcineurin/NFAT通路,抑制T细胞的免疫应答。目前,多数研究认为,PTDM发生机制主要是FK506在抑制免疫反应的同时,也通过calcineurin/NFAT通路作用于胰岛β细胞,抑制胰岛素的分泌[6]。也有体外研究表明,FK506可以作用于脂肪细胞,参与下调PPAR-γ的表达[7]。本研究表明,与对照组相比,给予FK506的大鼠FBG明显升高;内脏脂肪组织的PPAR-γ、脂联素及瘦素mRNA的表达量降低,内酯素、抵抗素及RBP4 mRNA的表达量升高。通过本实验证实,FK506能够调节脂肪组织中PPAR-γ及脂肪因子的表达。
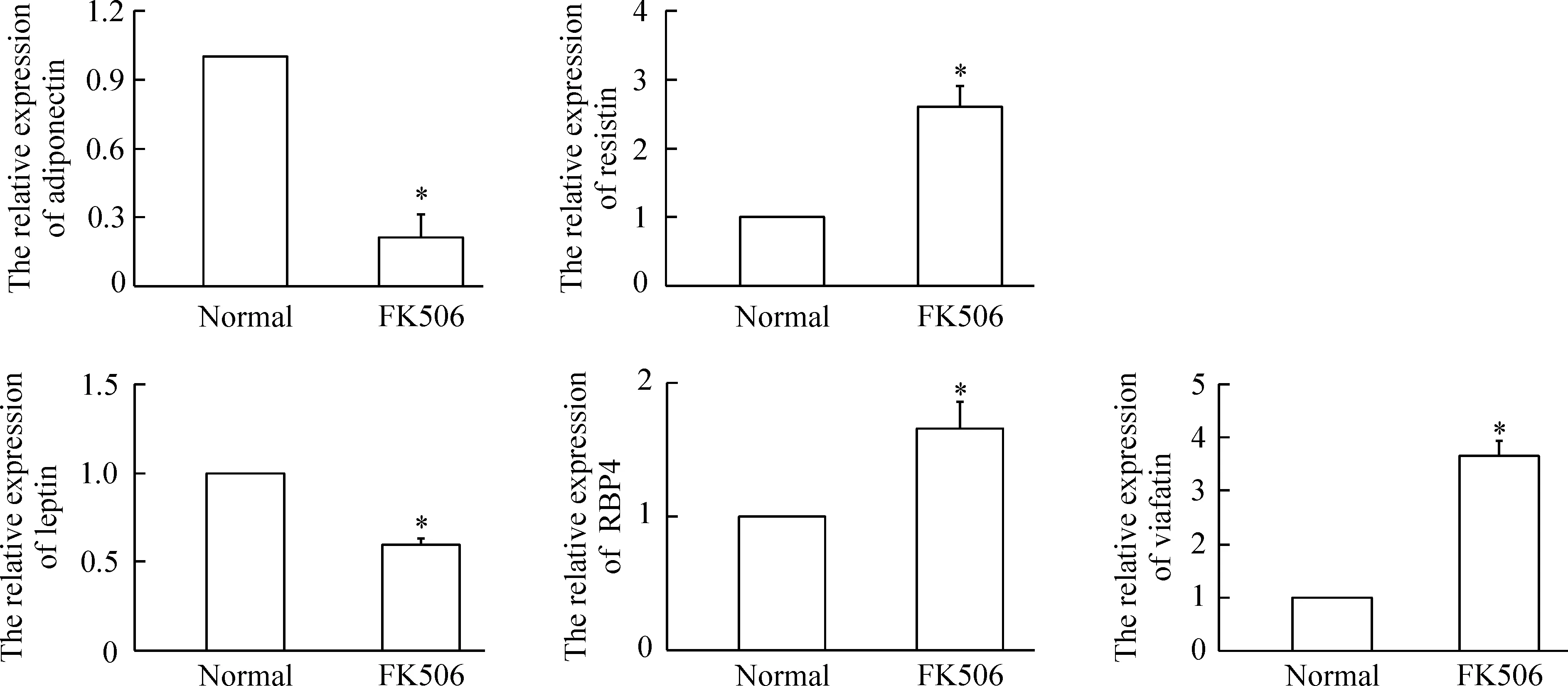
Figure 4. The mRNA expression of adipocytokines in the rats fasted for 8 h and treated with FK506 or saline.Mean±SD.n=3.*P<0.05 vs normal.
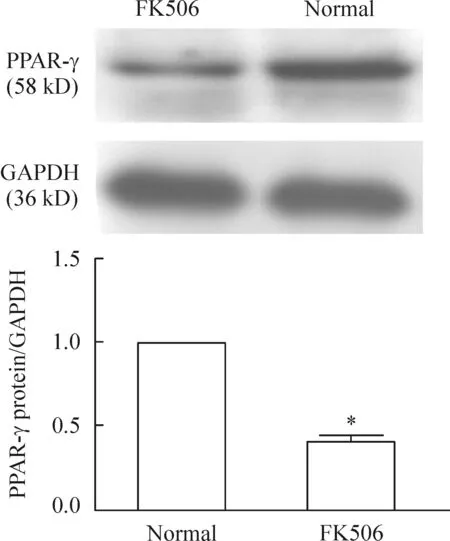
Figure 5. The expression of PPAR-γ detected by Western blotting.Mean±SD.n=3.*P<0.05 vs normal.

Figure 6. The expression of adiponectin detected by Western blotting.Mean±SD.n=3.*P<0.05 vs normal.
早在2007年,Hernandez-Fisac等[8]用一定剂量的FK506成功建立PTDM大鼠模型,来研究FK506对胰岛素基因表达的影响。本实验以此为参考,在排除大鼠体重对实验的干扰下,得到的FK506大鼠FBG明显高于对照组。这充分说明,FK506是影响大鼠空腹血糖变化及胰岛素对血糖变化调节能力的独立因素。FK506对血糖的影响,不仅仅是因为抑制胰岛素的分泌,也有可能是诱导了胰岛素抵抗。有研究证实[5]胰岛素抵抗存在于PTDM患者血糖升高之前,并贯穿全过程。所以,胰岛素抵抗可能是PTDM的始发因素。因为,胰岛素抵抗容易引起胰岛素的积聚,高浓度的胰岛素会降低胰腺β细胞对血糖的敏感性,引起血糖升高。而高血糖会抑制胰腺细胞的增殖,导致胰岛素分泌不足,最终共同引起血糖的升高。所以,FK506可能首先影响的是胰岛素对血糖的调节能力,最终导致血糖变化。
目前,PPAR-γ在脂肪组织的胰岛素抵抗方面起到了重要作用。研究表明[9],PPAR-γ主要与调节脂肪组织脂肪因子分泌有关。脂肪因子是脂肪组织分泌的一类细胞因子,可以直接作用于胰岛素信号通路,调节血糖水平,可以改善胰岛素抵抗。脂肪因子主要包括:脂联素、瘦素、抵抗素、内酯素和RBP4等。其中,脂联素具有增加脂肪酸氧化、提高葡萄糖摄取量、改善胰岛素抵抗和抗炎的作用,具有胰岛素增敏作用。人体实验证明[10]脂联素与机体胰岛素敏感性之间有很强的相关性。瘦素可以抑制下丘脑的进食中枢,减少食物的摄取量,促进能量的消耗。但是,抵抗素、内酯素及RBP4可以抑制细胞对葡萄糖的摄取,诱导高血糖状态及胰岛素抵抗。从本实验也可以看出,空腹血糖较高的 FK506处理大鼠,脂联素及瘦素表达明显降低,而抵抗素、内酯素及RBP4明显升高。同时,又有研究表明PTDM患者血清脂联素低于正常[11],而高水平脂联素对PTDM起到了很好的保护作用。所以,FK506对脂肪因子的调变作用可以影响血糖的变化。
目前,普遍认为脂肪因子的分泌主要与脂肪组织上的PPAR-γ通路有关。激活的PPAR-γ,与维甲酸类受体或糖皮质激素受体形成异二聚体,结合于特异性的DNA序列而使得靶基因激活,从而发挥转录调控脂肪因子分泌的作用。多数文献报道,PPAR-γ激动剂促进脂联素[12]及瘦素分泌[13],抑制抵抗素及内酯素分泌,改善胰岛素抵抗。本实验也发现:FK506处理大鼠PPAR-γ表达量明显降低,同时出现了脂联素、瘦素的表达降低和内酯素、抵抗素的表达明显升高,影响了正常的血糖调节机制,导致FBG明显升高。可以看出,PPAR-γ与脂肪因子的表达有着明显的一致性。FK506可以通过抑制PPAR-γ的表达,影响脂肪因子的分泌,诱导糖耐受损伤。
研究表明,leptin的表达与胰岛素的抵抗呈正向关系[14],高浓度的leptin可能会抑制脂肪细胞PPAR-γ的表达[15-16]。这可能是与岛素的抵抗程度及研究的组织有关系,也说明PPAR-γ及leptin之间存在负反馈调节,具体机制有待进一步研究。
[参 考 文 献]
[1] Montori VM, Basu A, Erwin PJ, et al. Posttransplantation diabetes: a systematic review of the literature[J]. Diabetes Care, 2002, 25(3):583-592.
[2] Roland M, Gatault P, Doute C, et al. Immunosuppressive medications, clinical and metabolic parameters in new-onset diabetes mellitus after kidney transplantation[J]. Transpl Int, 2008, 21(6):523-530.
[3] Chien YS, Chen YT, Chuang CH, et al. Incidence and risk factors of new-onset diabetes mellitus after renal transplantation[J]. Transplant Proc, 2008, 40(7):2409-2411.
[4] Sahay M, Sahay RK, Narayan G, et al. New-onset diabetes after transplantation - Role of oral glucose tolerance test for diagnosis and study of risk factors[J]. Saudi J Kidney Dis Transpl, 2013, 24(5):897-902.
[5] 王 振,石炳毅,郑慧丽,等. 肾移植术后糖尿病的发病机制[J].中国医学科学院学报,2009,31(3):292-295.
[6] Heit JJ, Apelqvist AA, Gu X, et al. Calcineurin/NFAT signalling regulates pancreatic beta-cell growth and function[J]. Nature, 2006, 443(7109):345-349.
[7] Holowachuk EW. Nuclear factor of activated T cell (NFAT) transcription proteins regulate genes involved in adipocyte metabolism and lipolysis[J]. Biochem Biophys Res Commun, 2007, 361(2): 427-432.
[8] Hernandez-Fisac I, Pizarro-Delgado J, Calle C, et al. Tacrolimus-induced diabetes in rats courses with suppressed insulin gene expression in pancreatic islets[J]. Am J Transplant, 2007, 7(11):2455-2462.
[9] Terauchi Y, Kadowaki T. PPAR and diabetes[J]. Nihon Rinsho, 2005, 63(4): 623-629.
[10] Yadav A, Kataria MA, Saini V, et al. Role of leptin and adiponectin in insulin resistance[J]. Clin Chim Acta, 2013, 417:80-84.
[11] Bayes B, Lauzurica R, Granada ML, et al. Adiponectin and risk of new-onset diabetes mellitus after kidney transplantation[J]. Transplantation, 2004, 78(1): 26-30.
[12] Chen L, He T, Han Y, et al. Pentamethylquercetin improves adiponectin expression in differentiated 3T3-L1 cells via a mechanism that implicates PPARgamma together with TNF-alpha and IL-6[J]. Molecules, 2011, 16(7): 5754-5768.
[13] Bastard JP, Hainque B, Dusserre E, et al. Peroxisome proliferator activated receptor-gamma, leptin and tumor necrosis factor-alpha mRNA expression during very low calorie diet in subcutaneous adipose tissue in obese women[J]. Diabetes Metab Res Rev, 1999, 15(2): 92-98.
[14] Silha JV, Krsek M, Skrha JV, et al. Plasma resistin, adiponectin and leptin levels in lean and obese subjects: correlations with insulin resistance[J]. Eur J Endocrinol, 2003, 149(4):331-335.
[15] Rhee SD, Sung YY, Jung WH, et al. Leptin inhibits rosiglitazone-induced adipogenesis in murine primary adipocytes[J]. Mol Cell Endocrinol, 2008, 294(1-2): 61-69.
[16] Cabrero A, Cubero M, Llaverias G, et al. Leptin down-regulates peroxisome proliferator-activated receptor gamma (PPAR-gamma) mRNA levels in primary human monocyte-derived macrophages[J]. Mol Cell Biochem, 2005, 275(1-2):173-179.
