分离提取葛根淀粉生产废水中的葛根素
2014-08-09,*,
,*,
(1 广西产品质量监督检验研究院,南宁 530007; 2 广西大学轻工与食品工程学院,南宁 530004)
葛根素是豆科植物野葛Puerarialobata(Wild.) Ohwi 或甘葛藤PuerariathomsoniiBenth 的干燥根中提取并分离出来的一种单体, 主要成分为4, 7-二羟基8-β-D 葡萄糖异黄酮,可用于治疗高血压、心绞痛、冠心病、脑缺血、脑梗死、视网膜动静脉阻塞、突发性耳聋和糖尿病等症[1~3]。葛粉中由于含有葛根素而具有多种保健功能,被人们称为“长寿粉”。随着将葛粉开发为葛粉粉丝、固体饮料、面条、面包、果冻等中、高档的食品,我国的葛粉加工行业蓬勃发展起来了。但在葛根淀粉工业生产过程中,大量的葛根素随葛粉工业废水废渣流失,造成了资源浪费。当前,关于从葛粉工业废水中回收分离葛根素的成熟工艺未见报道。因此,从生产葛根淀粉废水中回收分离葛根素,对有效利用葛根资源具有现实意义。
1 实验方法
1.1 主要仪器
UV-2802H型紫外可见光分光光度计(尤尼柯仪器有限公司),卷式膜小型试验机(大连屹东膜工程设备公司),通风微孔板分光光度计(基因有限公司)。
1.2 试剂
无水乙醇(分析纯);氢氧化钠(分析纯);36%盐酸(分析纯);BCA Protein Assay Kit(分析纯);亚硫酸铁(分析纯);硫酸铝(分析纯);氯化铁(分析纯);十二水硫酸铝钾(分析纯)。实验所用水均为蒸馏水。PES10-1812型膜(大连屹东膜工程设备公司);大孔树脂(型号有:HPD100、HPD600、HPD722、HPD826、D101;沧州宝恩吸附材料科技有限公司)。
1.3 实验方法
1.3.1 葛根素的测定
葛根淀粉生产工业废水采用添加十二硫酸铝钾作为絮凝剂,其添加量为0.1 g/L时在25℃条件下絮凝30 min去除废水中的蛋白质,以消除蛋白质在葛根素测定时的影响,处理后的废水中葛根素含量的测定参照文献[4]中的紫外检测方法进行。
1.3.2 树脂预处理
HPD系列大孔树脂预处理:将大孔树脂以无水乙醇浸泡4 h后,以蒸馏水冲洗至洗涤液不浑浊且在紫外光谱扫描下无吸收峰检出,处理后将大孔树脂浸泡于蒸馏水中备用。
聚酰胺树脂预处理:将聚酰胺树脂浸泡于95%乙醇中,持续搅拌,并不间断更换乙醇,直至浸泡液不产生白色浑浊;再以蒸馏水冲洗树脂至无乙醇味后,用5%NaOH浸泡2~4 h后,以蒸馏水洗至pH中性;以10% 醋酸水溶液浸泡2~4 h,用蒸馏水洗涤至pH值中性。蒸馏水浸泡保持湿润,备用。
D101、AB-8大孔树脂预处理:用95%乙醇浸泡24 h后,更换乙醇,直至乙醇浸泡液不出现白色浑浊。用蒸馏水洗涤树脂,直至树脂无乙醇味。滤干树脂表面水分后,立即进行酸碱处理。处理步骤为:以5%的HCl 溶液浸泡大孔树脂2~4 h,蒸馏水冲洗至pH值中性;然后以2%的NaOH 溶液浸泡静置2~4 h,蒸馏水冲洗树脂至pH值中性为止。用蒸馏水浸泡大孔树脂保持表面湿润,备用。
2 结果与分析
2.1 大孔树脂的选择实验
2.1.1 葛根素及蛋白质的静态吸附解吸实验
参照文献[5~7]对7种不同型号的大孔树脂
(包括极性、弱极性、非极性大孔树脂)在同等条件下进行吸附解吸实验。称取处理好的大孔树脂约1 g,置100 mL具塞锥形瓶中,加入葛粉工业废水20 mL。在25℃、105 rpm条件下振荡2 h,于1,2,3,4,5,6,7,8 h时分别测定废水中葛根素的含量。参照文献[5~7]计算树脂的葛根素吸附量,绘制各大孔树脂的葛根素静态吸附曲线如图1所示(测试废水中葛根素含量为760.88 mg/L,蛋白质含量为1 609.19 mg/L)。

图1 大孔树脂的静态吸附量与解吸率
从图1可知,与极性树脂相比较,弱极性及非极性树脂如AB-8、HPD722等的葛根素、蛋白质吸附量与解吸率比较高,是对葛根素吸附效果较好的大孔树脂,蛋白质的吸附效果亦好,而蛋白质的饱和吸附量比葛根素的吸附量要大。由图知,AB-8大孔树脂的葛根素解吸率最高,达到了95.50%,D101及HPD722的葛根素解吸率次之,分别为91.37%、88.80%;尽管HPD600的葛根素吸附量最大,其解吸率却不高,仅为76.64%,远远低于AB-8的葛根素解吸率。HPD600的葛根素吸附量虽然大,但其解吸率偏低,应用于工业生产中时,易造成较多的葛根素被吸附在树脂上无法被洗脱下来,若周期性使用,则会导致树脂的吸附能力下降,回收分离效果受影响。HPD722的蛋白质解吸率为86.33%,达到几种树脂的最大值,而D101及HPD826的蛋白质解吸率略低,分别为85.51%与80.97%。AB-8的蛋白质解吸率较低,仅为75.55%。综合葛根素及蛋白质的饱和吸附量、解吸率进行选择,弱极性大孔树脂AB-8及HPD722是较为理想的树脂。
2.1.2 葛根素静态吸附曲线
在使用大孔树脂对葛粉废水中的葛根素进行吸附时,大孔树脂的吸附速率也是一个重要的指标。各型号树脂的葛根素静态吸附曲线参照文献[5~7]绘制如图2所示。
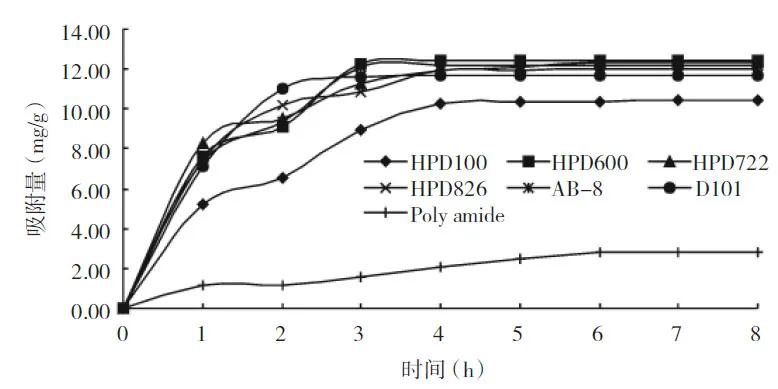
图2 25℃时大孔树脂的葛根素静态吸附曲线
快速吸附的大孔树脂可缩短吸附时间,而吸附较慢的大孔树脂则可能会延长整个吸附解吸过程。由图2可看出,在吸附开始的3 h内,各型号大孔树脂的葛根素吸附量均呈较快的上升。在此之后,部分树脂已经达到吸附饱和,因而曲线趋于平缓。最快达到吸附饱和的是D101、AB-8及HPD600树脂,其平衡时间约为3 h,属于快速饱和类型。前3 h树脂的葛根素吸附速率较快,原因在于葛粉工业废水中葛根素在树脂中的快速扩散,3 h后,吸附速率减缓,主要是由于废水中大量存在的其他物质与葛根素产生竞争性吸附作用及大孔树脂内部产生的传送阻力[8]。HPD600大孔树脂的吸附效率快,葛根素的饱和吸附量高(为12.50 mg/g干树脂),但其葛根素的解吸率低(仅为76.64%);D101大孔树脂的吸附速率也较快,但其饱和吸附量小于AB-8大孔树脂,因而这两种大孔树脂的吸附效果稍逊。HPD722的吸附速率虽略慢于AB-8,约5 h才达到饱和,但其葛根素吸附解吸效果较好(饱和吸附量12.36 mg/g干树脂,解吸率为88.80%),因而综合考虑,选择AB-8及HPD722较为合适。
2.2 大孔树脂动态吸附解吸实验
2.2.1 洗脱剂的优化选择
在利用大孔树脂分离纯化时,选择适宜的洗脱剂对洗脱效果较为重要。由于葛根素结构中有一个非极性黄酮母核,因而弱极性大孔树脂对葛根素具有较好的吸附效果。参考文献[9,10],本实验选择乙醇水为洗涤剂,不同体积分数的乙醇对AB-8、HPD722两种树脂解吸效果如图3所示。
由图3可知,随着乙醇体积分数的增加,AB-8大孔树脂的葛根素的解吸率总体呈上升趋势。乙醇的体积分数越小,极性越大,越不利于解吸。当用80%乙醇作为洗脱剂,葛根素和蛋白质的解吸率之间相差最为明显,此时葛根素解吸率达到最大而蛋白质的解吸率较小,二者相差约为22%。
与AB-8树脂相类似,随着洗脱剂中乙醇的增加,HPD722大孔树脂的葛根素的解吸率逐渐增大。在葛根素解吸率最大的80%乙醇处,蛋白质的解吸率也达到最大值,为89.98%,二者间无明显差距,因而无法达到对葛粉废水中葛根素与蛋白质的差异性解吸的目的。

图3 不同体积分数乙醇的葛根素及蛋白质解吸率(上图为AB-8树脂,下图为HPD722树脂)
实验结果显示,80%乙醇对葛根素的解吸效果最好;AB-8树脂可对废水中的葛根素及蛋白质起到较好的差异性解吸作用,在最大限度地解吸葛根素的同时,可较少解吸蛋白质。因而AB-8可作为适宜树脂。
2.2.2 不同pH值洗脱剂对树脂解吸的影响
通过调节乙醇溶液的pH值,可更好起到葛根素与蛋白质间的差异解吸效果。选择AB-8作为实验树脂,在乙醇体积分数相同的实验条件下,考察在酸性条件下,不同pH值的80%乙醇溶液对葛根素的解吸效果。结果如图4所示。

图4 不同pH值下80%乙醇的葛根素及蛋白质解吸率
图4显示了pH值对葛根素与蛋白质解吸效果的影响。随着pH值的变化,葛根素的解吸率变化不大,其值均在90%以上,当pH值为5.5与7.0时,解吸率分别为98.25%、99.06%,均较高;而蛋白质的解吸率随pH值的不同,出现较大的波动。当pH值为5.5时,蛋白质的解吸率最小,为66.17%。pH5.5时,蛋白质的解吸率出现最低值,原因可能在于此时洗脱剂与蛋白质分子结构间的极性作用。
综合考虑,当pH值为5.5时,葛根素的解吸率为98.25%,而蛋白质的解吸率达到最低,为66.17%,此时二者相差最大,差异为32.08%,可达到二者的有效分离。因而选择pH5.5作为洗脱剂的最佳pH值。
2.2.3 泄露曲线
采用动态上样的方式,设定上样流速为10 BV/h,使葛粉工业废水基本保持匀速通过大孔树脂,当流出液中葛根素浓度为葛粉工业废水中葛根素浓度的1/10时,停止上样,确定此时为泄露点。泄露曲线如图5所示。

图5 葛根素泄露曲线
由图5可知,随着葛粉工业废水上样量的增加,流经树脂的流出液中葛根素逐渐增加;但在30倍柱体积的范围内,曲线的上升趋势不明显,较为平缓。当上样量达到28倍柱体积时,流出液中的葛根素浓度为18.20 mg/L,而葛粉工业废水中的葛根素浓度为188.29 mg/L,此时流出液中的葛根素浓度接近葛粉工业废水中葛根素浓度的1/10;当上样量为30倍柱体积时,流出液中的葛根素浓度开始出现较大的升高,达到31.16 mg/L,大于葛粉工业废水中葛根素浓度的1/10(18.29 mg/L),此时到达泄露点,树脂吸附达到饱和,大量的葛根素得不到有效吸附而直接随流出液流出。为了合理利用废水,减少不必要的浪费,确定30倍柱体积为最大上样量。
2.3 葛根素动态洗脱曲线
选择pH5.5的80%乙醇对吸附饱和的AB-8树脂柱进行洗脱,绘制葛根素及蛋白质的动态洗脱曲线,以确定葛根素的洗脱峰及应收集哪一阶段的洗脱液。二者的动态洗脱曲线如图6所示。
由图6可看出,使用pH值5.5的80%乙醇作为洗脱剂进行洗脱,得到的葛根素洗脱峰及蛋白质洗脱峰均单一、尖锐,无明显的拖尾现象。从开始进行洗脱算起,葛根素峰型最高点为1.7 BV处,而蛋白质洗脱峰的最高点在1.3 BV处,二者间有相对较远的距离,因而可通过收集1.6至2.0 BV段的洗脱液,达到保留葛根素目的的同时尽可能去除废水中的蛋白质干扰。当洗脱总体积为4.0 BV时,葛根素及蛋白质均可被完全洗脱下来。

图6 葛根素及蛋白质的动态洗脱曲线
2.4 洗脱速率的确定
在相同的树脂类型、洗脱剂条件下,分别以1.0、2.0、3.0 BV/h的洗脱速率进行洗脱。为保证树脂吸附的量一致,将预处理后的大孔树脂浸泡于葛粉工业废水中,间歇震荡3 h吸附饱和后,湿法上柱。葛粉工业废水中葛根素浓度为115.47 mg/L,每一根大孔树脂柱(体积为50 mL)消耗的葛粉工业废水为1 000 mL。依照洗脱曲线,收集葛根素含量高的洗脱液,60℃浓缩干燥后,计算洗脱物中葛根素的纯度及回收率。不同洗脱速率的动态洗脱曲线见图7,各洗脱速率的洗脱物中,葛根素的纯度及回收率见表1。
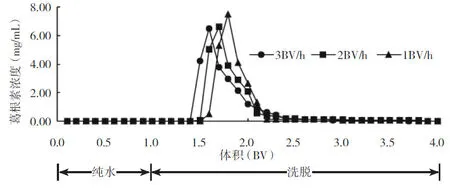
图7 不同洗脱速率下葛根素的动态洗脱曲线

表1 不同洗脱速率下葛根素的纯度及回收率
由图7可知,不同的洗脱速率对出峰时间的影响并不大,3个设定的洗脱速率下的葛根素洗脱峰峰型相似,且较尖锐、单一,并且洗脱的速率越低,洗脱效果越好。当洗脱速率为1.0 BV/h时,葛根素的纯度及回收率分别为55.02%、90.11%,此时葛根素洗脱效率最高,但洗脱流速较慢;而当洗脱速率达到3.0 BV/h时,其葛根素的纯度及回收率有所下降,分别为50.15%、84.53%,洗脱峰的峰型出现拖尾现象。综合考虑理论及工厂生产需要,最终确定洗脱速率为2.0 BV/h,收集0.5倍柱体积(第1.6 BV至2.0 BV)的洗脱液,离心去除絮凝后60℃热风干燥至恒重,测得其葛根素的纯度为53.97%,回收率为89.24%。
2.5 洗脱周期确定
通过反复的吸附洗脱,确定大孔树脂的使用周期。以葛根素的浓度为188.29 mg/L的废水为例。参照2.2.4泄露曲线绘制,以上样量和流出液中葛根素的含量为纵横坐标做出5次洗脱结果曲线图,如图8所示。

图8 洗脱周期实验结果
随着实验周期的增加,树脂的泄露点前移,意味着其吸附饱和量逐渐下降。在前三个实验周期,曲线的泄露点前移幅度不明显;当洗脱实验进行至第四个周期,泄露曲线的变化趋势趋于明显,上样量开始出现明显的降低;而在第五个周期,当废水的上样量为22倍柱体积时,泄露曲线出现明显上升,流出液中的葛根素含量快速升高,此时发生泄露,树脂吸附饱和。因而推断,当洗脱进行至第五个周期时,树脂的吸附能力出现显著下降。
3 讨论与小结
葛根淀粉废水成分复杂,富含有机物,其中蛋白质含量较为丰富。采用添加十二硫酸铝钾法去除蛋白质的方法具有操作简便,所需设备简单,处理成本低廉等优点,是当前葛根淀粉废水处理的好方法;通过大孔树脂选型实验,得到了最适型号的树脂(AB-8大孔树脂),同时对大孔树脂洗脱的参数进行了一系列摸索及探究,得到了最佳的洗脱条件。以pH5.5的80%乙醇作为洗脱剂,洗脱流速为2.0 BV/h,利用AB-8大孔树脂对葛粉工业废水中的葛根素进行回收分离,得到的洗脱物中,葛根素含量达50%以上,回收率高达85%。当前葛粉工厂每生产1 t葛根淀粉时产生10 t葛粉工业废水,以葛粉工业废水中的葛根素含量为200 mg/L计算,利用大孔树脂可回收约0.85 kg的葛根素。一般偏小规模的葛粉工厂每日可生产葛根淀粉7~8 t,若使用大孔树脂对葛粉工业废水中的葛根素进行富集回收,每日可回收的葛根素约为6.0 kg。这表明利用树脂分离提纯葛根素具有广阔的工业应用前景。
[1] 金玉婷,石森林.葛根素新剂型的研究进展[J]. 中国医院药学杂志,2010(12): 65-67.
[2] 覃开羽,吴 敏.葛根素的药理作用及不良反应分析[J].中国药业,2007,16(3):61-62.
[3] 张妤琳,梁敬钰.葛根素的研究进展[J]. 海峡药学,2005,27(1): 9-12.
[4] 张建辉,杨代明,吴廷瑞,等. HPLC法和紫外分光光度法测定葛根淀粉中葛根素含量的研究[J]. 食品与机械,2006,22(6):110-113.
[5] Liu YF, Liu JX, Chen XF, et al. Preparative separation and purification of lycopene from tomato skins extracts by macroporous adsorption resins[J]. Food Chemistry, 2010, 123: 1027-1034.
[6] Zhou JC, Feng DW, Zheng GS. Extraction of sesamin from sesame oil using macroporous resin[J]. Journal of Food Engineering, 2010, 100: 289-293.
[7] Fua BQ, Liu J, Li H, et al. The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid[J]. Journal of Chromatography A, 2005, 1089(1/2): 18-24.
[8] Gao M, Huang W, Liu CZ. Separation of scutellarin from crude extracts ofErigeronbreviscapus(vant.) Hand. Mazz. by macroporous resins[J]. Journal of Chromatography B, 2007, 858(1/2): 22-26.
[9] 葛淑兰, 陈龙华, 李中文. 大孔吸附树脂及其在黄酮类成分分离纯化中的应用进展[J]. 中国药师, 2008, 11(6): 702-705.
[10]易海燕, 何桂霞, 欧阳文, 等. 大孔吸附树脂分离纯化藤茶总黄酮的研究[J]. 中草药, 2011, 42(1): 74-77.
