活体成像观察Ascl2-RNAi对结肠癌HT-29细胞裸鼠移植瘤生长的影响
2014-08-09方兴国狄连君陈小燕
朱 蓉,赵 逵,方兴国,狄连君,陈小燕
(遵义医学院附属医院 消化内科, 贵州 遵义 563099)
Achaete scute-like 2 (Ascl2)是一个与肠干细胞相关的重要转录因子,是Wnt信号途径的靶分子之一[1],目前研究发现,Ascl2不仅控制成体肠干细胞的“命运”[2]:在小鼠肠上皮中转基因过表达Ascl2出现肠隐窝过度增生和肠绒毛异位隐窝出现,在成体小鼠肠道诱导Ascl2基因表达缺失导致Lgr5阳性的成体肠隐窝干细胞在数天后消失;而且,Ascl2还与结肠癌相关,其调控结肠癌干细胞“干性”[3-4]。本研究通过成功构建Ascl2的RNAi质粒,转染人结肠癌HT-29细胞,通过G418筛选、挑取克隆并扩增培养形成稳定转染的细胞系,再将该细胞移植到裸鼠皮下,并采用小动物活体成像仪观察Ascl2干扰前后HT-29细胞的致瘤能力,以探讨Ascl2-RNAi对结肠癌HT-29细胞体内生长增殖的影响。
1 材料与方法
1.1 材料与仪器 人结肠癌HT-29细胞株购自中科院上海细胞库(该细胞株引自ATCC); 胎牛血清购自Hyclone公司;Macoy’s 5A培养基购自Sigma公司; LipofectamineTM2000购自Invitrogen公司;抗Ascl2单克隆抗体购自Millipore公司;激光共聚焦扫描显微镜购自德国 Carl Zeiss公司;流式细胞仪购自美国BD 公司;小动物活体成像仪Maestro EX2.10(第三军医大学烧伤研究所)购自美国CRI。
1.2 细胞培养、质粒构建以及稳定转染细胞系的建立
1.2.1 细胞的传代培养 人结肠癌细胞株HT-29培养于含10%胎牛血清的McCoy’s 5A完全培养液中,置于37℃,5% CO2的培养箱中,每2~3天换液1次,细胞生长融合至70%~80%,用0.25%胰蛋白酶和0.02% EDTA混合液进行消化,传代培养。
1.2.2 质粒构建与测序 对照质粒shRNA-control/EGFP以及shRNA-Ascl2/EGFP质粒均由武汉市晶赛生物工程有限公司合成,经文献查得Ascl2干扰片段的序列为CCGCGTGAAGCTGGTGAAC[2 ],由此设计合成的DNA模板引物为:
5’-CACCGCCGCGTGAAGCTGGTGAACTTCAAGACGGTTCACCAGCTTCACGCGGTTTTTTG-3',
5’-AGCTCAAAAAACCGCGTGAAGCTGGTGAACCGTCTTGAAGTTCACCAGCTTCACGCGGC-3'.
将合成的片段进行测序验证,结果表明构建的Ascl2干扰质粒目的片段与预期序列完全相符。
1.2.3 Ascl2-RNAi质粒转染HT-29细胞 取对数生长期的HT-29细胞接种于24孔板中,细胞生长至50%~60%融合时,按LipofectamineTM2 000转染试剂盒说明书进行转染,将2 μL shRNA-Ascl2/EGFP质粒溶液加入到37 ℃预热的无血清无双抗培养基48 μL,共50 μL,室温孵育5 min;将2 μL LipofectamineTM2000试剂加入到37 ℃预热的无血清无双抗培养基48 μL,共50 μL,室温孵育5 min;将2种溶液轻轻混匀,室温孵育20 min,加入24孔板中,100 μL/孔,轻轻摇动孔板混匀,放入孵箱继续培养4~6 h后,更换为新鲜的完全培养液,培养48 h后采用激光共聚焦显微镜观察绿色荧光的表达情况。
1.2.4 G418抗性筛选,克隆挑取及扩增培养 HT-29细胞转染48 h后,加入筛选浓度的G418筛选培养基(G418筛选浓度为800 μg/mL),每隔3~5 d换液1次。当非荧光细胞几乎被完全杀死时,降低G418浓度,采用维持浓度(G418维持浓度为400 μg/mL) 维持细胞的筛选。3~4周后可见培养板底有细胞克隆形成,进一步采用激光共聚焦显微镜观察所形成的细胞克隆绿色荧光的表达情况,并作好标记,将标记好的阳性克隆用100 μL枪头进行挑取,移至加有1 mL完全培养液的24孔板中,加入维持浓度的G418,继续培养,激光共聚焦镜观察培养的细胞绿色荧光表达情况,继续扩增,消化、传代培养,冻存,分别建立shRNA-Ascl2/HT-29和shRNA-control/HT-29两个稳定转染的细胞系。
1.3 流式细胞仪检测GFP阳性细胞比例 常规消化、离心细胞,用流式缓冲液混悬细胞为单细胞悬液,进行流式细胞仪检测,以未转染的细胞作为GFP阴性对照。
1.4 western-blot检测Ascl2的干扰效果 裂解细胞、收集蛋白质标本,配胶、上样、垂直电泳,制作“三文治”结构、电转,封闭、洗膜,加一抗(抗Ascl2单克隆抗体 1:1000),洗膜、加二抗,曝光(根据效果调整时间),凝胶成像系统分析结果。
1.5 小动物活体成像仪观察Ascl2-RNAi对HT-29细胞裸鼠移植瘤生长的影响 4~6周龄的BALB/c裸鼠6只用于成瘤实验。常规消化、离心细胞,用生理盐水混悬细胞为单细胞悬液,计数板反复多次计数后,以1×106细胞(体积:100 μL)接种于裸鼠的背部皮下,左右均接种1×106细胞,左侧为干扰质粒转染的细胞,右侧为对照质粒转染的细胞。每日观察裸鼠的状态、瘤子的生长状况,并记录瘤子的长、短径。第20天时,对裸鼠进行麻醉、小动物活体成像仪观察拍照,处死裸鼠,解剖出瘤子后测量大小、称取重量,并做好记录。

2 结果
2.1 激光共聚焦显微镜观察Ascl2干扰质粒转染结肠癌HT-29细胞 激光共聚焦显微镜观察显示,Ascl2对照和干扰质粒(shRNA-control/EGFP和shRNA-Ascl2/EGFP)转染HT-29细胞48 h(见图1 A~C),其转染效率均低于20%,进行G418筛选3~4周后,形成稳定转染的细胞克隆(见图1 D~F),进一步消化、传代,扩增培养(见图1 G~I),分别建立稳定转染的结肠癌细胞系,并命名为shRNA-Ctr/HT-29(shRNA-control/HT-29)和shRNA-Ascl2/HT-29细胞。

注:A~C为瞬时转染48 h,D~F为稳定转染克隆,G~I为扩增培养的稳定转染细胞。图1 Ascl2干扰质粒转染HT-29细胞情况
2.2 流式细胞仪检测GFP阳性HT-29细胞比例 流式细胞仪检测结果表明,质粒转染、经G418筛选出来的稳定转染细胞克隆经传代、扩增培养,检测GFP阳性细胞比例达90%以上(见图2 )。

注:A:阴性对照细胞GFP阳性比例;B:Ascl2干扰质粒转染后细胞GFP阳性比例。图2 流式细胞仪检测GFP阳性细胞比例
2.3 western-blot检测Ascl2质粒的干扰效果 对HT-29、shRNA-Ctr/HT-29和shRNA-Ascl2/HT-29细胞进行Ascl2蛋白质表达水平的检测,western-blot结果显示,干扰后细胞中Ascl2蛋白质表达明显下调(见图3 )。
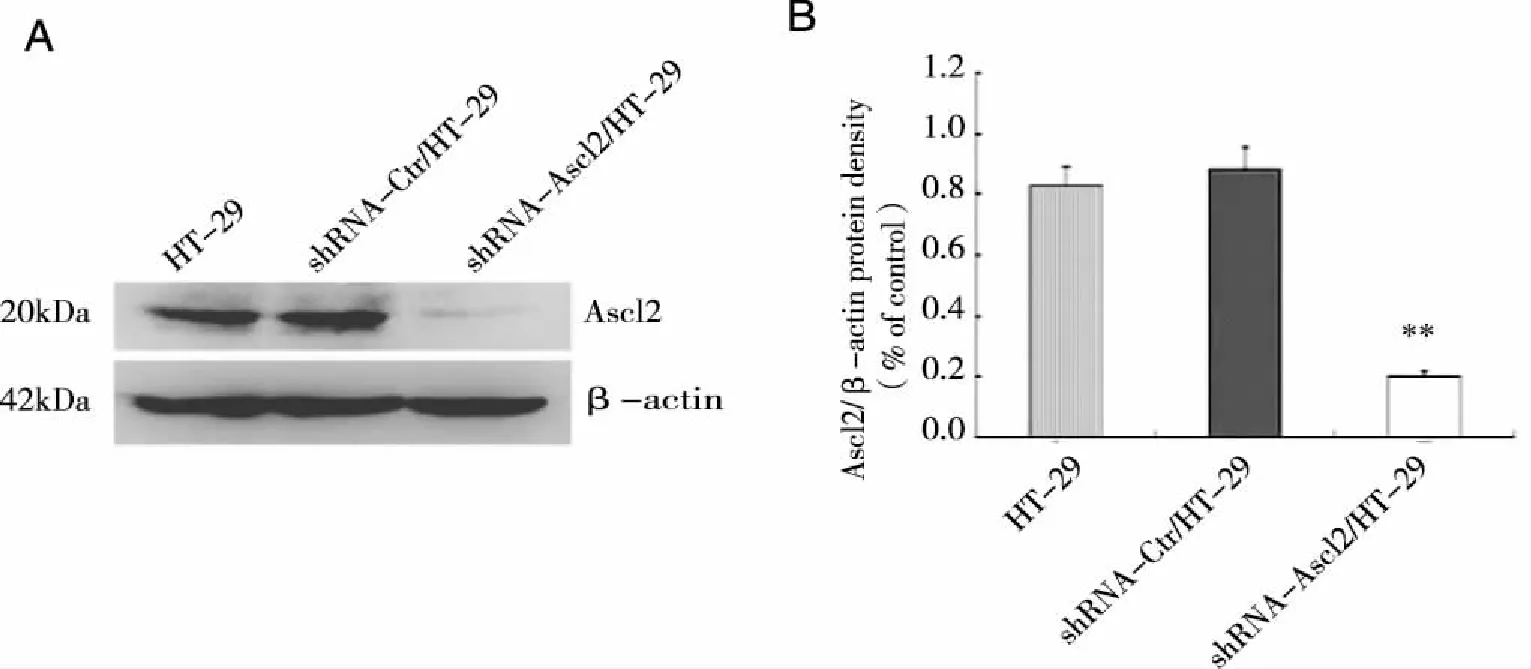
注:A为western-blot检测HT-29、shRNA-Ctr/HT-29、shRNA-Ascl2/HT-29细胞中Ascl2蛋白质表达条带,B为蛋白表达统计柱状图(**P<0.01 )。图3 Ascl2干扰效果的检测
2.4 小动物活体成像观察Ascl2-RNAi对HT-29细胞裸鼠移植瘤生长的抑制作用 为了观察干扰Ascl2对HT-29细胞裸鼠致瘤能力的影响,转染Ascl2干扰质粒和对照质粒细胞分别以1×106/只注射于裸鼠左侧和右侧背部皮下,每间隔5 d测量1次瘤体积,20 d后,所有的裸鼠均致瘤,麻醉后采用小动物活体成像仪观察shRNA-Ctr/HT-29和shRNA-Ascl2/HT-29细胞裸鼠皮下致瘤情况,结果发现Ascl2干扰后的HT-29细胞致瘤能力明显减弱(见图4A)。脱颈法处死裸鼠,测量瘤体积,取出瘤子称量瘤质量。转染干扰质粒的HT-29细胞所致肿瘤体积和质量均小于转染对照质粒的HT-29细胞所致肿瘤体积和质量(见图4B、C)。
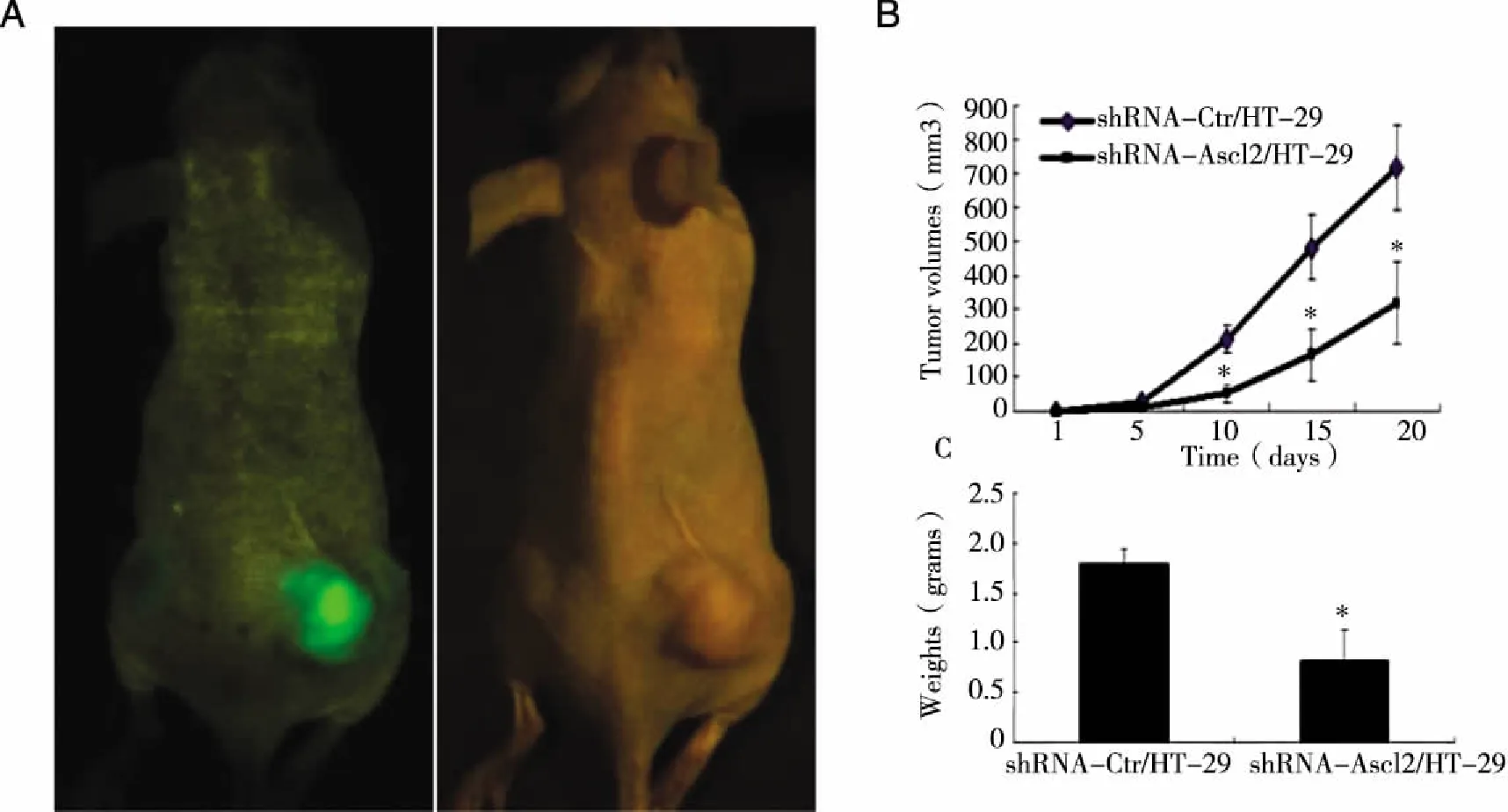
注:A:小动物活体成像仪观察裸鼠移植瘤的生长情况,左侧:Ascl2干扰质粒转染的HT-29细胞致瘤,右侧:对照质粒转染的HT-29细胞致瘤;B:裸鼠移植瘤体积生长情况;C:移植瘤质量比较柱状图(*P<0.05)。图4 Ascl2-RNAi对HT-29细胞裸鼠移植瘤生长的抑制作用
3 讨论
结肠癌是人类消化道最常见的恶性肿瘤之一,其发病率呈上升趋势。中晚期结肠癌治疗困难、疗效差,目前尽管强调综合性、个体化治疗,但终不能解决根本问题。经过国内外研究者的努力,提出了肿瘤干细胞这一全新的理论,该理论认为肿瘤干细胞才是肿瘤生长、复发和转移的根源。而以肿瘤干细胞为治疗靶点,才能从根本上根除肿瘤、防止其复发和转移,而不仅仅是以减小肿瘤体积为治疗目标[5]。Ascl2是一个可能与结肠癌干细胞“干性”密切相关的碱性/螺旋-环-螺旋转录因子[4],深入研究其对结肠癌生长的影响及机制,可能为将Ascl2作为结肠癌治疗的新靶点提供理论依据。
本实验采用RNAi技术对体外培养的人结肠癌HT-29细胞进行研究,成功构建了Ascl2 的RNAi质粒,并对HT-29细胞进行瞬时转染,然后G418筛选,形成稳定的克隆后进行挑选并扩增培养形成稳定转染的HT-29细胞系,确定干扰效果后对裸鼠进行皮下移植瘤实验,采用小动物活体成像技术观察移植瘤的荧光表达情况和瘤体生长情况,结果发现,HT-29细胞经Ascl2干扰后,皮下移植瘤的生长能力明显减弱,说明Ascl2与结肠癌的生长密切相关,结合文献报道,Ascl2可能成为一个结肠癌治疗的新靶点,且Ascl2表达局限,研究报道其表达仅限于肠道隐窝基底的Lgr5阳性的肠成体干细胞以及胎盘[2],该转录因子作为结肠癌治疗的新靶点可能具有靶向性好和副作用小等更多的优势。
小动物活体成像仪能够直观的观察到瘤体绿色荧光表达情况,并可以在整个过程中动态观察,可以作为一种很好的研究手段用于活体小动物体内肿瘤的生长及转移研究[6]。小动物活体成像技术机理是:通过活体肿瘤、细胞或基因的生物发光以及荧光标记,采用制冷CCD(高灵敏度)配合特制的成像暗箱,再用图像软件进行处理,从而直观观测活体小动物体内肿瘤的生长、迁移、转移扩散,以及细胞活动,甚至可以观测特定基因的表达,还可通过标记细菌或病毒从而观测感染性疾病的发展等生物学过程[6-7]。该技术观察灵敏度高、结果直观,可以进行实时观测、动态观察和定量评估,操作简单、安全,不涉及反(放)射性物质,且实验成本低。因此,目前小动物活体成像技术在国内外得到越来越多的应用,也极大地促进了生命科学特别是肿瘤研究的发展[8-12],该技术值得推广。
本实验在整个过程中观察到绿色荧光表达没有衰减,说明质粒转染的成功以及质粒转染具有一定的时效性,短时间内不会衰减,可以作为一种很好的经济的研究手段,而不是一定要进行慢病毒转染等较高费用的研究。我们作为西部地区的科研单位,采用这种经济实用的研究手段,争取能为医学事业和整个人类的健康做出更大的贡献。
[参考文献]
[1] Jubb A M,Chalasani S, Frantz GD, et al. Achaete-scute like 2(ascl2) is a target of Wnt signaling and is upregulated in intestinal neoplasia[J]. Oncogene, 2006,25(24):3445-3457.
[2] van der Flier L G,van Gijn M E,Hatzis P, et al.Transcription factor achaete scute-like 2 controls intestinal stem cell fate[J]. Cell, 2009,136(5):903-912.
[3] Jubb A M, Hoeflich K P, Haverty P M, et al. Ascl2 and 11p15.5 amplification in colorectal cancer[J]. Gut, 2011,60(11):1606-1607.
[4] Rong Zhu, Yongtao Yang, Yin Tian, et al. Ascl2 knockdown results in tumor growth arrest by miRNA-302b-related inhibition of colon cancer progenitor cells[J]. PLoS one, 2012,7(2):e32170.
[5] Clevers H. The cancer stem cell: premises, promises and challenges[J]. Nat Med, 2011,17(3):313-319.
[6] 朱淼鑫,姚明. 小动物活体成像技术的应用[J]. 中国比较医学杂志, 2011,21 (3):1-5.
[7] 李珂,赵光. 小动物活体成像技术的应用进展[J]. 实用医药杂志, 2012,29 (1):81-82.
[8] 王豫,关华,宋曼,等. 小动物生物发光活体成像的条件优化与技术扩展研究[J]. 军事医学,2013,37 (4):271-273.
[9] 范临兰,席晓霞,魏虎来,等. 应用活体成像技术对三氧化二砷抗小鼠4T1乳腺癌作用的研究[J]. 中国兽医科学, 2013,43(2):170-176.
[10] 张绘宇, 郑国兵, 张金栋, 等. 利用荧光素酶标记的肿瘤细胞建立活体成像动物模型[J]. 中国体视学与图像分析, 2013,18(1):67-72.
[11] 倪庆纯,韩重,杨威,等.利用小动物活体成像技术快速评价药物的抗肿瘤作用研究[J]. 今日药学,2012,22 (6):321-323.
[12] 刘霞,闫美娜,王荟,等. mLumin 转染人肝癌HepG2 细胞系的建立[J]. 江苏大学学报, 2011,21(4):322-325.
