节球藻毒素研究进展
2014-08-08江敏,许慧
江 敏,许 慧
(1. 上海市水产养殖工程技术研究中心, 上海 201306; 2. 上海海洋大学水产与生命学院,上海 201306)
节球藻毒素研究进展
江 敏1,*,许 慧2
(1. 上海市水产养殖工程技术研究中心, 上海 201306; 2. 上海海洋大学水产与生命学院,上海 201306)
节球藻毒素(Nodularin)是由泡沫节球藻(Nodulariaspumigena)产生的一种环状五肽肝毒素。节球藻毒素对陆生动物和人体均具有毒性和致癌作用,还会影响水生生态系统的结构和功能,对许多陆生植物、水生动物的生长繁殖具有一定的威胁,受到了社会的广泛关注。综述了节球藻毒素的分子结构、检测方法和产生途径,深入讨论了节球藻毒素的环境归趋和毒性效应的研究进展,并对其重要的研究领域提出进一步的展望。
节球藻毒素;肝毒素;毒性;致癌作用;环境归趋;降解
随着人们生活水平的提高和工农业活动的发展,水体富营养化现象日趋普遍,藻华事件不断涌现,有毒藻类及其引发的健康问题正日益引起人们的关注。一些蓝藻,因其可产生对人类、动物、植物和真核微生物等具有不利影响的低分子量化合物,即藻毒素,从而成为科学家和大众关注的焦点[1]。蓝藻产生的毒素主要有微囊藻毒素(Microcystins)、节球藻毒素(Nodularins,简称NOD)、柱胞藻毒素(Cylindrospermospins)、鱼腥藻毒素-α(Anatoxin-α)、同源鱼腥藻毒素-α(Homoanatoxin-α)和麻痹性贝类毒素(Saxtoxins)等,这些毒素按照其结构和毒性分为肝毒素、神经毒素和其他毒素等。其中微囊藻毒素和节球藻毒素属于肝毒素,其主要靶器官为肝脏。微囊藻毒素是由微囊藻产生的对蛋白磷酸酶PP1和PP2A具有抑制性的环状七肽,目前已知的种类有90多种。节球藻毒素主要由泡沫节球藻(Nodulariaspumigena)产生,其结构与微囊藻毒素类似,是一种环状五肽结构,抑制蛋白磷酸酶PP1和PP2A的活性。早在1878年,Nature首次报道了澳大利亚有毒蓝藻泡沫节球藻水华事件[2],引发世界注目。本文就节球藻毒素的结构、检测方法、产生及去除和毒性效应进行的概括,并对其今后的研究方向进行了展望。
1 节球藻毒素的分子结构
节球藻毒素为环状五肽肝毒素,一般结构为(-D-MeAsp-L-Y-Adda-D-Glu-Mdhb),节球藻毒素的分子结构比微囊藻毒素少两个氨基酸,并且在节球藻毒素-R中,其结构L-Y一般代表的是L-精氨酸(L-Arg)[3]。分子结构如图1所示,图中D-MeAsp代表D-甲基天冬氨酸;Mdhb为N-脱氢-α-氨基丁酸;其中Adda为一种特殊的β-氨基酸(3-氨基-9-甲氧基-2, 6, 8-三甲-10-苯基-4, 6-癸二烯酸),是所有已知的蓝藻肝毒素的共同结构[4]。
肝毒素的共同结构Adda的氨基酸本身无毒,这可能是由于游离的Adda不能到达细胞的作用部位或者不能与相应的靶细胞相互作用所致,但其立体结构是肝毒素活性和毒性作用所必需的,其毒性可能与Adda和L-精氨酸之间的空间关系有关[5]。
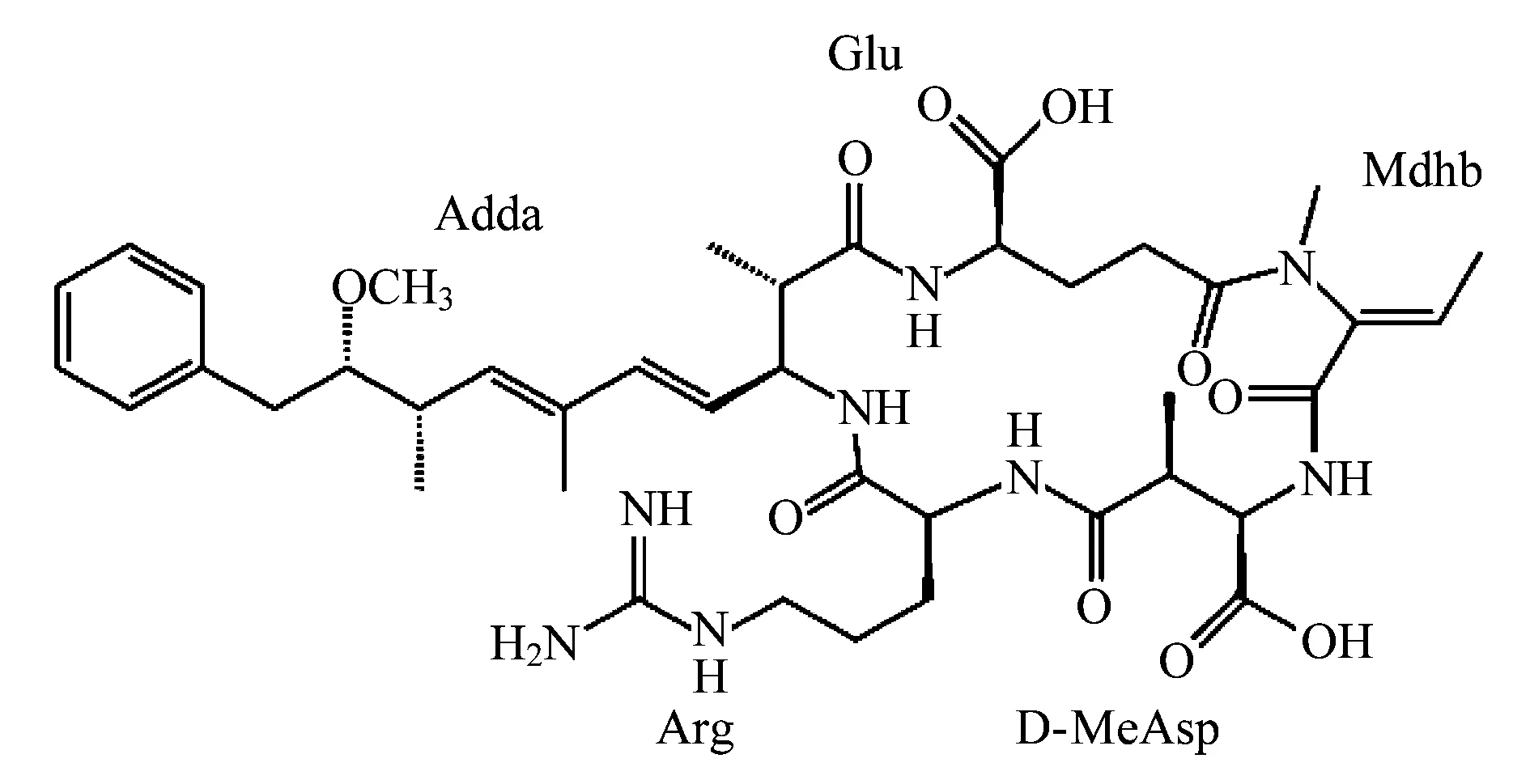
图1 节球藻毒素的分子结构Fig.1 The molecular structure of nodularins
2 节球藻毒素的检测方法
传统的节球藻毒素检测方法有高效液相色谱法、薄层层析法、酶联免疫分析(ELISA)法以及蛋白磷酸酶抑制分析(PPIA)法等。近年来也涌现出一些新型检测方法,如放射性标记法、单克隆抗体法等(表1)。
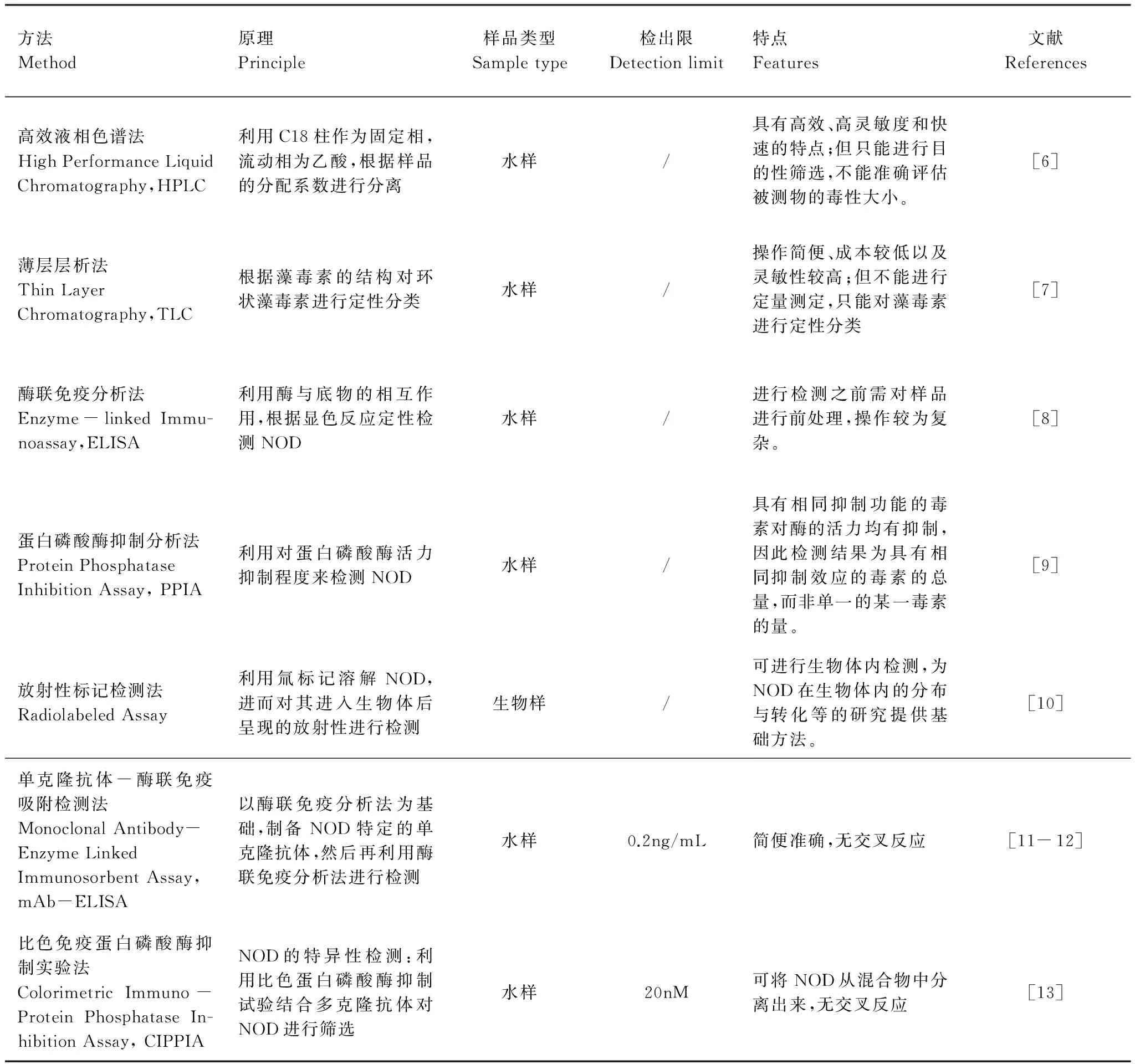
表1 节球藻毒素的检测方法
3 节球藻毒素的产生和环境归趋
3.1 节球藻毒素的产生
节球藻毒素主要由泡沫节球藻分泌产生。Michelle等在2001年的研究中,利用特异性引物简并PCR技术检测出节球藻菌株中含有多肽合成酶基因和聚酮合成酶基因,证实了节球藻毒素的合成与微囊藻毒素类似,均非核糖体合成,而是通过含有不同分子量酶的多酶复合物合成[14]。
3.2 节球藻毒素的环境归趋
微囊藻毒素在水生态系统中的环境归趋包含以下内容:藻细胞中毒素的释放及水柱中溶解态毒素的形成;底泥沉积物吸附及降解;微囊藻毒素的光降解;微囊藻毒素的生物降解;微囊藻毒素在水生生物体内的积累及代谢[15]。本文将NOD的环境归趋分为三部分:NOD的释放、其在环境中的降解、以及NOD在水生生物体内的积累和代谢。
3.2.1 节球藻毒素的释放
藻体内NOD的积累和释放受到多重环境因子的影响。2010年Bagmi Pattanaik等研究了光合有效辐射、紫外照射和营养条件等对节球藻毒素积累和释放的影响,结果显示:当磷限制时,细胞内NOD的浓度达到最低;当进行紫外照射且处于氮限制条件时,细胞内和细胞外NOD的浓度达到最高[16]。
Jaana Lehtimaki等人对波罗的海中泡沫节球藻细胞内NOD的积累以及细胞外NOD的浓度变化进行了研究,发现当环境条件有利于泡沫节球藻生长时,细胞内NOD含量就会增加,即其含量会随环境温度、光照和磷含量的增加而增大,但会随氮浓度的升高而减少;细胞外NOD浓度则在藻细胞裂解时开始增加[17]。
3.2.2 节球藻毒素的降解
国内外关于微囊藻毒素降解与处理方法的研究很多,但对于节球藻毒素降解的研究报道则相对较少,其方法大致包括物理降解、化学降解、生物降解等,而生物降解(酶降解)是其中最主要的途径。
(1) NOD的物理降解
①NOD的光降解
在自然环境条件下NOD可发生光降解,但其降解程度会随光照方式的不同而呈现差异性。1997年,Hayley Twist等人研究了纯化的NOD、毒素粗提取物、以及泡沫节球藻分泌的毒素在3种不同的光照环境,即持续黑暗、持续光照、以及不含紫外波长的光照条件下发生的变化,结果发现,无论何种条件下,纯化毒素在250 h内含量基本不变,接近某个常数,而毒素粗提物中NOD的含量在3种环境条件下持续下降,并在220h时达到最低;泡沫节球藻直接分泌产生的NOD在持续黑暗条件250h内降低不明显,在持续光照和除去紫外波长的光照条件下250h内其含量有明显降低,且在50—100h时降到最低[18]。由此可见,只要给予适合的环境条件,处于特定状态的NOD就可发生光降解,从而减少对生物的毒害作用[18]。
特定催化剂也会促进NOD的光降解。2005年,Iain Liu等人发现,以二氧化钛(TiO2)作为催化剂对NOD进行光降解,其降解速度明显增加,毒素含量也明显降低,相应的光降解副产物也可在一定时间内分解[19]。
②其他物理方法
反渗透和真空蒸馏是脱盐作用常用的两种方法。1997年,Erkki Vuori等人发现,反渗透和真空蒸馏还可有效地移除海水中的NOD[20]。
沉积物吸附也有助于水中NOD的移除。2008年,Anna Torunska等人对波罗的海中细粒沉积物对NOD的吸附做了一定的研究。结果发现,一部分NOD可以被细粒沉积物吸附,吸附能力取决于NOD与沉积物结构的亲和力,其吸附机制包括静电作用、氢键和非特异性的范德华力[21]。
(2)NOD的化学降解
环境中的NOD可通过氧化降解或电化学反应等消除。2011年, Paulina V. F. Santos等人对NOD的氧化降解和电化学反应机制进行了研究。结果表明,NOD的电化学分解只涉及到1个电子,是不可逆的、不依赖于pH的过程;而NOD的氧化降解则是不可逆的、依赖于pH的过程[22]。
(3)NOD的生物降解
2009年,Hanna Mazur-Marzec等人就格丹斯克海峡中自然存在的细菌对NOD的生物降解、以及毒素对分离纯化后细菌的影响进行了研究。将分离纯化后的细菌与NOD共同培养时,NOD未见降解,而底泥中自然存在的微生物群却可以在5—7d内有效去除NOD[23]。
细菌菌株(Sphingosinicellasp)对NOD具有一定的降解能力。B- 9菌株细胞提取物中含有能降解NOD的水解酶,其水解过程为NOD的质子化、加水反应和环状肽肽键的断裂,最终产物为Adda。假设M代表NOD的结构式,其水解过程可表示为M→(M+H)+→(M+H2O+H)+→(Adda+H)+,水解过程中会出现一种线性中间产物,说明NOD的水解与MCs的水解具有类似的途径[24]。Susumu Imanishi等人的研究中认为,细菌菌株B- 9细胞提取物中降解NOD的水解酶选择性地作用于Arg-Adda之间的肽键是环状肝毒素NOD降解的起始作用[25]。
水中可降解NOD的微生物以及降解途径具有多样性。2008年,Christine Edwards等研究表明,不同淡水水体中NOD的半衰期为4—18d,降解得到的产物源自母体化合物的脱甲基作用、水解作用、脱羧作用和缩合作用[26]。微生物对NOD的水解作用依赖于水的性质、采样地点、微生物的种类以及NOD的数量或浓度。
3.2.3 节球藻毒素在水生生物体内的积累和代谢
NOD可沿食物链由泡沫节球藻传递至其它水生生物。许多水生生物对NOD具有一定的解毒作用,经过一定时间的代谢后,最终生物体内NOD的浓度要比初始摄入时的浓度要低[27]。Karjalainen M等调查显示,暴露于含有5μg/L经放射性标记的NOD水溶液24h后,具沟急游虫(Strombidiumsulcatum)中NOD含量为(1.55±0.50)μg/g C, 48h后纺锤水蚤(Acartiatonsa)、真宽水蚤(Eurytemoraaffinis)中NOD含量分别为(0.37±0.22)μg/g C和(0.60±0.15)μg/g C[10]。
4 节球藻毒素的毒性效应
泡沫节球藻可以固定大气中的溶解态氮,其生存能力比其它浮游生物高,由于其在水中的高生物量和毒素代谢物的产生,从而使生物多样性降低,严重影响了生态系统的结构和功能[28]。同时,由于许多水生生物对NOD具有一定的解毒作用,且解毒过程是一个消耗能量的过程,因而会影响浮游生物的繁殖和总的生长率。若水生生态系统生物链中某一种较敏感的生物受到节球藻毒素的影响,则整个食物链的生产力也会受到影响。NOD对人、陆生动植物以及水生生物都具有一定的毒害作用,其主要的靶器官为肝脏,对肝脏的毒性效应主要是致癌作用。
4.1 NOD对陆生动物的影响
节球藻毒素的主要靶器官为肝脏和肾脏。Tetsuya Ohta等就NOD对F344雄性鼠的肝脏毒性进行了研究,发现NOD对小鼠肝的致癌效应与二乙基亚硝胺单独作用时相类似,揭示了NOD是一种致癌物质,而微囊藻毒素-LR则只是肿瘤促进剂。NOD可诱导组成小鼠肝细胞角蛋白的初始物质8肽和18肽的高度磷酸化,且其效率比微囊藻毒素-LR高20倍,说明NOD相对于微囊藻毒素-LR更容易进入细胞内,因此其对细胞的毒害作用比微囊藻毒素-LR更大[29]。2002年,张占英等的研究表明,经过腹腔注射、口服和静脉注射3种不同途径进入小鼠体内的I(125)-NOD主要分布在肾脏和肝脏,放射自显影技术研究发现标记的NOD主要定位于肾皮质的肾细胞核内和肝细胞核内[30]。
NOD对动物具有急性毒性作用。2002年,Rheal A.Towner利用磁共振技术对大鼠体内NOD的毒性进行评估,结果显示,腹腔注射3h后肝组织中含有NOD的区域有明显损伤,并且同时发现肝血清功能酶(转氨酶和天冬氨酸转氨酶)的活性也受到一定的抑制[31]。Yanyan Zhao等认为,NOD可以抑制NADH脱氢酶和激活琥珀酸脱氢酶的活性,从而影响生物正常的呼吸作用,还可改变线粒体Na+-K+ATP酶活性,进而打破线粒体膜上的离子稳态,使线粒体膜电位消失[32]。
4.2 NOD对人的影响
NOD对人的暴露途径主要有4种:皮肤接触、吸入、血液透析和摄入。人们在含有NOD的水中进行水上运动或用未处理过的水进行淋浴时,都有可能出现皮肤的过敏性反应;利用未充分处理的含有NOD的水对病人进行血液透析会对病人的肝组织造成损伤,出现一系列的生理生化反应;当饮用水源中含有泡沫节球藻浮渣或者NOD时,若处理不当,有可能使NOD随饮水或饮食进入人体内造成损伤[33]。目前最主要的应对策略是提高水处理技术,降低水源中节球藻毒素的含量。
NOD会对人体细胞产生遗传毒性,导致遗传疾病的发生。2006年,A.Lankoff对NOD诱导的人类HepG2细胞DNA氧化损伤和非整倍性改变进行研究,结果显示NOD通过嘌呤氧化和由于非整倍性活动导致着丝粒微核形成的增加诱导了DNA的氧化损伤,还可引起HepG2细胞的凋亡,NOD诱导基因发生改变有可能是引发致癌作用的主要原因[34]。
2011年,Gong Feng等人对人类肝细胞癌细胞系(HepG2)的研究中发现,NOD可以通过NF-KB途径在mRNA和蛋白质水平诱导Fas受体和配体的表达,从而使细胞发生凋亡,其主要原因是NOD可以促进核转位和激活NF-KB的p65亚基,若将HepG2细胞中的p65基因敲除,则可发现Fas受体和配体的表达以及细胞凋亡的数量均减少[35]。
4.3 NOD对陆生植物的影响
长期暴露于NOD下,植物体内也会产生一系列的反应。2011年,Nina Lehtimäki等人首次提出,当灌溉水中含有NOD时,菠菜叶子变白且生长受到抑制,但菠菜叶绿体类囊体膜上的光合合成机制并不会受到干扰。NOD引起的菠菜氧化应激反应包括多种蛋白质的修饰、各种氧化酶的改变如α-生育酚和细胞色素氧化酶水平增加等,虽然这些抗氧化酶活性增加可以使植物在NOD的条件下生存,但是由于酶促防御系统的上调可能会增加能量的消耗,降低了植物的生长以及适应性,最终导致植物的生长停缓甚至死亡[36]。
4. 4 NOD对水生生物的影响
节球藻毒素对水生生物的毒性影响体现在多个方面。2005年,Stephan Pflugmacher等人对暴露于蓝藻毒素的澳大利亚黑虎虾(Penaeusmonodon)细胞内和微粒体内的谷胱甘肽-S-转移酶活性和底物特异性进行了研究。结果表明,低浓度的毒素会诱导酶的活性,而高剂量的毒素则可显著抑制酶的活性[37]。2010年,Stephan Pflugmacher等人对NOD引起的蠕虫叉红藻(Furcellarialumbricalis)内的几种酶如超氧化物歧化酶(SOD)、谷胱甘肽转移酶(GST)、谷胱甘肽过氧化物酶(GPx)和谷胱甘肽还原酶(GR)的活性进行了检测,结果显示这几种酶的活性均随NOD浓度的增加而升高,证实NOD可激活蠕虫叉红藻体内的抗氧化系统,引起抗氧化反应[38]。
NOD也可以诱导水生生物的细胞凋亡。2012年,Hangjun Zhang等人研究了体外暴露于NOD的鲫鱼淋巴细胞的凋亡反应,透射电子显微镜显示淋巴细胞呈现一系列的形态学改变,包括细胞质凝聚、核染色质凝聚和边缘化;流式细胞仪检测结果表明,NOD浓度越高,细胞凋亡率越大,且细胞凋亡率远大于正常条件下淋巴细胞的凋亡。NOD诱导细胞发生凋亡的机制为NOD可以引起细胞内活性氧种类的明显增加、剂量依赖性的线粒体膜损伤、细胞内钙离子浓度的上调、Bcl- 2的下调和mRNA和蛋白质水平Bax表达的上调、细胞凋亡蛋白酶-3和细胞凋亡蛋白酶- 9不再受到细胞凋亡蛋白酶- 8活性的调节。NOD可以通过线粒体凋亡通路和破坏鱼的免疫反应而诱导淋巴细胞的凋亡[39]。
5 研究前景
综上所述,节球藻毒素是一种对水生生物、陆生生物以及人类的健康有很大威胁的物质,其含量超过一定水平就会对生物的物质代谢、能量转换和器官组织造成一定的损伤,肝脏和肾脏是节球藻毒素的主要的靶器官,但NOD对其它器官的影响作用是需要确定的;且其对不同生物的安全浓度可能存在很大差异,因此,通过研究节球藻毒素对不同生态位代表性生物的毒性研究,确定节球藻毒素对不同生态位生物的安全浓度,进而制定相应的水生态基准刻不容缓。同时,水域中除了有藻毒素外,还有其它污染物质如重金属、除草剂、水消毒副产物等,NOD是否与其具有复合污染效应还有待进一步研究。节球藻毒素的降解对于确保其在环境中保持安全的浓度水平具有重要意义,而生物方法对节球藻毒素的移除主要依赖于酶促反应下的降解,但目前可分离出的酶的种类与数量均很有限,因此,筛选可降解节球藻毒素的微生物,提取相关降解酶并掌握其特性是未来研究的方向之一。
[1] James S M, Geoffrey A C. Cyanotoxins // Whitton B A. Ecology of Cyanobacteria II: Their Diversity in Space and Time. Netherlands: Springer, 2012: 651- 675.
[2] Francis G. Poisonous Australian lake. Nature, 1878, 18(444): 11- 12.
[3] Sivonen K, Jones G. Cyanobacterial toxins // Chrous I, Bartram J. Toxic Cyanobacteria in Water: a Guide to Their Public Health Consequences, Monitoring and Management. London: E&FN Spon, 1999: 55- 124.
[4] Zhi B H, Zhou Y, Liu Z S, Li C Y, Lu S Y, Ren H L. Advance in study of nodularin. Modern Preventive Medicine, 2010, 37(2): 245- 248.
[5] Lanras T, Cook C M, Eriksson J E, Meriluoto J A O, Hotokka M. Computer modelling of the 3-dimensional structures of the cyanobacterial hepatotoxins microcystin-LR and nodularin. Toxicon, 1991, 29(7): 901- 906.
[6] Meriluoto J. Chromatography of microcystins. Analytica Chimica Acta, 1997, 352(1/3): 277- 298.
[7] Pelander A, Ojanperä I, Sivonen K, Himberg K, Waris M, Niinivaara K, Vuori E. Screening for cyanobacterial toxins in bloom and strain samples by thin layer chromatography. Water Research, 1996, 30(6): 1464- 1470.
[8] Li S, Yin H W. Ex-treatment of immunoassay method for nodularin and cylindrospermopsins. Journal of East China Normal University: Natural Science, 2011, (6): 108- 114.
[9] Robillot C, Hennion M C. Issues arising when interpreting the results of the protein phosphatase 2A inhibition assay for the monitoring of microcystins. Analytica Chimica Acta, 2004, 512(2): 339- 346.
[10] Karjalainen M, Reinikainen M, Lindvall F, Spoof L, Meriluoto J A O. Uptake and accumulation of dissolved, radiolabeled nodularin in Baltic Sea zooplankton. Environmental Toxicology, 2003, 18(1): 52- 60.
[11] Zhou Y, Li Y S, Zhi B H, Lu S Y, Ren H L, Zhang Y Y, Li Z H, Shen Q F, Meng X M, Liu Z S, Zhang Z S, Zhang J H, Hao Y M, Liu W D, Fang S, Yan D M. Detection of nodularin based on a monoclonal antibody in water and aquatic fish samples. Food Control, 2011, 22(5): 797- 800.
[12] Mikhailov A, Härmälä-Braskén A S, Polosukhina E, Hanski A, Wahlsten M, Sivonen K, Eriksson J E. Production and specificity of monoclonal antibodies against nodularin conjugated throughN-methyldehydrobutyrine. Toxicon, 2011, 39(10): 1453- 1459.
[13] Metcalf J S, Bell S G, Codd G A. Colorimetric immuno-protein phosphatase inhibition assay for specific detection of microcystins and nodularins of cyanobacteria. Applied and Environmental Microbiology, 2001, 67(2): 904- 909.
[14] Moffitt M C, Neilan B A. On the presence of peptide synthetase and polyketide synthase genes in the cyanobacterial genusNodularia. FEMS Microbiology Letters, 2001, 196(2): 207- 214.
[15] Song L R, Chen W. Production of microcystins in bloom-forming cyanobacteria and their environmental fates: a review. Journal of Lake Sciences, 2009, 21(6): 749- 757.
[16] Pattanaik B, Wulff A, Roleda M Y, Garde K, Mohlin M. Production of the cyanotoxin nodularin-A multifactorial approach. Harmful Algae, 2010, 10(1): 30- 38.
[17] Lehtimaki J, Moisander P, Sivonen K, Kononen K. Growth, nitrogen fixation, and nodularin production by two Baltic Sea cyanobacteria. Applied and Environmental Microbiology, 1997, 63(5): 1647- 1656.
[18] Twist H, Codd G A. Degradation of the cyanobacterial hepatotoxin, nodularin, under light and dark conditions. FEMS Microbiology Letters, 1997, 151(1): 83- 88.
[19] Liu L, Lawton L A, Bahnemann D W, Robertson P K J. The photocatalytic destruction of the cyanotoxin, nodularin using TiO2.Applied Catalysis B: Environmental, 2005, 60(3/4): 245- 252.
[20] Vuori E, Pelander A, Himberg K, Waris M, Niinivaara K. Removal of nodularin from brackish water with reverse osmosis or vacuum distillation. Water Research, 1997, 31(11): 2922- 2924.
[21] Toruńska A, Bolaek J, Pliński M, Mazur-Marzec H. Biodegradation and sorption of nodularin (NOD) in fine-grained sediments. Chemosphere, 2008, 70(11): 2039- 2046.
[22] Santos P V F, Lopes I C, Diculescu V C, de Araujo M C U, Oliverira-Brett A M. Redox mechanisms of nodularin and chemically degraded nodularin. Electroanalysis, 2011, 23(10): 2310- 2319.
[23] Mazur-Marzec H, Toruńska A, Bońska M J, Moskot M, Pliński M, Jakóbkiewicz-Banecka J, Węgrzyn G. Biodegradation of nodularin and effects of the toxin on bacterial isolates from the Gulf of Gdańsk. Water Research, 2009, 43(11): 2801- 2810.
[24] Kato H, Imanishi S Y, Tsuji K, Harada K I. Microbial degradation of cyanobacterial cyclic peptides. Water Research, 2007, 41(8): 1754- 1762.
[25] Imanishi S, Kato H, Mizuno M, Tsuji K, Harada K I. Bacterial degradation of microcystins and nodularin. Chemical Research Toxicology, 2005, 18(3): 591- 598.
[26] Edwards C, Graham D, Fowler N, Lawton L A. Biodegradation of microcystins and nodularin in freshwaters. Chemosphere, 2008, 73(8): 1315- 1321.
[27] Karjalainen M. Fate and effects ofNodulariaspumigenaand its toxin, nodularin, in Baltic Sea planktonic food webs. Finnish Institute of Marine Research-Contributions, 2005, No. 10.
[28] Mazur-Marzec H, Pliński M. Do toxic cyanobacteria blooms pose a threat to the Baltic ecosystem? Oceanologia, 2009, 51(3): 293- 319.
[29] Ohta T, Sueoka E, Iida N, Komori A, Suqanuma M, Nishiwaki R, Tatematsu M, Kim S J, Carmichael W W, Fujiki H. Nodularin, a potent inhibitor of protein phosphatases 1 and 2A, is a new environmental carcinogen in male F344 rat liver. Cancer Research, 1994, 54(24): 6402- 6406.
[30] Zhang Z Y, Yu S Z, Chen C W, Wei G R. Study on the distribution of nodularin in tissues and cell level in mice. China Journal of Preventive Medicine, 2002, 36(2): 100- 102.
[31] Towner R A, Sturgeon S A, Khan N, Hou H, Swartz H M. In vivo assessment of nodularin-induced hepatotoxicity in the rat using magnetic resonance techniques (MRI, MRS and EPR oximetry). Chemico-Biological Interactions, 2002, 139(3): 231- 250.
[32] Zhao Y Y, Xie P, Tang R, Zhang X Z, Li L, Li D P. In vivo studies on the toxic effects of microcystins on mitochondrial electron transport chain and ion regulation in liver and heart of rabbit. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2008, 148(3): 204- 210.
[33] Codd G, Bell S, Kaya K, Ward C, Beattie K, Metcalf J. Cyanobacterial toxins, exposure routes and human health. European Journal of Phycology, 1999, 34(4): 405- 415.
[34] Lankoff A, Wojcik A, Fessard V, Meriluoto J. Nodularin-induced genotoxicity following oxidative DNA damage and aneuploidy in HepG2 cells. Toxicology Letters, 2006, 164(3): 239- 248.
[35] Feng G, Li Y, Bai Y S. Induction of Fas receptor and Fas ligand by nodularin is mediated by NF- κB in HepG2 cells. Toxicology and Applied Pharmacology, 2011, 251(3): 245- 252.
[36] Lehtimäki N, Shunmugam S, Jokela J, Wahlsten M, Carmel D, Keranen M, Sivonen K, Aro E M, Allahverdiyeva Y, Mulo P. Nodularin uptake and induction of oxidative stress in Spinach (Spinachiaoleracea). Journal of Plant Physiology, 2011, 168(6): 594- 600.
[37] Pflugmacher S, Wiegand C, Werner S, Schroder H, Kankaanpaa H. Activity and substrate specificity of cytosolic and microsomal glutathione S-transferase in Australian black tiger Prawns (Penaeusmonodon) after exposure to cyanobacterial toxins. Environmental Toxicology, 2005, 20(3): 301- 307.
[38] Pflugmacher S, Olin M, Kankaanpaa H. Oxidative stress response in the red algaFurcellarialumbricalis(Huds.) Lamour. due to exposure and uptake of the cyanobacterial toxin nodularin fromNodulariaspumigena. Harmful Algae, 2010, 10(1): 49- 55.
[39] Zhang H J, Shao D D, Wu Y Z, Cai C C, Hu C M, Shou X L, Dai B R, Ye B H, Wang M D, Jia X Y. Apoptotic responses ofCarassiusauratuslymphocytes to nodularin exposure in vitro. Fish & Shellsh Immunology, 2012, 33(6): 1229- 1237.
参考文献:
[4] 支百慧, 周玉, 柳增善, 李春媛, 卢士英, 任洪林. 节球藻毒素研究进展. 现代预防医学, 2010, 37(2): 245- 248.
[8] 李双, 殷浩文. 节球藻和柱胞藻毒素免疫分析的前处理方法研究. 华东师范大学学报: 自然科学版, 2011, (6): 108- 114.
[15] 宋立荣, 陈伟. 水华蓝藻产毒的生物学机制及毒素的环境归趋研究进展. 湖泊科学, 2009, 21(6): 749- 757.
[30] 张占英, 俞顺章, 陈传炜, 卫国荣. 节球藻毒素在小鼠体内分布的研究. 中华预防医学杂志, 2002, 36(2): 100- 102.
Research progress of nodularin
MIN Jang1,*, HUI Xu2
1ShanghaiEngineeringResearchCenterofAquaculture,Shanghai201306,China2CollegeofFisheriesandlifeScience,ShanghaiOceanUniversity,Shanghai201306,China
Nodularin is a cyclic pentapeptide hepatotoxin produced byNodulariaspumigena. It′s toxicity and carcinogenicity to terrestrial animals and human beings has been confirmed by many studies. It has been subjected to the extensive concern of the society for its impact on the structure and function of aquatic ecosystem and the threats to different kinds of organisms including terrestrial plants and aquatic animals. The molecular structure, detection methods and production of nodularin are sketched. Recent progresses and perspectives in the study of environmental fates and toxic effects are viewed and discussed. Finally, the promising study about nodularin in the future is also proposed.
Nodularin; hepatotoxin; toxicity; carcinogenicity; environmental fate; degradation
上海市教委科研创新项目(10ZZ103);上海市教委重点学科建设项目(J50701);上海市高校知识服务平台项目(ZF1206)
2013- 06- 03;
2014- 06- 11
10.5846/stxb201306031298
*通讯作者Corresponding author.E-mail: mjiang@shou.edu.cn
江敏,许慧.节球藻毒素研究进展.生态学报,2014,34(16):4473- 4479.
Min J, Hui X.Research progress of Nodularin.Acta Ecologica Sinica,2014,34(16):4473- 4479.
