锰胁迫对杠板归细胞超微结构的影响
2014-08-08薛生国吴雪娥
王 钧, 邬 卉,薛生国,吴雪娥,刘 平
(1. 中南大学冶金与环境学院, 长沙 410083; 2. 中国环境科学学会, 北京 100082 )
锰胁迫对杠板归细胞超微结构的影响
王 钧1, 邬 卉1,薛生国1,吴雪娥1,刘 平2,*
(1. 中南大学冶金与环境学院, 长沙 410083; 2. 中国环境科学学会, 北京 100082 )
锰是植物生长必需的微量元素,然而锰含量过高将影响酶活性、造成植物毒害,不同植物的锰耐性差异很大。杠板归(PolygonumperfoliatumL.)是一种生长在锰尾矿废弃地的耐性植物。通过温室培养,应用透射电子显微镜-能谱联用仪研究不同锰处理条件下(5,1000,10 000 μmol/L)杠板归根、茎和叶细胞超微结构的变化和锰在叶细胞内可能的存在形式,结果表明:(1)生长介质锰含量为5 μmol/L时,杠板归细胞超微结构未见异常;即使锰处理浓度为1000 μmol/L时,杠板归根、茎和叶细胞结构依然完整,细胞器清晰可见,未见明显损伤;(2)当锰处理浓度为10000 μmol/L时,杠板归细胞器未见缺失现象,但根细胞内线粒体数量减少,茎细胞叶绿体开始受损,叶细胞叶绿体膜结构出现破损,基粒片层结构减少,嗜锇颗粒数量明显减少;(3)与对照相比,1000 μmol/L或10000 μmol/L锰处理30 d,植物细胞内出现黑色团聚物。10000 μmol/L锰处理条件下,杠板归叶细胞内和细胞间隙出现类似针状物质,这可能是杠板归体内锰积累和分布的形态之一。研究成果有助于阐明植物的锰耐性机制,为锰耐性植物筛选和废弃锰尾矿库生态重建提供科学参考。
杠板归; 锰胁迫; 耐性; 细胞; 超微结构
植物对重金属的耐性通常因植物种类和重金属元素种类的不同而存在差异。重金属在植物体内的分布总是尽可能避免损伤具有重要功能的组织、细胞和细胞器,而重金属在植物体内的选择性分布是植物忍耐重金属毒害的重要机制之一[1- 2];相应地,重金属进入植物体后,通过损伤重要组织、细胞和细胞器来表现其毒性,影响植物生长并可能导致植物体的死亡[3- 4]。植物细胞超微结构(细胞器)的改变是植物一系列生理活动异常的细胞学基础[5]。植物细胞遭受重金属胁迫后其超微结构会发生不同程度的损伤,主要表现在高尔基体、内质网、细胞核、叶绿体、线粒体、液泡、质膜等的异常变化。金伟等[6]用透射电镜观察 Cr3+处理18d的亚心形藻超微结构的变化,低浓度 Cr3+(≤1.5×10-5mg/L)对细胞的伤害不明显,Cr3+浓度增加时出现细胞核变形,核膜解体,线粒体膨大或解体,类囊体缺失,排列紊乱,叶绿体膜系统溃解。Cu2+和Cd2+离子处理使泡泡草根细胞产生质壁分离、细胞质浓缩和部分细胞空泡,使线粒体脊突消失、结构模糊和外膜破坏[7]。李大辉等[8]发现菱在 Cd2+、Hg2+处理8 d后,叶片和不定根细胞中细胞核的染色质与核质遭到破坏,不定根中细胞核的核仁消失。但核膜完整。梁文斌[9]等发现,低锰胁迫下垂序商陆叶细胞形态结构未发生明显变化,随着锰处理浓度的增加,叶绿体数目减少。
锰是植物生长必需的微量元素之一,对植物的光合放氧、调节酶活性等方面具有不可替代的作用[10]。但是,过量的锰亦会对植物造成毒害[11]。锰对植物的毒性效应最普遍的机制为氧化胁迫[12]。锰胁迫对不同植物细胞的超微结构损伤既有相似性又有差异性,如豆长明[13]等研究发现高锰胁迫下美洲商陆叶细胞叶绿体为主要损伤细胞器,叶细胞内出现大量黑色团状颗粒,或液泡膜周边出现大量黑色物质;王华[14]等人研究发现在锰处理浓度≤5 000 μmol/L时,水蓼叶细胞的细胞膜还没有受到明显伤害,锰在水蓼叶细胞非活性代谢部分(细胞壁和液泡)的积累是其解毒耐锰的主要机制之一;Ioannis Papadakis[15]等在观察柑橘细胞超微结构中发现,高锰胁迫下液泡中发现黑色物质,且通过增加叶绿体数量和大小也适应高锰胁迫环境;Snejana Doncheva[16]等发现,当锰处理浓度为3 000 μmol/L时,豌豆细胞叶绿体受损,类囊体扭曲,淀粉粒大小和数量上升,囊体中亦发现黑色物质。
杠板归(PolygonumperfoliatumL.)是在湖南湘潭发现的锰耐性植物,在锰含量高达114 000 mg/kg的废弃尾矿库上生长良好[17]。研究发现,温室条件下锰处理浓度为500 μmol/L时,杠板归叶锰含量即达13140 mg/kg,当锰浓度为10000 μmol/L时叶锰含量高达41 540 mg/kg。重金属在植物体内的积累超过一定阈值后,将对细胞超微结构的造成损伤。 植物受重金属胁迫后,其细胞超微结构改变是植物一系列生理活动异常的细胞学基础,因此本文拟采用温室营养液培养法,以杠板归为研究对象,从亚细胞水平研究耐性植物在不同锰处理水平条件下细胞超微结构的变化,并探寻锰在细胞内可能的积累位点,有助于阐明植物的锰耐性机制,为锰矿废弃地耐性植物筛选和生态重建提供科学参考。
1 材料与方法
1.1 供试材料
以杠板归为研究对象,种子采自湖南湘潭锰矿。低温处理和消毒后置于恒温箱(温度为(25+0.5)℃)催芽,待种子露白后埋入河沙盆中,长到2叶1心时,选取生长一致的健壮幼苗移栽至体积为20 L的塑料盆内,采用Hoagland营养液培养[18]。设定3个锰处理水平,锰浓度分别为5、1000、10000 μmol/L,其中5 μmol/L是植物正常生长需要的微量元素水平。锰以MnCl2·4H2O形态加入,每组处理设3个重复。培养初期,营养液每7 d换1次,旺盛生长期每5 d换1次,每天用 0.1 mol/L NaOH或0.1 mol/L HCl调pH值至4.5,以维持生长介质中较高的Mn2+浓度,保持24 h通气。连续处理30 d,收获植物。
1.2 透射电子显微镜样品制备与观察
选取不同锰处理条件下杠板归新鲜的根、茎和叶样品,用锋利的刀片将其切成大小约1—2 mm2的小块,依次经过2.5%的戊二醛溶液(0.2 mol/L PBS缓冲液配)固定、磷酸缓冲液(pH值=7.2的PBS)洗涤、1%的OsO4固定、0.1 mol/L的磷酸缓冲液(pH值=7.0)漂洗、梯度脱水、冷冻断裂法分割样品等,环氧树脂对样品进行包埋渗透,经70 ℃聚合48 h后储存备用。用超薄切片机将制备的样品切成80 nm的薄片,醋酸铀-柠檬酸铅双重染色后在JEOL TEM- 1230EX电镜上观察并照像,工作电压为100 kV。
1.3 杠板归叶片的能谱分析
将杠板归叶片用钻石刀在超薄切片机上切成120 nm的薄片,通过透射电镜寻找样品细胞中电子云密度小体分布位点,并拍照,用EDAX-PHOENIX 能谱分析仪进行样品的X射线光谱分析。能谱仪操作条件为:加速电压80 kV,最小光斑直径(Spotsize)80 nm,样品台倾角35 ℃,保持CPS(每秒所读信息量)1500,收谱时间100 s。
2 结果与分析
2.1 锰对杠板归根细胞超微结构的影响
图1至图3为锰耐性植物杠板归在不同锰浓度处理下根细胞及细胞器的超微结构变化。生长介质锰含量5 μmol/L是植物正常生长需要的微量元素含量水平,杠板归根细胞超微结构未见异常(图1-A)。与正常生长环境条件相比,锰胁迫条件下杠板归根细胞未见明显变化,细胞结构基本完整,细胞膜和细胞器清晰可见,液泡完整(图1-B、图1-C)。

图1 不同锰处理浓度下杠板归根细胞的超微结构Fig.1 Ultrastructure pictures of the root cells of P.perfoliatum under different manganese levelsA. 锰处理浓度为5 μmol/L(CK);B. 锰处理浓度为1000 μmol/L;C. 锰处理浓度为10000 μmol/L
线粒体是植物细胞中普遍含有的细胞器,大小形状不一,由内外两层膜组成,膜结构有效地增加了酶分子附着的表面。线粒体的重要功能是进行呼吸作用,是细胞中产生能量的场所,提供植物生命活动所需的能量。细胞中线粒体的数目与细胞的生理状态有关,代谢旺盛的细胞有较多的线粒体。5 μmol/L锰处理条件下线粒体内、外膜、峭较为清晰可见(图2-A);1000 μmol/L锰处理条件下,杠板归根细胞线粒体数量结构未发生明显变化(图2-B);但在10000 μmol/L锰处理条件下,线粒体数量明显减少,部分线粒体嵴消失(图2-C),这表明在高锰处理条件下杠板归生长受到一定程度的抑制。内质网是分布在细胞质中的膜层结构,以各种形状延伸,扩展形成各种管、泡、腔交织的复杂网状管道系统,主要功能是合成蛋白质,也与脂类和糖类的合成关系密切。内质网的存在提供了细胞空间内的支持骨架,增加了细胞的表面积,形成细胞内的运输和贮藏系统,使代谢活动高效进行。细胞发育过程中内质网数量可能有很大变化,影响其变化的因素包括细胞的类型、年龄以及外部环境条件。细胞内活跃的代谢活动与大量的内质网数量有关。由图3-A、图3-B、图3-C对比可以看出,不同锰处理条件下,杠板归根细胞的内质网清晰可见,未发生明显数量结构变化。

图2 不同锰处理浓度下杠板归根细胞的超微结构(线粒体)Fig.2 Ultrastructure pictures of the root cells of P.perfoliatum under different manganese levels (Mitochondrion)
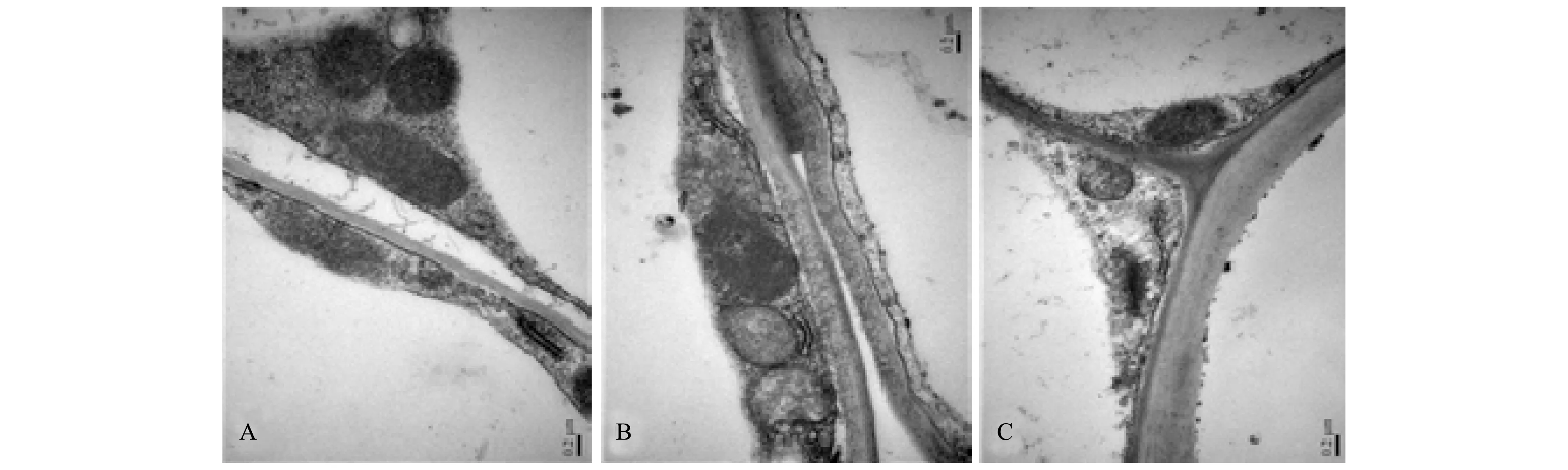
图3 不同锰处理浓度下杠板归根细胞的超微结构(内质网)Fig.3 Ultrastructure pictures of the root cells of P.perfoliatum under different manganese levels (Endoplasmic reticulum)
2.2 锰对杠板归茎细胞超微结构的影响
重金属对植物细胞超微结构的影响研究主要集中在叶和根,对茎的研究较少。茎作为植物养分及水分输送的营养器官,也是植物体内金属元素迁移转运的重要途径。图4至图6为杠板归在不同锰浓度处理下茎细胞及细胞器的超微结构变化。5 μmol/L和1000 μmol/L锰处理条件下杠板归茎细胞结构完整,细胞壁均未出现断裂现象,核膜完整,细胞器清晰可见(图4-A、图4-B),但在10000 μmol/L锰处理条件下,根细胞核内有多处色深,异染色质与常染色质分布不均匀,部分细胞的双层膜已出现受损迹象(图4-C)。线粒体中嵴的多少与细胞生理状态有关,代谢旺盛的细胞有较密的嵴。与对照(图5-A)相比,1000 μmol/L锰处理条件下,杠板归茎细胞线粒体数量未发生变化(图5-B),但在10000 μmol/L锰处理条件下茎细胞的线粒体嵴数量减少变得稀疏(图5-C),这表明在高锰处理条件下杠板归茎细胞生活力下降,线粒体活性降低。叶绿体是植物整个光合作用的功能单位,是光合作用的细胞器。5 μmol/L和1000 μmol/L锰处理条件下,茎细胞基粒类囊体与叶绿体长轴方向平行,基粒片层排列整齐(图6-A、图6-B),但在10000 μmol/L锰处理条件下茎细胞的叶绿体基粒片层模糊,基粒类囊体膨胀,基粒排列紊乱(图6-C),这可能与高锰胁迫有关,也可能是杠板归茎部逐渐木质化,叶绿体失去功能。
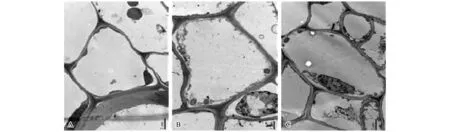
图4 不同锰处理浓度下杠板归茎细胞的超微结构Fig.4 Ultrastructure pictures of the stem cells of P.perfoliatum under different manganese levels
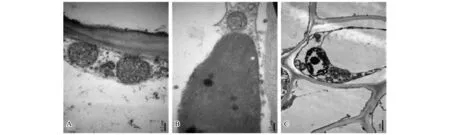
图5 不同锰处理浓度下杠板归茎细胞的超微结构(线粒体)Fig.5 Ultrastructure pictures of the stem cells of P.perfoliatum under different manganese levels (Mitochondrion)
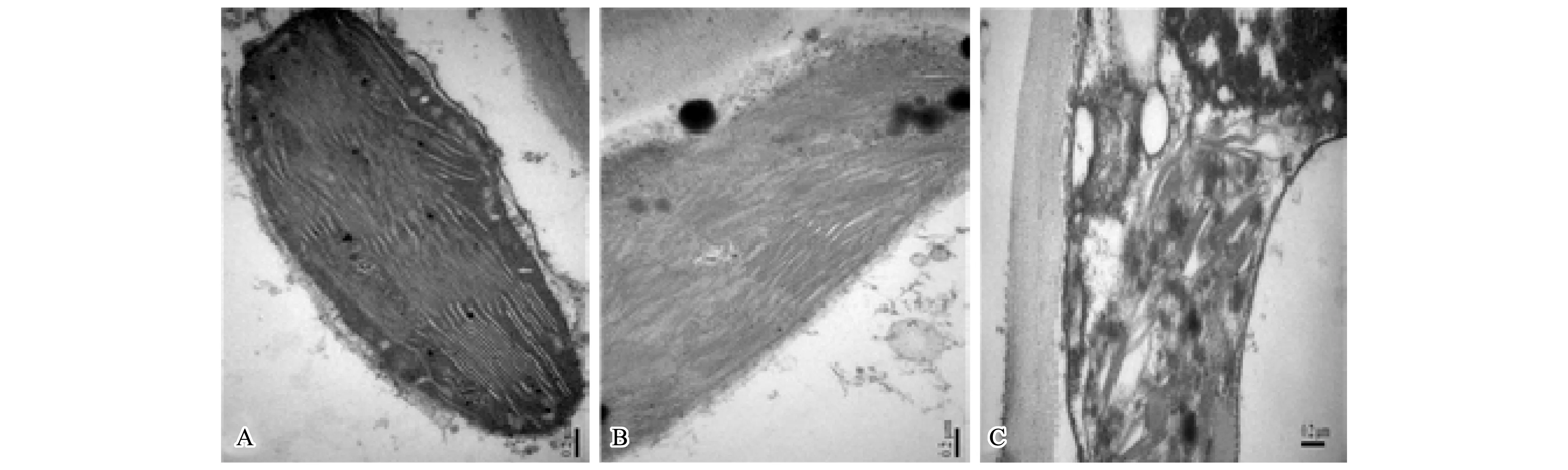
图6 不同锰处理浓度下杠板归茎细胞的超微结构(叶绿体)Fig.6 Ultrastructure pictures of the stem cells of P.perfoliatum under different manganese levels (Chloroplast)
2.3 锰对杠板归叶细胞超微结构的影响
图7至图9为不同锰浓度处理下杠板归叶细胞及细胞器的超微结构变化。锰浓度为5 μmol/L时,叶细胞膜系统完整, 细胞器结构正常,叶绿体仍保持正常形态,基粒、基质片层排列整齐,线粒体形态规则,内膜脊突丰富、结构整齐,间质浓密(图7-A)。透射电镜观察发现,随着锰处理浓度升高,叶细胞结构变化主要体现在液泡内出现黑色物质、叶绿体损伤等。如图7-B与图7-C所示,与对照相比,1000 μmol/L或10000 μmol/L锰处理30 d,细胞内明显出现黑色团聚物。其中,锰处理浓度为10000 μmol/L时,在电子显微镜下发现杠板归细胞内和细胞间隙开始出现针状物质(图7-C),这可能是锰在植物细胞内的一种存式形式。如图8-A所示,杠板归正常对照叶绿体结构清晰,双层膜完整,基粒片层结构排列整齐,内含淀粉粒,并有嗜饿颗粒;1000 μmol/L锰处理条件下,细胞内叶绿体完好无损,与对照结构一致,未见损伤(图8-B);而10000 μmol/L锰处理条件下,叶绿体出现明显损伤,结构不完整,双层膜破裂或结构消失,内部基粒片层结构紊乱,淀粉颗粒与对照相比明显增大变多,而嗜锇颗粒数量明显减少(图8-C)。另外,与对照(图9-A)或低浓度锰处理(图9-B)条件下(锰处理浓度为5 μmol/L和1000 μmol/L)相比,高浓度锰处理条件下(锰处理浓度为10000 μmol/L)杠板归叶细胞线粒体出现明显损伤,内部结构紊乱,嵴突结构不明或消失(图9-C)。

图7 不同锰处理浓度下杠板归叶细胞的超微结构Fig.7 Ultrastructure pictures of the leaf cells of P.perfoliatum under different manganese levels

图8 不同锰处理浓度下杠板归叶细胞的超微结构(叶绿体)Fig.8 Ultrastructure pictures of the leaf cells of P.perfoliatum under different manganese levels (Chloroplast)
2.4 杠板归叶细胞内的类似针状物质
考虑到杠板归为锰耐性植物,其锰积累量可高达41 540 mg/kg。很容易产生一个问题,杠板归是否以晶体形式存储锰?透射电子显微镜观察显示,杠板归叶细胞内和细胞间隙开始出现类似针状物质(图10),且类似针状物质所含锰量较高(图11-A、图11-B),选择位点1和2的类似针状物质分析后,发现其含有元素O、P、Mn等,初步推测锰可能与磷酸根基团0结合。
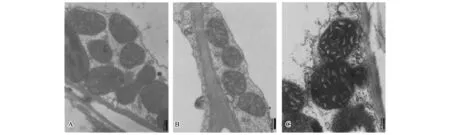
图9 不同锰处理浓度下杠板归叶细胞的超微结构(线粒体)Fig.9 Ultrastructure pictures of the stem cells of P.perfoliatum under different manganese levels (Mitochondrion)

图10 杠板归叶细胞内能谱点位分布图Fig.10 Corresponding EDAX-spectra pictures of the leaf cells of P.perfoliatum点位1示细胞间隙针状物质;点位2示细胞质内针状物质
3 讨论
锰是植物生长必需的微量元素之一, 参与体内重要的新陈代谢过程。锰含量过高, 将影响酶活性, 导致体内积累过多的H2O2和多酚类物质, 使植物受到毒害。过量的Mn2+能够抑制Fe2+和Mg2+等元素的吸收及活性, 导致叶绿体结构破坏、叶绿素合成下降和光合速率降低。低锰处理条件下,杠板归的叶绿体结构未发生明显变化。随着生长介质中锰处理浓度的升高,叶绿体开始出现不同程度的变化,叶绿体双层膜破裂或结构消失,内部基粒片层结构紊乱,表明高浓度锰胁迫对杠板归叶绿体结构已产生明显影响。Snejana Doncheva[16]等发现锰处理条件下,豌豆细胞叶绿体受损,类囊体扭曲,淀粉粒大小和数量明显上升。这与本研究中杠板归叶细胞超微结构受高锰胁迫影响的结果类似。但是,梁文斌[19]等人观察到的垂序商陆随着锰处理浓度的升高,淀粉粒减少变小、嗜锇颗粒数增多,与本研究中杠板归叶绿体淀粉粒大小和数量上升、嗜锇颗粒数量明显减少的结果存在差异。这可能是由于杠板归未通过淀粉粒降解,合成更多的有机溶质,调节渗透压的机制来应对锰毒。
植物通过细胞区隔化作用忍耐金属毒害,重金属在植物体内以不具生物活性的解毒形式存在。已有研究表明[4,20],杠板归具有较强的锰耐性,锰在植物体内可能以某种非生物活性的解毒形式存在。锰与其它重金属元素不同,其可能存在于液泡、细胞壁、高尔基体和叶绿体片层结构[21- 22]。王华[14]等研究发现在锰处理浓度≤5 000 μmol/L时水蓼锰积累在水蓼叶细胞非活性代谢部分(细胞壁和液泡)。本研究中发现,与对照相比,杠板归叶细胞结构变化主要体现细胞内出现黑色物质。Ioannis Papadakis[15]、Snejana Doncheva[16]、豆长明[10]等人在植物细胞内都观察到类似黑色物质,其中豆长明分析美洲商陆叶细胞内黑色物质后,发现其为锰的氧化物。过量锰以氧化锰形式存在于植物叶细胞内,文献也多有报道,而大量的锰氧化物累积将导致植物叶片出现发暗、黄斑等症状[23- 24],与前期研究中温室营养液培养下杠板归叶片褪绿等结论吻合[17]。推测叶细胞内黑色物质可能为锰的氧化物,其组成元素及含量有待进一步确定。
细胞的生理代谢活动主要在细胞质中进行,一旦细胞质受毒害收缩、干涸和消失,即细胞空泡化,则细胞生理代谢活动停止,细胞将死亡。尽管杠板归在锰处理浓度高达10000 μmol/L培养液中,线粒体和叶绿体受到一定的损伤,但并未发现任何空泡化细胞,内质网和高尔基体结构依然完好,发挥各自的功能,这表明杠板归对高锰胁迫具有极强的耐性。透射电镜观察还发现,随着锰处理浓度的升高,杠板归叶细胞间隙和细胞内开始出现类似针状物质,能谱分析针状物质发现P元素含量达到7.92%和11.46%,可能是杠板归通过磷酸根对锰进行固定或沉淀。磷酸根在植物重金属耐性作用中扮演重要角色,其作用机制一直颇受关注[25],磷酸盐对锰及其它重金属的沉积与固定效应在研究中也有不少报道[26- 27]。关于杠板归锰累积过程中,磷酸根的作用机制还有待进一步研究。
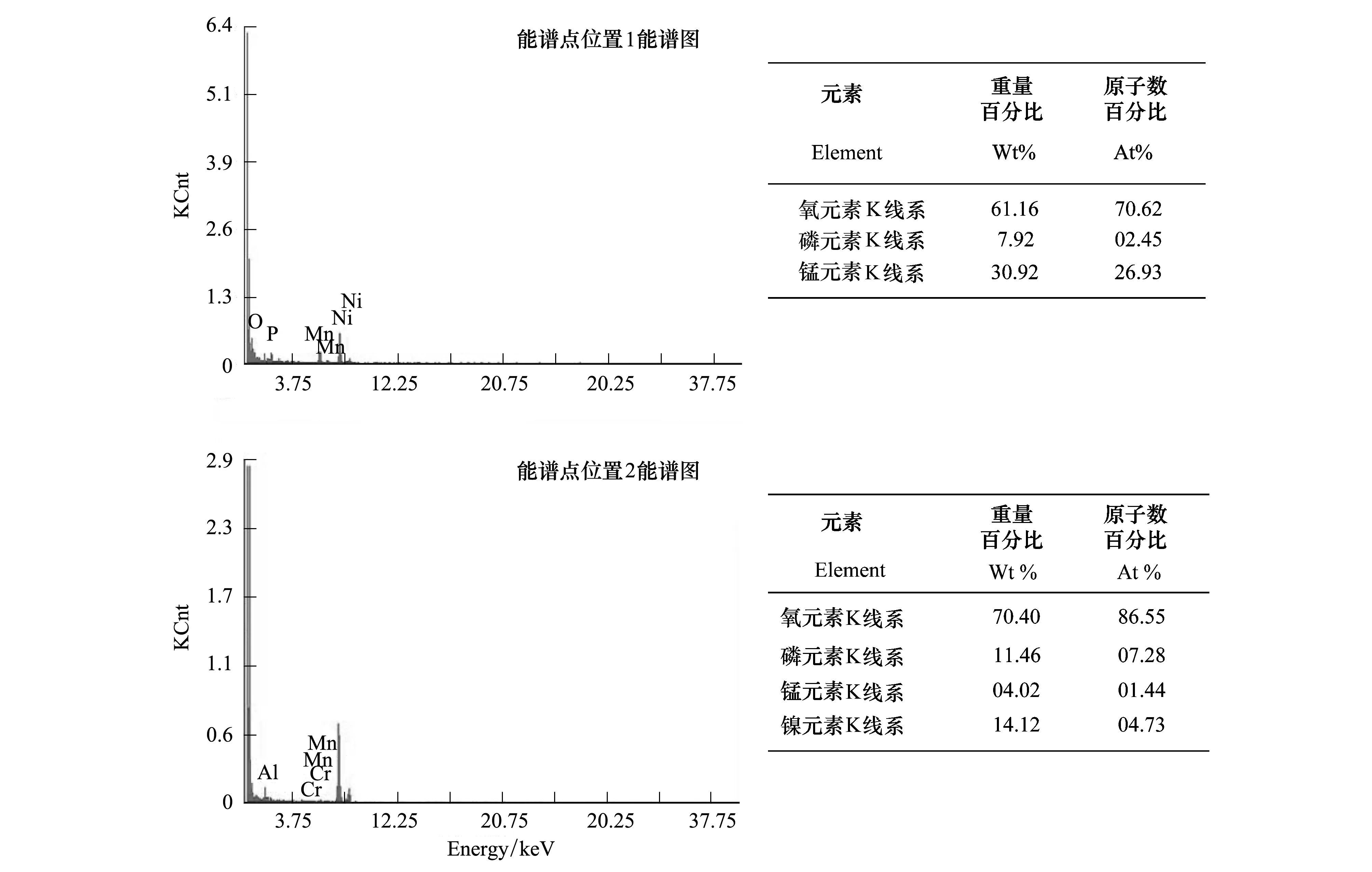
图11 杠板归叶细胞内不同区域能谱图Fig.11 Corresponding EDAX-spectra pictures of the leaf cells of P.perfoliatum in different region
4 结论
(1) 当生长介质锰浓度为5 μmol/L和1000 μmol/L时,杠板归根、茎和叶细胞结构完整,细胞器清晰可见,未见明显损伤。
(2) 当锰处理浓度为10000 μmol/L时,植物细胞内细胞器未见缺失现象,但是细胞器已受伤害,杠板归根细胞内线粒体数量减少,茎细胞叶绿体开始受损,叶细胞叶绿体双层膜破裂或结构消失,内部基粒片层结构紊乱。
(3) 高锰生长条件下,杠板归叶细胞内和细胞间隙出现类似针状物质,这可能是杠板归体内积累锰并避免锰毒害的一种形式。
[1] Weng X Y, Zhao L L, Zheng C J, Zhu J W. Characteristics of the hyperaccumulator plantPhytolaccaacinosa(Phytolaccaceae) in response to excess manganese. Journal of Plant Nutrition, 2013, 36(9): 1355- 1365.
[2] Schutzendubel A, Nikolova P, Rudolf C, Polle A. Cadmium and H2O2-induced oxidative stress in Populus x canescens roots. Plant Physiology and Biochemistry, 2002, 40(6): 577- 584.
[3] Mukhopadhyay M J, Sharma A. Manganese in cell metabolism of higher plants. Botanical Review, 1991, 57(2): 117- 149.
[4] Sytar O, Kumar A, Latowski D, Kuczynska P, Strzalka K, Prasad M N V. Heavy metal-induced oxidative damage, defense reactions, and detoxification mechanisms in plants. Acta Physiologiae Plantarum, 2013, 35(4): 985- 999.
[5] Xue S G, Chen Y X, Luo Y M, Reeves R D, Lin Q. Manganese tolerance and hyperaccumulation ofPhytolaccaacinosaRoxb. Acta Pedologica Sinica, 2004, 41(6): 879- 895.
[6] Jin W, Lu M, Wang R H. The effect of Cr(Ⅲ) to the ultrastructure ofPlatymonassubcordiformis. Journal of Liaoning Normal University: Natural Science, 1998, 21(4): 319- 322.
[7] Ni C Y, Li H, Luo Y M, Chen Y X. The influence of copper, cadmium and their combined pollution on ultrastructure ofCommelinabengalensisLinn. Acta Scientiae Circumstantiae, 2004, 24(2): 343- 348.
[8] Li D H, Shi G X. Effects of Cd2+or Hg2+water pollution on the ultrastructure of nuclei and chloroplasts in somatic cells ofTrapabicornisOsbeck. Journal of Plant Resources and Environment, 1999, 8(2): 43- 48.
[9] Liang W B, Xue S G, Shen J H, Wang P, Wang J. Manganese stress on morphological structures of leaf and ultrastructures of chloroplast of a manganese hyperaccumulator,Phytolaccaamericana. Acta Ecologica Sinica, 2011, 31(13): 3677- 3683.
[10] Baker A J M, Brooks R R. Terrestrial higher plants which hyperaccumulate metallic elements-a review of their distribution. ecology and phytochemistry. Biorecovery, 1989, 1(2): 81- 126.
[11] Demirevska-Kepova K, Simova-Stoilova L, Stoyanova Z, Hölzer R, Feller U. Biochemical changes in barley plants after excessive supply of copper and manganese. Environmental and Experimental Botany, 2004, 52(3): 253- 266.
[12] Fernando D R, Bakkaus E J, Perrier N, Baker A J M, Woodrow I E, Batianoff G N, Collins R N. Manganese accumulation in the leaf mesophyll of four tree species: a PIXE/EDAX localization study. New Phytologist, 2006, 171(4): 751- 757.
[13] Dou C M, Fu X P, Chen X C, Shi J Y, Chen Y X. Accumulation and detoxification of manganese in hyperaccumulatorPhytolaccaamericana. Plant Biology, 2009, 11(5): 664- 670.
[14] Wang H, Tang S M, Liao X J, Cao Q M. Physiological and molecular mechanisms of Mn uptake by hyperaccumulting PlantPolygonumhydropiper(Polygonaceae). Acta Botanica Yunnanica, 2008, 30(4): 489- 495.
[15] Papadakis I E, Giannakoula A, Therios I N, Bosabalidis A M, Moustakas M, Nastou A. Mn-induced changes in leaf structure and chloroplast ultrastructure ofCitrusvolkameriana(L.) plants. Journal of Plant Physiology, 2007, 164(1): 100- 103.
[16] Doncheva S, Georgieva K, Vassileva V, Stoyanova Z, Popov N, Ignatov G. Effects of succinate on manganese toxicity in pea plants. Journal of Plant Nutrition, 2005, 28(1): 47- 62.
[17] Liu H, Xue S G, He Z X, Liu F H, Lei J, Zhou X Y. Germplasm collections and manganese tolerance mechanisms of manganese hyperaccumulator plants. Environmental Science and Technology, 2011, 34(6): 98- 103.
[18] Hoagland D R, Arnon D I. The water culture method for prowling plants without soil. California Agriculture Experimental Station (Circular 347), Berkeley, CA, USA, 1950. 1- 32.
[19] Liang W B, Xue S G, Shen J H, Wang P. Effects of manganese stress on photosythesis and chlorophyll fluorescence parameters ofPhytolaccaamericana. Acta Ecologica Sinica, 2010, 30(3): 619- 625.
[20] Ren L M, Liu P, Cai M Z, Xu G D, Fang X Y, Cheng Z X. Physiological response ofPolygonumhydropiper,Comnyzacanadensis,PolygonumperfoliatumandPhytolaccaamericanato manganese toxicity. Journal of Soil and Water Conservation, 2007, 21(3): 81- 85.
[21] Schmöger M E V, Oven M, Grill E. Detoxification of arsenic by phytochelatins in plants. Plant Physiology, 2000, 122(3): 793- 802.
[22] Klink A, MacioA, Wislocka M, Krawczyk J. Metal accumulation and distribution in the organs ofTyphalatifoliaL. (cattail) and their potential use in bioindication. Marine and Freshwater Biology, 2013, 43(3): 164- 168.
[23] Führs H, Specht A, Erban A, Kopka J, Horst W J. Functional associations between the metabolome and manganese tolerance inVignaunguiculata. Journal of Experimental Botany, 2012, 63(1): 329- 340.
[24] Liu P, Tang X M, Gong C F, Xu G D. Manganese tolerance and accumulation in six Mn hyperaccumulators or accumulators. Plant and Soil, 2010, 335(1/2): 385- 395.
[25] Kochian L V, Hoekenga O A, Pieros M A. How do crop plants tolerate acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency. Annual Review of Plant Biology, 2004, 55(1): 459- 493.
[26] Hauck M, Paul A, Gross S, Raubuch M. Manganese toxicity in epiphytic lichens: chlorophyll degradation and interaction with iron and phosphorus. Environmental and Experimental Botany, 2003, 49(2): 181- 191.
[27] Shao Z Z, Sun F Q. Intracellular sequestration of manganese and phosphorus in a metal-resistant fungusCladosporiumcladosporioidesfrom deep-sea sediment. Extremophiles, 2007, 11(3): 435- 443.
参考文献:
[5] 薛生国, 陈英旭, 骆永明, Reeves R D, 林琦. 商陆(PhytolaccaacinosaRoxb.)的锰耐性和超积累. 土壤学报, 2004, 41(6): 879- 895.
[6] 金伟, 陆敏, 王瑞恒. 铬(Ⅲ)对亚心形扁藻(Platymonassubcordiformis)细胞超微结构的影响. 辽宁师范大学学报: 自然科学版, 1998, 21(4): 319- 322.
[7] 倪才英, 李华, 骆永明, 陈英旭. 铜、镉及其交互作用对泡泡草细胞超微结构的影响. 环境科学学报, 2004, 24(2): 343- 348.
[8] 李大辉, 施国新. Cd2+或Hg2+水污染对菱体细胞的细胞核及叶绿体超微结构的影响. 植物资源与环境学报, 1999, 8(2): 43- 48.
[9] 梁文斌, 薛生国, 沈吉红, 王萍, 王钧. 锰胁迫对垂序商陆叶片形态结构及叶绿体超微结构的影响. 生态学报, 2011, 31(13): 3677- 3683.
[14] 王华, 唐树梅, 廖香俊, 曹启民. 超积累植物水蓼吸收锰的生理与分子机制. 云南植物研究, 2008, 30(4): 489- 495.
[17] 刘恒, 薛生国, 何哲祥, 刘丰豪, 雷杰, 周喜艳. 锰超富集植物种质资源及耐性机制研究进展. 环境科学与技术, 2011, 34(6): 98- 103.
[19] 梁文斌, 薛生国, 沈吉红, 王萍. 锰胁迫对垂序商陆光合特性及叶绿素荧光参数的影响. 生态学报, 2010, 30(3): 619- 625.
[20] 任立民, 刘鹏, 蔡妙珍, 徐根娣, 方旭燕, 程正新. 水蓼、小飞蓬、杠板归和美洲商陆对锰毒的生理响应. 水土保持学报, 2007, 21(3): 81- 85.
Manganese stress on the ultrastructures of a manganese tolerant plant,PolygonumperfoliatumL.
WANG Jun1, WU Hui1, XUE Shengguo1, WU Xue′e1, LIU Ping2,*
1SchoolofMetallurgyandEnvironment,CentralSouthUniversity,Changsha410083,China2ChineseSocietyforEnvironmentalSciences,Beijing100082,China
Manganese (Mn), a typical heavy metal pollutant, is an essential trace element found in various concentrations in all tissues. Manganese is known to be taken up by soil, water, and plants. Mn-contaminated soils and waters are becoming an environmental concern following increased awareness of the need for environmental protection. Soil Mn in particular accumulates easily and cannot be removed naturally in great quantities. Plants exposed to excess Mn often suffer from Mn poisoning, which has many negative effects. In general, excess heavy metal concentrations can induce specific damage to the ultrastructure of plant cells; such damage is expressed primarily as abnormal changes to cell components including the Golgi body, endoplasmic reticulum, nucleus, chloroplast, mitochondria, vacuole, and plasma membrane. Moreover, the extent of damage imparted to cell ultrastructure by heavy metal toxicity increases with both exposure time and heavy metal concentration.
PolygonumperfoliatumL. is a Mn-tolerant plant that can grow on abandoned Mn tailings. Accordingly, it is thought to be promising for the revegetation of land formed from such tailings. Following hydroponic experiments in a greenhouse environment, transmission electron microscopy-energy dispersive spectroscopy (TEM-EDS) was used to investigate changes in the ultrastructure of root, stem, and leaf cells ofP.perfoliatumand to study variations in the form of Mn in leaf cells under various Mn concentrations (5, 1000, and 10000 μmol/L). The results demonstrate the following. (1) For an Mn concentration of 5 μmol/L, the ultrastructure ofP.perfoliatumwas clearly visible, without any obvious damage. The structures of the root, stem, and leaf cells ofP.perfoliatumremained intact, with clearly visible and seemingly undamaged organelles, when the Mn concentration was increased to 1000 μmol/L. (2) Organelles were still present at Mn concentrations greater than 1000 μmol/L. However, the number of mitochondria in the root cells decreased, the double-membrane system and cristae of mitochondria became dim, and the chloroplasts in stem cells began to exhibit signs of damage. Moreover, evidence of damage began to appear in chloroplast membrane structures of leaf cells, where the lamellar structure of grana was poorly developed and the number of osmiophilic granules decreased significantly. Although the chloroplasts and chloroplast membrane structures ofP.perfoliatumhad significant changes under heavy Mn stress, this species could still survive and grow. All these suggested thatP.perfoliatumhad an extraordinary tolerance to Mn. (3) Black agglomerations were observed in the cells after treatment with Mn concentrations of 1000 μmol/L or 10000 μmol/L for 30 days, with more agglomerations observed at higher Mn concentrations. Such features were not noted in the control experiments. For an Mn concentration of 10000 μmol/L, Mn existed as a solid acicular substance within leaf cells and intercellular spaces, possibly indicating a mechanism employed byP.perfoliatumto allow accumulation of Mn while avoiding poisoning. The present study has furthered understanding of the Mn tolerance mechanisms of plants and laid a scientific foundation for adopting tolerant plants for use in the revegetation of polluted soil over large areas. Thus, the results offer promise for further developments in the ecological restoration of Mn tailings wasteland.
PolygonumperfoliatumL.; manganese stress; tolerance; cell; ultrastructure
国家自然科学基金资助项目(40771181);国家公益性(环保)行业科研资助项目(200909065)
2013- 06- 12;
2013- 10- 25
10.5846/stxb201306121691
*通讯作者Corresponding author.E-mail: liup3000@163.com
王钧, 邬卉,薛生国,吴雪娥,刘平.锰胁迫对杠板归细胞超微结构的影响.生态学报,2014,34(4):798- 806.
Wang J, Wu H, Xue S G, Wu X E, Liu P.Manganese stress on the ultrastructures of a manganese tolerant plant,PolygonumperfoliatumL..Acta Ecologica Sinica,2014,34(4):798- 806.
