基于光学CT的三维凝胶剂量验证技术的研究进展
2014-08-08王贤刚
杜 乙,王贤刚
(清华大学 核能与新能源技术研究院,北京 100084)
肿瘤放射治疗(放疗)是利用放射线如放射性同位素产生的α、β、γ射线和各类X射线治疗机或加速器产生的X射线、电子束、质子束及其他粒子束等治疗恶性肿瘤的一种方法。该方法具有定位准确、毒副作用小、适用性广等优点,我国每年接受放疗的癌症患者比例约为65%~75%[1]。
放疗的效果很大程度上取决于靶区定位与剂量交付的准确性。为保证准确性,放疗计划需通过质量保证(QA)措施后方可实施[2]。剂量验证作为放疗QA的重要环节,要求对靶区内人体组织的三维吸收剂量进行精确测量[2]。常见的剂量验证方法有电离室法[3-4]、胶片法[5-6]、热释光片法,独立或搭配组织等效模体(如三维水箱、有机玻璃)使用,以一维点剂量或二维面剂量来验证整个放疗剂量沉积的过程。
目前公认的剂量验证技术的应用标准(RTAP准则)要求验证技术应达到空间分辨率≤1 mm,测量时间≤60 min,测量准确度≤3%,技术精确度≤1%[7]。
早期的放疗技术以共面野照射为代表,照射角度固定,射线能量与束流强度恒定,照射野内剂量分布的几何规则度高,但往往与靶区符合度不高,造成对周围正常组织的不必要损伤。随着临床对放疗精确性要求的不断提高和技术的不断进步,短程放疗、调强放疗、立体定向放疗、图像引导放疗等新型照射技术相继出现,区别于早期共面野技术,这些技术统称为精确放疗技术[8-9],主要特点是多照射角度、多照射野、射线能量与束流强度动态调节、剂量沉积区域与靶区适型度高等[10]。
精确放疗技术在剂量学方面的特点是剂量梯度大、剂量分布复杂,照射期间动态变化。新技术的高给予剂量和复杂照射过程增大了实际交付剂量与预期剂量间出现较大偏差的概率。
新放疗技术的发展和对健康的更加关注,要求QA措施有效落实。在剂量验证环节,传统的采用电离室、热释光片、胶片等设备,配合组织等效模体,通过测量空间参考点剂量或二维面剂量来验证三维分布剂量的技术,受限于剂量计在几何尺寸、剂量响应等方面的固有不足,空间分辨率、能量范围、测量时间等三维测量能力不佳,在理论或实践上,难以应对放疗技术发展所带来的空间复杂分布剂量测量的巨大挑战和RTAP准则的各项要求,这种潜在困难要求以解决多野动态立体照射下剂量信息保存和测定为核心的新型剂量测量手段的出现,以满足三维吸收剂量与剂量梯度测量在准确性、精确度等方面的要求。
为固定三维动态剂量,相关研究人员发展了凝胶剂量计,以达到辐照过程中固定不同空间位置吸收剂量的目的,自1984年首次用于剂量验证技术研究以来[7],受到了研究人员的广泛关注,各项性能也得到了大幅改进。早期的研究人员使用核磁共振成像技术(MR)[11]作为剂量读出手段,并以此发展出了基于MR的三维凝胶剂量验证技术,测量结果稳定,能满足QA的一般要求[12],但应用中存在MR运营成本高、挤占病患医疗资源等弊端,限制了技术的推广。
Gore等[13-14]于1996年首次提出了基于光学CT的新型三维凝胶剂量验证技术,该技术利用凝胶剂量计的光学特性,相较于传统剂量验证手段,多方面性能突出,且具较大的机理研究与性能提升的科研价值和低成本、适宜推广的应用潜质,引起了相关科研人员与放射科医生的广泛兴趣。
本文结合基于光学CT的三维凝胶剂量验证技术的发展历史,从技术角度对基础理论和发展现状进行阐述,重点就常见的凝胶剂量计与光学CT技术路线两方面内容展开论述。
1 基于光学CT的三维凝胶剂量验证技术原理与方法
凝胶剂量计本质上是一种化学剂量计,其研究工作始于20世纪50年代,它是按照特定工艺要求将辐射敏感试剂均匀弥散在形态固定的基底材料中而制成,因最早使用凝胶作为基底材料而得名。辐射敏感试剂在基底材料中的位置较为稳定,受照射时,会随局部沉积剂量的不同而发生不同程度的化学反应,致使剂量计某些参数发生定量变化,以此存储剂量的位置与强度信息。常用的测量参数有弛豫时间、密度、光衰减系数等,针对这些参数相应地发展出了适于MR、X射线CT、光学CT等不同成像技术[15]的剂量测量技术。
凝胶剂量计的研究主要集中在凝胶剂量计的化学组成、辐照中剂量沉积的物理化学机理、性能评估与改进、制备工艺探索等基础理论与应用方法研究。
光学CT技术与X射线CT技术类似,以射线/光线强度在物质中传播发生指数衰减为物理基础,以CT成像为数学基础,获取物质对射线/光线的衰减系数分布,经校正、刻度、标定等操作后,呈现目标信息。与X射线CT的主要区别在于,光学CT使用可见光源,系统设计的自由度大,但易受散射、折射、反射等因素干扰,伪像成因与表现复杂,校正方法需进行专门设计[16]。
光学CT技术的研究围绕以可见光对凝胶剂量计中存储的三维剂量信息进行断层扫描过程中所涉及的系统设计、重建算法、伪像校正、三维剂量表示等技术为核心而展开。
基于光学CT的三维凝胶剂量验证技术是凝胶剂量学与光学CT技术在放疗剂量验证中的结合与应用,利用剂量计辐射前后光衰减系数变化来表征沉积剂量,使用光学CT进行读出,剂量验证过程分为如下4步[17]。
1) 制备组织等效的凝胶剂量计:根据受照部位尺寸制作凝胶剂量计,并与组织等效材料组合,制成半透明的凝胶剂量计模体。
2) 按照放疗计划照射:根据待验证放疗计划和医生处方剂量照射模体。
3) 光学CT扫描模体读出剂量:用光学CT进行扫描,重建得到三维图像,即三维剂量分布。
4) 空间剂量信息表达:根据三维剂量分布绘制剂量分布的二维、三维剂量等值线及剂量梯度,与放疗计划的剂量处方进行比对。
2 常用的凝胶剂量计
放疗剂量验证技术中的凝胶剂量计应具备如下要求:1) 时间与空间稳定性好;2) 组织等效性好;3) 沉积效应与射线能量、剂量率等因素无关;4) 易于制作与储存。
凝胶剂量计分类方法较多,如根据光衰减物理机制不同可将其划分为光吸收型与光散射型2类,更常见的是依据化学组分与剂量沉积机理不同而划分为3类[18]:亚铁类、辐射聚合类、辐射变色塑料(PRESAGETM)。
2.1 亚铁类凝胶剂量计
亚铁类凝胶剂量计出现最早,是在经典的Fricke溶液化学剂量计基础上改进而成的。亚铁类凝胶剂量计依靠Fe2+在受照射后发生定量氧化反应生成Fe3+,致使剂量计光吸收谱线发生偏移,从而将沉积剂量以光吸收系数形式进行三维固定[19]。它通常以明胶为基底材料,以Fe(NH4)2(SO)2·6H2O作为主反应物。
亚铁类凝胶剂量计主要依靠辐射变色存储剂量效应,属于光吸收型剂量计,研究较早,成果丰富,具有基材料衰减系数小、制备工艺简单、反应机理明确、反应灵敏度高、组织等效性好等优点,但其剂量信息载体(Fe3+)扩散现象严重,梯度信息会在数小时内损失掉,时间与温度稳定性较差,不宜长期保存[19]。为克服这些不足,在原Fricke配方基础上,研究人员提出了多种改良方案以减缓扩散速度,并取得了一定成果,如添加二甲酚橙作为螯合剂而得到的FXG剂量计[20]。
2.2 聚合类凝胶剂量计
聚合类凝胶剂量计以丙烯酰胺等单分子聚合物作为辐射敏感试剂,依靠辐射诱变单分子聚合反应,生成散射系数较大的大分子聚合物,导致剂量计的光散射系数发生变化,以此将沉积剂量分布以光散射系数的形式固定下来[17]。
聚合类凝胶剂量计辐照后在外观上会由透明变浑浊,属于光散射型剂量计。在性能上,聚合类剂量计温度与化学稳定性好,可较好地保持剂量梯度信息。由于光衰减主要依靠散射作用,散射信号会对阵列探测器的相邻单元产生影响,影响测量精度与分辨率。
2.3 PRESAGETM剂量计
PRESAGETM剂量计以聚氨酯塑料为基材料,以孔雀蓝等辐射敏感染料为辐射敏感试剂,依靠辐射表色染料辐照前后的光吸收系数变化来表征剂量信息,属吸收型剂量计,于2006年注册成为专利[21]。
PRESAGETM剂量计有许多优良性能[22-23]:首先,由于使用塑料(聚氨酯)作为基材料,模体刚度得以提升,样品无需容器盛放,消除了容器壁产生的反射与折射信号的影响,并能加工成任意形状;其次,由于属于吸收型剂量计,散射影响小,辐射变色试剂在633 nm处存在吸收峰值,非常适合使用He-Ne激光器进行光学CT扫描,提高了测量灵敏度;同时,PRESAGETM剂量计的扩散效应小,不会被空气氧化,稳定性显著,利于长期保存。
PRESAGETM剂量计也存在一定不足,如组织等效性不如凝胶;基材刚度较大,制备时易产生内部裂纹,形成散射/折射核而引起伪像。
3类常用凝胶剂量计的性能列于表1[18]。除上述3种剂量计外,还有交联凝胶剂量计[24-26]等多种新型凝胶剂量计,关于新型凝胶剂量计的开发研究一直在积极开展中。

表1 3种凝胶剂量计的性能
3 三维光学CT剂量读出技术发展及研究现状
1996年Gore等[13]设计出了第一台用于凝胶剂量计扫描的三维光学CT实验样机。
与X射线CT技术类似,光学CT扫描方式也有笔形束扫描、平行束扫描和锥形束扫描。早期受探测器技术限制,系统设计以笔形束扫描为主,随着技术的进步,研究人员先后提出了基于阵列探测器的锥形束与平行束扫描技术方案。
3.1 笔形束扫描
早期的光学CT系统普遍采用笔形束扫描方式,如图1所示。它以激光器作为点光源(如He-Ne激光器)、以光电二极管为点探测器,进行笔形束/平行束扫描,并在旋转-升降系统的配合下,完成三维数据采集。为减少光学界面的干扰,光学CT系统将样品置于装有匹配液的水箱中。

图1 笔形束扫描方案示意图
类似于第一代CT扫描方式,笔形束扫描的光学CT系统探测器一致性好、信噪比高、折射少、测量准确度好、视野不受探测器尺寸限制、对样品光衰减类型无要求,是光路分析、误差与伪像分析的优秀研究平台。但此类系统存在扫描耗时长、分辨率受限等不足,虽不断有改进方案出现,如以镜面旋转取代光源-探测器平移的扫描方式[16],但性能提升有限。
3.2 锥形束扫描
Wolodzko等[27]于1999年首次提出了采用面光源的锥形束扫描方案。如图2所示。与笔形束扫描相比,锥形束扫描的入射光线呈锥形穿过被测样品,无升降-平移环节,每次扫描获取二维阵列投影数据,极大地缩短了数据采集时间,扫描时间仅为几min[28-29]。由于阵列探测器的像素单元小、像素高、投影数据密集度高,具有高分辨率测量的潜质,但易受散射信号影响,故不适合测量光散射型样品,同时由于样品内光路呈锥形束分布,在重建图像前的投影数据预处理环节中需加入几何校正部分,否则重建图像中会出现径向几何畸变。

图2 锥形束扫描方案示意图
3.3 平行束扫描
Doran等[30]于2001年首次提出了采用聚焦透镜的平行束扫描方案,如图3所示。该方案将点光源经聚焦透镜后形成平行光场,入射光线平行穿过被测样品,以阵列探测器(如CCD相机)采集投影,每次扫描获取二维阵列投影数据。

图3 平行束扫描方案示意图
相较于锥形束扫描,平行束扫描同样具有扫描快速、探测像素小的优点与高分辨率测量的潜质,也不适合扫描光散射型样品。聚焦透镜的使用,使样品内光路相互平行,消除了与入射角度有关的径向畸变问题,但增加了图像链的长度与系统的复杂度[31-32]。
以上3种扫描方式的部分通用参数列于表2。
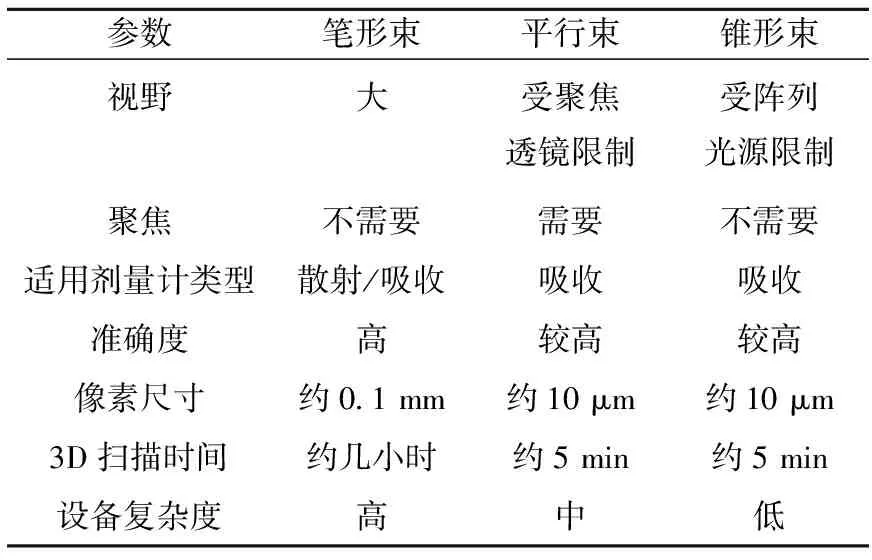
表2 3种扫描方式参数
4 三维凝胶剂量验证研究中需研究的科学问题
基于凝胶剂量计-光学CT的放疗剂量验证技术经10余年发展,积累了许多研究成果,但依然存在多方面问题未能得到很好解决,目前的研究热点也多围绕这些方面而展开。
4.1 凝胶剂量计研究
凝胶剂量计本质上是一种化学剂量计,也是三维凝胶剂量验证技术的重要组成部分,不同化学组分、不同制备条件、不同剂量响应机理均会影响剂量计的各项性能,并最终影响系统的测量精度[33]。辐照过程中的剂量沉积与固定机理探索是一个重要的基础研究方向,改进或开发性能更加优良的新型凝胶剂量计是凝胶剂量学的研究热点,同时也是提高系统性能的重要手段。
4.2 扫描方案与系统设计
一般而言,X射线CT扫描方法均可用在光学CT上,如螺旋扫描、偏置扫描等,同时可见光源与探测器的形式多于X射线CT,如不同波长的单色光源、多种CCD和CMOS探测器,光路走向也可借助相关器件进行调节,如平面镜、聚焦透镜,这增加了光学CT方案设计的自由度,故光学CT在扫描方案和系统设计方面存在很大的灵活性[34]。
新型优化的系统设计一直是光学CT的主要研究方向之一。例如,目前的系统设计普遍使用匹配水箱来消除介质面对光传播的影响,但诸如匹配液不易配置、水箱壁面沾污等问题会引起严重伪像,为此研究人员提出了“干式”扫描的概念。干式扫描更方便用户使用,相关研究工作也取得了一定进展[35]。
4.3 重建算法与迭代重建算法
光学CT中,入射光线往往会由于物质散射与截面折射而发生光路偏折,从而引起局部测量偏差,传统的滤波反投影算法会在反投影过程中将这种局部偏差扩展至整条投影线,导致重建图像中出现环形或带状伪像[36]。采用滤波或平滑的方法虽能缓解某些伪像的影响,但牺牲了图像边缘信息,不利于了解剂量梯度变化和绘制等剂量曲线。
相较于滤波反投影算法,迭代重建算法可将系统中实际存在的某些物理干扰因素通过建模的方法融合进系统矩阵,重建过程即可实现物理修正,同时,选择合适的目标函数,可对噪声、测量偏差乃至坏数据的影响进行抑制,并对边缘信息进行合理增强[37],非常适合光学CT图像重建与剂量分布信息获取。
目前,大部分研究人员在使用光学CT进行图像重建时,仍沿用传统的滤波反投影算法,而近年来在X射线CT领域取得较大发展的迭代重建算法并未在光学CT中得到较好应用。如何结合光学CT中光线传播机制与图像感兴趣信息建立相应的迭代重建算法,尚需系统而细致的深入研究。
4.4 伪像成因与校正方法研究
伪像问题作为影响图像质量的重要因素,一直是CT领域的研究热点。一般而言,基于射线衰减规律和反投影重建的几种常见伪像,如环形、带状、硬化伪像,均会在光学CT中出现。同时,光学CT中特有的光反射、折射和散射现象,在不同光介面作用下,均可能引起特殊形态的伪像,如径向几何畸变、拱形伪像[28-29]。此外,一些外界因素,如光路中的障碍物、外界杂散光线、环境条件变化引起的系统漂移等,也可能会形成伪像[38]。
光学CT中伪像形成的机理分析研究与相应的校正算法研究,对光学CT的测量结果和图像质量影响巨大,同样是目前光学CT研究中的主要问题之一。
5 结论
基于光学CT的三维凝胶剂量验证技术,采用凝胶剂量计固定三维剂量分布、光学CT扫描读出剂量分布信息,并给出交付剂量的等剂量曲线,在三维剂量分布验证方面具有很大优势,可能成为临床剂量验证的有效手段。同时,该方法作为辐射物理、凝胶化学、光学技术与CT成像技术的交叉领域,尚有一系列科学问题需进行深入探讨,具有很大的研究和发展潜力。
参考文献:
[1] SHAW E, KLINE R, GILLIN M, et al. Radiation therapy oncology group: Radiosurgery quality assurance guidelines[J]. International Journal of Radiation Oncology, Biology, Physics, 1993, 27(5): 1 231-1 239.
[2] IBBOTT G S. QA in radiation therapy: The RPC perspective[J]. Journal of Physics: Conference Series, 2010, 250(1): 012001.
[3] LÉTOURNEAU D, GULAM M, YAN D, et al. Evaluation of a 2D diode array for IMRT quality assurance[J]. Radiotherapy and Oncology, 2004, 70(2): 199-206.
[4] GUTIÉRREZ A N, CALVO O. Diode arrays and QA of advanced techniques[J]. Journal of Physics: Conference Series, 2010, 250(1): 012049.
[5] ZHU X R, JURSINIC P A, GRIMM D F, et al. Evaluation of Kodak EDR2 film for dose verification of intensity modulated radiation therapy delivered by a static multileaf collimator[J]. Medical Physics, 2002, 29(8): 1 687-1 692.
[6] MOUTSATSOS A, PETROKOKKINOS L, ZOURARI K, et al. Gamma knife relative dosimetry using VIP polymer gel and EBT radiochromic films[J]. Journal of Physics: Conference Series, 2009, 164(1): 012053.
[7] OLDHAM M, SIEWERDSEN J H, KUMAR S, et al. Optical-CT gel-dosimetry, Ⅰ: Basic investigations[J]. Medical Physics, 2003, 30: 623-534.
[8] BUCCI M K, BEVAN A, ROACH M. Advances in radiation therapy: Conventional to 3D, to IMRT, to 4D, and beyond[J]. CA: A Cancer Journal for Clinicians, 2005, 55(2): 117-134.
[9] GERBER D E, CHAN T A. Recent advances in radiation therapy[J]. American Family Physician, 2008, 78(11): 1 254-1 262.
[10] IKUSHIMA H. Radiation therapy: State of the art and the future[J]. The Journal of Medical Investigation, 2010, 57(1): 2-11.
[11] GORE J C, KANG Y S. Measurement of radiation dose distributions by nuclear magnetic resonance (NMR) imaging[J]. Physics in Medicine and Biology, 1984, 29(10): 1 189-1 197.
[12] DING X, OLSEN J, BEST R, et al. High resolution polymer gel dosimetry for small beam irradiation using a 7T micro-MRI scanner[J]. Journal of Physics: Conference Series, 2010, 250(1): 012094.
[13] GORE J C, RANADE M, MARYANSKI M J, et al. Radiation dose distributions in three dimensions from tomographic optical density scanning of polymer gels, Ⅰ: Development of an optical scanner[J]. Physics in Medicine and Biology, 1996, 41(12): 2 695-2 704.
[14] MARYANSKI M J, ZASTAVKER Y Z, GORE J C. Radiation dose distributions in three dimensions from tomographic optical density scanning of polymer gels, Ⅱ: Optical properties of the BANG polymer gel[J]. Physics in Medicine and Biology, 1996, 41(12): 2 705-2 717.
[15] JIRASEK A. Alternative imaging modalities for polymer gel dosimetry[J]. Journal of Physics: Conference Series, 2010, 250(1): 012070.
[16] DORAN S J. The history and principles of optical computed tomography for scanning 3-D radiation dosimeters: 2008 update[J]. Journal of Physics: Conference Series, 2009, 164(1): 012020.
[17] BALDOCK C, De DEENE Y, DORAN S, et al. Polymer gel dosimetry[J]. Physics in Medicine and Biology, 2010, 55(5): R1-R63.
[18] DORAN S J. The history and principles of chemical dosimetry for 3-D radiation fields: Gels, polymers and plastics[J]. Applied Radiation and Isotopes, 2009, 67(3): 393-398.
[19] SCHREINER L J. Review of Fricke gel dosimeters[J]. Journal of Physics: Conference Series, 2004, 3 (1): 9-21.
[20] HEALY B, BRINDHA S, ZAHMATKESH M, et al. Characterisation of the ferrous-xylenol orange-gelatin (FXG) gel dosimeter[J]. Journal of Physics: Conference Series, 2004, 3(1): 142-145.
[21] ADAMOVICS J A. Three-dimensional dosimeter for penetrating radiation and method of use: US, 7098463[P]. 2006-08-29.
[22] SAKHALKAR H S, ADAMOVICS J, IBBOTT G, et al. A comprehensive evaluation of the PRESAGE/optical-CT 3D dosimetry system[J]. Medical Physics, 2009, 36: 71-82.
[23] MOSTAAR A, HASHEMI B, ZAHMATKESH M H, et al. A basic dosimetric study of PRESAGE: The effect of different amounts of fabricating components on the sensitivity and stability of the dosimeter[J]. Physics in Medicine and Biology, 2010, 55(3): 903-912.
[24] BABIC S, BATTISTA J, JORDAN K. Micelle hydrogels for three-dimensional dose verification[J]. Journal of Physics: Conference Series, 2009, 164(1): 012044.
[25] JORDAN K, AVVAKUMOV N. Radiochromic leuco dye micelle hydrogels, Ⅰ: Initial investigation[J]. Physics in Medicine and Biology, 2009, 54(22): 6 773-6 789.
[26] BABIC S, BATTISTA J, JORDAN K. Radiochromic leuco dye micelle hydrogels, Ⅱ: Low diffusion rate leuco crystal violet gel[J]. Physics in Medicine and Biology, 2009, 54(22): 6 791-6 808.
[27] WOLODZKO J G, MARSDEN C, APPLEBY A. CCD imaging for optical tomography of gel radiation dosimeters[J]. Medical Physics, 1999, 26: 2 508-2 513.
[28] OLDING T, HOLMES O, SCHREINER L J. Cone beam optical computed tomography for gel dosimetry, Ⅰ: Scanner characterization[J]. Physics in Medicine and Biology, 2010, 55(10): 2 819-2 840.
[29] OLDING T, SCHREINER L J. Cone-beam optical computed tomography for gel dosimetry, Ⅱ: Imaging protocols[J]. Physics in Medicine and Biology, 2011, 56(5): 1 259-1 279.
[30] DORAN S J, KOERKAMP K K, BERO M A, et al. A CCD-based optical CT scanner for high-resolution 3D imaging of radiation dose distributions: Equipment specifications, optical simulations and preliminary results[J]. Physics in Medicine and Biology, 2001, 46(12): 3 191-3 213.
[31] THOMAS A, NEWTON J, ADAMOVICS J, et al. Commissioning and benchmarking a 3D dosimetry system for clinical use[J]. Medical Physics, 2011, 38: 4 846-4 857.
[32] THOMAS A, OLDHAM M. Fast, large field-of-view, telecentric optical-CT scanning system for 3D radiochromic dosimetry[J]. Journal of Physics: Conference Series, 2010, 250(1): 012007.
[33] JORDAN K. Review of recent advances in radiochromic materials for 3D dosimetry[J]. Journal of Physics: Conference Series, 2010, 250(1): 012043.
[34] BALDOCK C. Historical overview of the development of gel dosimetry: Another personal perspective[J]. Journal of Physics: Conference Series, 2009, 164(1): 012002.
[35] RAMM D, RUTTEN T P, SHEPHERD J, et al. Optical CT scanner for in-air readout of gels for external radiation beam 3D dosimetry[J]. Physics in Medicine and Biology, 2012, 57(12): 3 853-3 868.
[36] OLDHAM M, KIM L. Optical-CT gel-dosimetry, Ⅱ: Optical artifacts and geometrical distortion[J]. Medical Physics, 2004, 31: 1 093-1 104.
[37] BEISTER M, KOLDITZ D, KALENDER W A. Iterative reconstruction methods in X-ray CT[J]. Physica Medica, 2012, 28(2): 94-108.
[38] OLDHAM M. 3D dosimetry by optical-CT scanning[J]. Journal of Physics: Conference Series, 2006, 56(1): 58-71.
