联苯菊酯与肿瘤相关DNA相互作用的光谱研究*
2014-08-08卜晓阳何宝佳杨小弟
卜晓阳,李 萍,何宝佳,杨小弟
(1.皖南医学院 药学院,安徽 芜湖241002;2.南京师范大学 化学与材料科学学院,江苏 南京210097)
联苯菊酯(Bifenthrin,结构式见图1)是一种典型的拟除虫菊酯类农药,此类农药因具有高效、安全、广谱等特点,被广泛使用于农业生产和家庭生活中.拟除虫菊酯农药作为一种神经毒物,其作用机制一直是毒理学研究的热点.研究发现多种疾病的发生与拟除虫菊酯农药的暴露有关,它具有一定的慢性毒性,是人类健康潜在的威胁物[1-2].有些拟除虫菊酯农药品种甚至有致癌、致畸、致基因突变作用[3-4].肿瘤的发生大部分是与人体内某些基因的异常表达有关.p53 DNA是一种肿瘤抑制基因,人体中功能正常的p53 DNA能阻止多种肿瘤发生,而p53 DNA自身结构的改变是导致其抑癌功能丧失的主要原因[5].另外,C-myc DNA是一种癌基因,能促进细胞分裂,研究表明多种肿瘤疾病中都发现有C-myc DNA的表达异常[6-7].
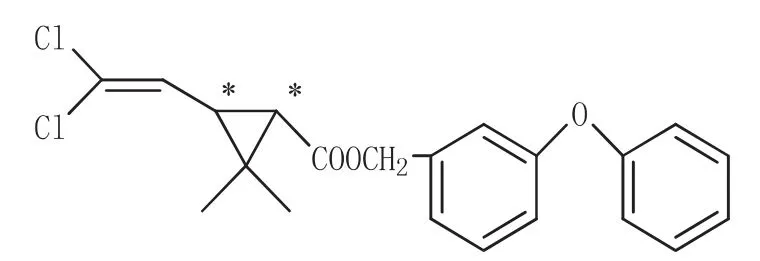
图1 联苯菊酯的结构式(BF)
本文主要利用光谱学手段探讨联苯菊酯与两种肿瘤基因之间的作用机制,主要是研究两者之间的作用模式和对DNA空间结构的影响,以期从分子水平上了解联苯菊酯对人类肿瘤相关基因的影响,为揭示农药生物毒理性和肿瘤疾病的预防和治疗提供新的线索.
1 实验部分
1.1 仪器与试剂
Cary-5000紫外光谱仪(美国Varian公司);LS50B型荧光光谱仪(美国 Perkin Elmer公司);SevenMulti pH离子综合测试仪(瑞士Mettler Toledo公司);HH-2数显式恒温水浴锅(常州国华电器公司).实验所用DNA(上海生工生物技术公司)序列为:p53 DNA ss1:5′-CCTCCTCCCCAACTCC-3′;ss2:3′-GGAGGAGGGGTTGAGG-5′;C-myc DNA:ss1:5 ′-GGGAGGGTGGGGAAGG-3 ′;ss2:3 ′-CCCTCCCACCCCTTCC-5.联苯菊酯为标准品(德国Dr.Ehrenstorfer公司);溴化乙啶(EB)(上海生工生物技术公司);其它试剂均为分析纯;水为娃哈哈纯净水.
1.2 双链DNA的配置
用2条互补单链DNA(5×10-4mol/L)配置成双链DNA的磷酸盐缓冲液(0.5mol/L,pH=7.3),在85℃下,退火12min,缓慢冷却到25℃,得到双链DNA溶液浓度为5×10-4mol/L.
1.3 实验方法
紫外光谱实验:用0.1mol/L磷酸盐缓冲液(pH=7.3)配制联苯菊酯溶液,得到联苯菊酯溶液浓度为1.0×10-4mol/L和5.0×10-4mol/L,逐渐将不同体积的联苯菊酯溶液滴加到500μL浓度为5.0×10-6mol/L DNA的磷酸盐缓冲液(pH=7.3)中,使DNA与联苯菊酯的摩尔比为4:1~1:4,测量DNA溶液在190~500nm处紫外吸收光谱的变化.参比溶液为0.1mol/L磷酸盐缓冲液(pH=7.3).
变温实验:将5.0×10-6mol/L的DNA溶液和5.0×10-4mol/L的联苯菊酯溶液等摩尔混合,在37℃下恒温3h,然后进行程序升温.参比溶液为0.1mol/L磷酸盐缓冲液.测定在25~90℃温度范围内溶液在260nm处的吸光度(A260nm).升温速率为2℃/min.
EB-DNA荧光猝灭实验:将DNA与EB溶液混合得到EB-DNA混合体系,再分别加入不同剂量的联苯菊酯溶液,使联苯菊酯与DNA的摩尔比为1:1 ~8:1,测定联苯菊酯加入后对 EB-DNA 体系的荧光影响情况.荧光激发和发射狭缝宽度均为5nm.
离子强度影响实验:将DNA与EB、NaCl三种溶液混合,得到NaCl-EB-DNA的三元溶液体系,滴加不同体积的联苯菊酯溶液,使联苯菊酯与DNA摩尔比为1:1~8:1,测其对该三元溶液体系的荧光影响.与EB-DNA体系的猝灭效应作比较.荧光激发和发射狭缝宽度均为5nm.
2 结果与讨论
2.1 联苯菊酯与DNA相互作用的紫外滴定实验
将不同体积的联苯菊酯逐渐滴加至DNA溶液中,DNA溶液的紫外吸收光谱变化如图2所示.由图可见,随着DNA与联苯菊酯的浓度比从4:1递减至1:4,DNA在260nm处的特征吸收峰呈减色效应,但吸收峰的位置无明显位移,一般来说,对于典型的嵌插,由于DNA的π电子和小分子的π电子会发生堆积作用,可出现紫外减色效应和红移现象,如果是静电或沟槽作用就会表现为吸收峰小幅红移但强度无明显改变.图中,联苯菊酯加入后,DNA的紫外吸收峰呈有规律的减色但无红移现象,这说明联苯菊酯和两种DNA之间均存在相互作用,但并非完全的嵌插作用,可能为较弱的部分嵌插.

图2 DNA与联苯菊酯按4:1~1:4浓度比混合后溶液的紫外吸收光谱A:p53 DNA;B:C-myc DNA
2.2 联苯菊酯与DNA相互作用的紫外升温实验
DNA熔点温度(Tm)的变化可以用来判断其双螺旋结构的稳定性.小分子与DNA结合模式会影响DNA的Tm.典型的嵌插作用能提高DNA双螺旋稳定性,会使其Tm值升高7~8℃;本实验中,在25~90℃范围内,通过紫外光谱仪的程序升温,测定联苯菊酯加入前后DNA在260nm处紫外吸收峰强度的变化,并利用Boltzmann函数拟合计算出DNA的解链温度Tm,结果如表1所示.由表1看出,联苯菊酯的加入使p53 DNA的Tm升高3.6℃;使C-myc DNA的Tm升高1.9℃,这可能由于联苯菊酯以弱的嵌插作用与两种DNA作用,一定程度上增强了DNA结构的稳定性.并且p53 DNA的Tm变化较C-myc DNA的更大,说明联苯菊酯与p53 DNA的结合能力更强.
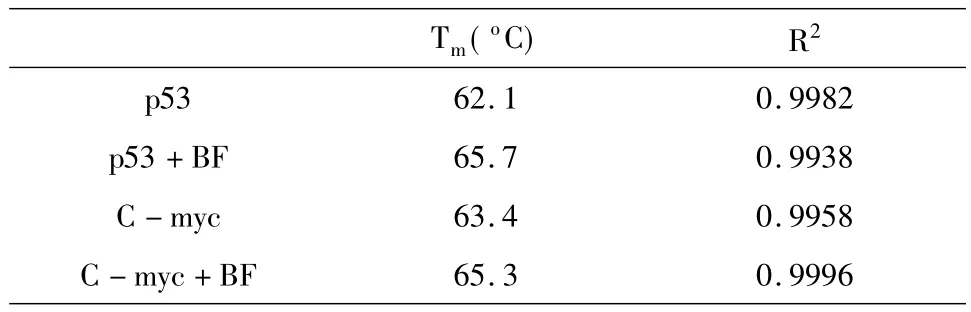
表1 加入有机氯农药分子前后的DNA的Tm值
2.3 联苯菊酯与DNA相互作用的EB-DNA荧光猝灭实验
溴化乙锭(EB)是一种荧光染料,它能典型地嵌入双螺旋DNA的碱基对中使其荧光显著增强.本实验利用EB作为p53 DNA和C-myc DNA的荧光探针,向EB-DNA溶液中逐步加入联苯菊酯,根据EB-DNA体系是否发生荧光猝灭来判断联苯菊酯能否竞争置换出EB,从而与DNA发生嵌插作用.联苯菊酯与EB-DNA体系的荧光猝灭图谱见图3.
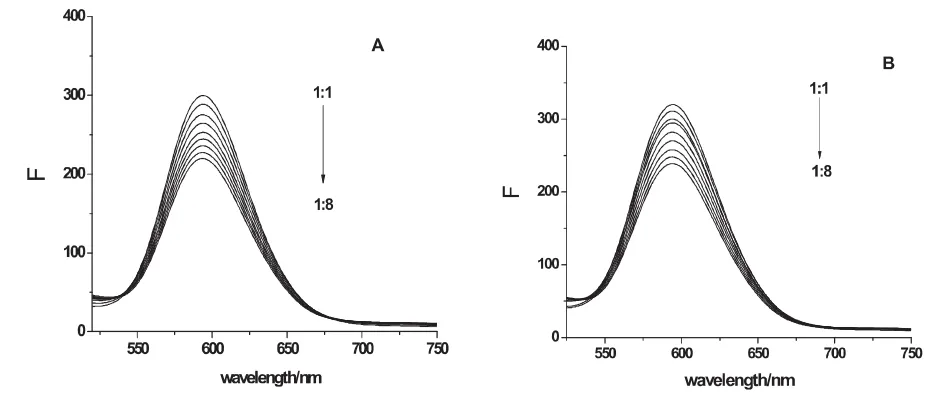
图3 联苯菊酯与EB-DNA荧光猝灭图谱
由图可见,联苯菊酯加入后,EB-DNA体系的荧光逐渐减弱,当DNA与联苯菊酯的摩尔比从1:1减小到1:8时,EB-p53体系发生25.43%的猝灭,EB-C-myc体系发生22.89% 的猝灭,当联苯菊酯浓度继续增大后,EB-DNA体系荧光无明显减小,这说明联苯菊酯对EB的竞争作用已达饱和,联苯菊酯无法完全竞争出嵌插进DNA中的EB,只能发生部分嵌插作用.
由 Stern-Volmer方程(F0/F=1+Kq·τ0[Q],F0为EB-DNA系的初始荧光强度,F为EB-DNA体系加入联苯菊酯溶液后的最终荧光强度,Kq为猝灭速率,[Q]为猝灭剂浓度,τ0为生物分子的荧光寿命,约为10ns)计算相关常数(Ksv:猝灭常数;Kq:猝灭速率;n:结合位点数),结果见表2.表中联苯菊酯与EB-DNA体系结合位点均小于1,猝灭常数较小等数据进一步证实联苯菊酯与DNA为弱的部分嵌插结合.

表2 联苯菊酯与EB-DNA体系作用的相关常数
2.4 联苯菊酯与DNA相互作用的离子强度影响实验
紫外滴定实验和EB-DNA竞争实验的结果表明联苯菊酯与DNA之间存在着嵌插作用,而小分子与DNA的相互作用有可能受多种作用的共同影响.当小分子与DNA之间是以静电作用时,改变离子强度,引入的带电正离子可以中和DNA磷酸骨架上的负电荷,竞争了小分子与DNA的嵌插作用,从而减弱荧光猝灭程度.因此可以在荧光实验中改变溶液的离子强度,以此来判断小分子与DNA分子之间是否有静电作用.本实验利用强电解质NaCl来控制联苯菊酯与DNA体系的离子强度,实验结果如表3所示.表中猝灭率(Quenching rate)=(F0-F)/F0×100%,其中F0为NaCl-EB-DNA的初始荧光强度,F为NaCl-EB-DNA体系加入联苯菊酯溶液后的最终荧光强度.

表3 NaCl对联苯菊酯与EB-DNA体系作用的影响
结果表明,加入NaCl以后,两种DNA体系均增大了3%左右,说明加入NaCl增强了联苯菊酯对EB-DNA体系的猝灭行为.这说明离子强度没有竞争影响联苯菊酯与DNA间的结合作用,它们之间不存在静电作用,可能由于加大离子强度为联苯菊酯提供了更好的疏水环境,这样有利于联苯菊酯与DNA双螺旋之间的嵌插作用,导致了荧光猝灭现象轻微的加强.
3 结论
运用紫外和荧光光谱法探讨联苯菊酯与两种肿瘤相关DNA之间的相互作用,紫外滴定实验结果出现减色现象和无明显红移,表明联苯菊酯和DNA之间可能是非完全的嵌插作用.紫外变温实验表明,联苯菊酯的结合能引起DNA熔点温度升高,增强了DNA分子的热稳定性.EB竞争实验进一步证明DNA与联苯菊酯是部分嵌插结合;离子强度实验说明联苯菊酯与DNA之间不存在静电作用.综上所述,联苯菊酯与两种肿瘤相关DNA均以弱的嵌插作用结合,且与p53 DNA的结合能力稍强于与C-myc DNA的结合能力.
[1]ZHANG Z Y,WANG D L,CHI Z J,et al.Acute to xicity of organophos phorus and pyreth roid insect icides tobombyxmori[J].Journal of Economic Entomology,2008,101(2):360-364.
[2]姚克文,王介东.拟除虫菊酯类农药的男(雄)性生殖毒性研究进展[J].中华男科学杂志,2008,14(3):268-271.
[3]TYI.FR C R,BERESFORD N,VANDER W M,et a1.Metabollsm and environmental degradation of pyrethroid insectieidas produce compounds with endocrine activitles[J].Environmental Toxicology and Chemistry,2000,19(4):801-809.
[4]陈海燕,王心如,肖继皋,等.有机磷均拟除虫菊酯农药的拟雌激素活性研究[J].中华劳动卫生职业病杂志,2001,19(4):274-277.
[5]D W Meek.Tumour Suppression by p53:A Role for the DNA Damage Response[J].Nat Rev Cancer,2009,9(10):714-723.
[6]I Ninomiya,Y Yonemura,H Matsumoto.Expression of C-myc Gene Product in Gastric Carcinomas[J].Oncology,1991,48(2):149-152.
[7]李莉,鲁嘉,刘雪梅,等.光谱法研究三氯生与人类肿瘤相关DNA 的相互作用[J].分析测试学报,2012,31(8):951-956.
