SIRT1通过降低NF-κB p65乙酰化减轻高糖应激引起的大鼠肾小球系膜细胞损伤*
2014-08-08杜月光柴可夫钱俊文章科娜
杜月光, 柴可夫, 钱俊文, 章科娜
(浙江中医药大学 1病理学教研室, 2中医临床基础研究所,浙江 杭州 310053)
糖尿病肾病(diabetic nephropathy, DN)是糖尿病的微血管并发症,也是终末期肾病的主要原因。目前认为糖脂代谢紊乱引起的炎症反应和氧化应激在糖尿病肾病的发病中起重要作用,并成为DN防治的重要靶点[1]。沉默信息调节因子1(silent information regulator 1, SIRT1)是一种依赖烟酰胺腺嘌呤二核苷酸的组蛋白去乙酰化酶,与细胞衰老、寿命延长、抗氧化应激和能量代谢调节等细胞多种功能活动有关[2]。研究表明SIRT1可使NF-κB RelA/p65 亚单位去乙酰化,进而抑制NF-κB活性,从而起到抗炎作用[3-4],因此研究认为SIRT1可作为抗炎治疗的潜在靶点。本项目通过高糖刺激大鼠肾小球系膜细胞,观察在系膜细胞高糖应激过程中SIRT1的表达变化,并通过SIRT1的激活剂和RNAi干扰技术影响SIRT1表达,观察其对氧化应激及炎症因子的影响,从而探讨SIRT1在系膜细胞高糖应激损伤中的作用,为进一步研究其在糖尿病肾病中的作用奠定基础。
材 料 和 方 法
1 材料
大鼠肾小球系膜细胞株(rat mesangial cells, RMC)由杭州市中医院肾病中心惠赠;限制性内切酶AgeⅠ/EcoRⅠ和T4 DNA 连接酶(NEB);慢病毒载体系统包括pTRC-EGFP、pHelper1.0和pHelper2.0载体(杭州浩基生物公司);质粒DNA提取试剂盒(Qiagen);SuperscriptTMII RTase(Invitrogen);实时荧光定量PCR试剂盒SYBR® Premix Ex TaqTMPerfect Real Time(Takara);总超氧化物岐化酶(superoxide dismutase,SOD)活性检测试剂盒(NBT法,碧云天公司);丙二醛(malondialdehyde,MDA)(Uscn E90597Ge);MTT细胞增殖及细胞毒性检测试剂盒(碧云天公司);转化生长因子β1(transforming growth factor β1,TGF-β1)(MB100B)、血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM-1-1)(MVC00)、单核细胞趋化蛋白1(monocyte chemoattratant protein 1,MCP-1)(MJE00)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)(RTA00)ELISA检测试剂盒(R&D);抗SIRT1抗体(Abcam);抗乙酰化NF-κB p65 抗体(Santa Cruz)。
2 方法
2.1细胞培养及siRNA转染 RMC用含10% FBS和青、链霉素的低糖DMEM培养。构建pTRC-shSIRT1质粒,应用Superfectin II转染试剂将pTRC-shSIRT1转染HEK293T细胞,离心及过滤去除上清液中的细胞碎片后,收集病毒液,之后将适量逆转录病毒转染至RMC,并以2 mg/L polybrene 提高转染效率。
2.2分组及干预 实验按以下分组处理:正常对照组(含1 g/L 葡萄糖的DMEM培养液)、甘露醇组(含27.8 mmol/L甘露醇的DMEM 培养液)、高糖组(含4.5 g/L 葡萄糖的DMEM 培养液)、白藜芦醇组(用1 μmol/L白藜芦醇的完全培养基培养24 h后,换用高糖培养基培养)和SIRT1 RNAi组(添加干扰病毒感染24 h后,换用高糖培养基培养)。
2.3MTT比色法检测细胞活性 选择对数生长终末期,且生长状态良好的RMC,按照5×106/L的密度接种到96孔板内,过夜培养。更换培养基为无血清RPMI-1640 培养液, 继续培养24 h, 按要求分组处理。在避光条件下,每孔加入MTT,继续培养4 h,每孔加入100 μL Formanzan溶解液,在细胞培养箱内再继续孵育一定时间后,使紫色结晶全部溶解,于酶标仪上测定570 nm 处的吸光度(A) 值。
2.4细胞SOD含量的检测 收集细胞,用细胞裂解液裂解细胞,4 ℃离心,收集上清液,按照SOD检测试剂盒说明书操作,测定SOD活性。
2.5ELISA检测细胞上清液MDA、MCP-1、VCAM-1、TNF-α和TGF-β1的含量 收集细胞培养上清液,按照MCP-1、VCAM-1、TNF-α、TGF-β1和MDA ELISA试剂盒说明书操作,测定各指标浓度。
2.6Real-time PCR检测SIRT1、MCP-1、VCAM-1、TNF-α和TGF-β1mRNA转录水平 收集细胞用Trizol提取RNA,测定并计算RNA的纯度和浓度;取RNA在逆转录酶的作用下合成cDNA。用SYBR Green嵌合荧光法进行实时PCR扩增。采用Primer Premier 6.0和Beacon Designer软件进行荧光引物的设计,由上海生物工程有限公司负责合成,引物序列见表1。

表1 引物序列
反应体系中包括:ddH2O 10.5 μL,SYBR Premix EX TaqTM(2×) 12.5 μL,上游引物(10 μmol/L) 0.5 μL,下游引物(10 μmol/L) 0.5 μL,模板cDNA 1.0 μL,总体系量25 μL。反应条件为:预变性95 ℃ 1 min,95 ℃ 10 s,62 ℃ 25 s,共进行45个循环。每次在延伸阶段读取吸光度。每个样品重复3次。取其循环阈值(Ct)均值,分别计算各组的ΔCt(Ct内参照基因-Ct目的基因),再以正常组细胞为1进行均一化,以2-ΔΔCt表示基因的相对表达水平。
2.7Western blotting法检测SIRT1和乙酰化NF-κB蛋白的表达 采用总蛋白提取试剂盒提取细胞总蛋白,用BCA法对提取的蛋白进行浓度测定。取60 μg总蛋白进行SDS-PAGE。电泳完毕后将蛋白转移到PVDF膜上。将膜放入T-TBS(含5%脱脂奶粉)封闭1 h后,分别加入Ⅰ抗4 ℃孵育过夜(SIRT1 1∶1 000,乙酰化NF-κB 1∶500)洗膜,然后用Ⅱ抗(1∶5 000)室温孵育1 h,在暗室中用增强化学发光检测试剂显色,拍片晾干,计算机扫描,采用Bandscan 5.0软件分析条带的吸光度。目的蛋白相对表达量=目的蛋白吸光度值/内参照β-actin吸光度值。
3 统计学处理
用SPSS 11.0统计软件处理,数据以均数±标准差(mean±SD)表示,采用单因素方差分析比较各组间的差异,以P<0.05为差异有统计学意义。
结 果
1 各组细胞活力比较
高糖刺激造成RMC的活力下降,和正常对照组比较有显著差异(P<0.01)。白藜芦醇干预可有效抑制高糖诱导引起的细胞活力下降(P<0.05)。SIRT1干扰可引起RMC的活力降低,和正常对照组比较有显著差异(P<0.01),见图1。

Figure 1. The viability of RMC with different treatments.Mean±SD. n=3.**P<0.01 vs control;△△P<0.01 vs high glucose.
2 各组细胞MDA含量及SOD活性的比较
高糖诱导引起RMC MDA分泌增加,SOD活性降低,和正常对照组比较有显著差异(分别P<0.05和P<0.01)。白藜芦醇可以保护细胞的SOD活性,抑制高糖刺激引起的MDA分泌(P<0.01)。SIRT1 RNAi使高糖诱导的RMC MDA含量增加,SOD活性降低,和正常对照组比较有显著差异(P<0.05),见表2。
3 各组细胞SIRT1、MCP-1、VCAM-1、TNF-α和TGF-β1 mRNA 表达的比较
高糖刺激造成RMC的MCP-1、VCAM-1、TNF-α和TGF-β1mRNA表达上升,与正常对照组比较有显著差异(P<0.01)。白藜芦醇可以抑制高糖刺激引起的MCP-1、VCAM-1、TNF-α和TGF-β1mRNA表达上升(P<0.01)。SIRT1 RNAi引起RMC的MCP-1、VCAM-1、TNF-α和TGF-β1mRNA表达上升,和正常对照组比较有显著差异(P<0.01),见图2。

表2 各组细胞MDA含量及SOD活性的比较

Figure 2. The mRNA expression of SIRT1, MCP-1, TGF-β1, VCAM-1 and TNF-α in RMC with different treatments.Mean±SD. n=3.**P<0.01 vs control; △△P<0.01 vs high glucose.
4 各组细胞上清液中MCP-1、VCAM-1、TNF-α和TGF-β1蛋白含量的比较
高糖刺激引起细胞分泌MCP-1、VCAM-1、TNF-α和TGF-β1增加,和正常对照组比较有显著差异(P<0.01)。白藜芦醇预处理后,可以抑制高糖刺激引起的MCP-1、VCAM-1、TNF-α和TGF-β1含量的增加(P<0.01)。SIRT1干扰引起MCP-1、VCAM-1、TNF-α和TGF-β1的表达上升,和正常对照组比较有显著差异(P<0.01),见图3、4。
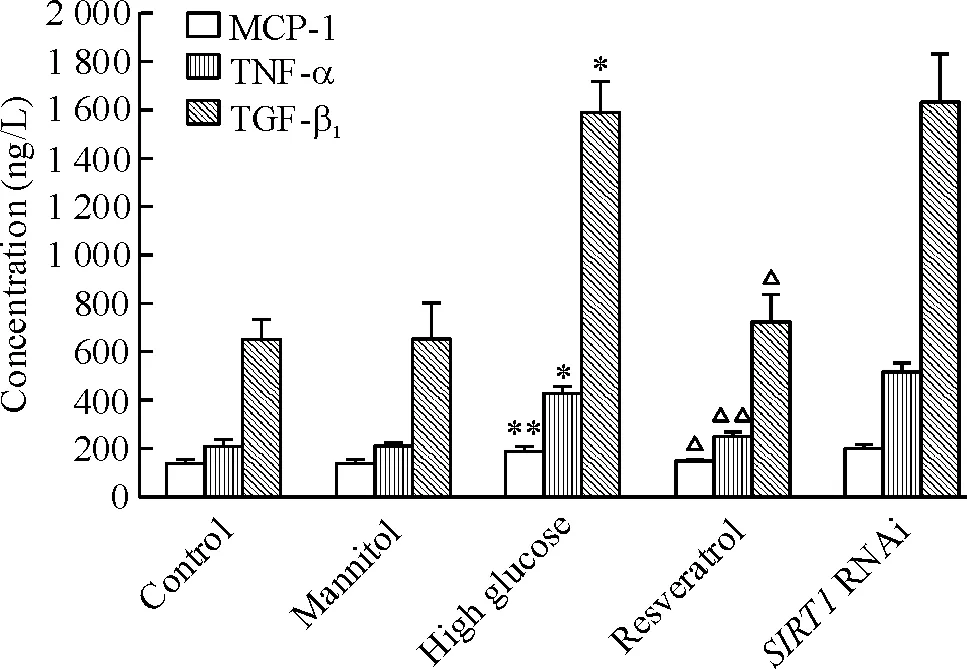
Figure 3. The protein concentrations of MCP-1, TNF-α and TGF-β1 in the RMC culture supernatant.Mean±SD. n=3.*P<0.05,**P<0.01 vs Control; △△P<0.01 vs high glucose.

Figure 4. The protein concentration of VCAM-1 in the culture supernatant of RMC with different treatments.Mean±SD. n=3.**P<0.01 vs control;△△P<0.01 vs high glucose
5 各组SIRT1蛋白和乙酰化NF-κB蛋白的表达
高糖诱导可使细胞表达SIRT1蛋白降低,乙酰化NF-κB蛋白表达增加(P<0.01)。白藜芦醇可以促进SIRT1蛋白的表达,使NF-κB p65乙酰化水平降低(P<0.01)。SIRT1干扰可使高糖诱导的RMC SIRT1蛋白表达减少,乙酰化NF-κB p65蛋白表达增加,和正常对照组比较有显著差异(P<0.01),见图5。

Figure 5. The protein expression of SIRT1 and acetylated NF-κB p65 in RMC with different treatments. 1: control group; 2: mannitol group; 3: high glucose group; 4: resveratrol group; 5: SIRT1 RNAi group. **P<0.01 vs control;△△P<0.01 vs high glucose.
讨 论
DN是糖尿病的微血管并发症,也是引起终末性肾病的主要原因,已成为全球日益关注的公共健康问题。糖尿病肾病主要以毛细血管基底膜增厚及肾小球和肾小管间质细胞外基质进行性积聚为主要病理改变。其发病机制复杂,尚未完全阐明。
目前已经明确,高糖是引起糖尿病并发症包括糖尿病肾病的始动因素。高糖介导引起的晚期糖基化终产物(advanced glycation end-products,AGEs)大量产生,甘油二脂/蛋白激酶C活性的提高,多元醇通路的激活等是引起DN的经典途径。除此之外,越来越多的证据表明肾素-血管紧张素系统(renin-angiotensin system,RAS)是引起肾损伤的主要介质。因此目前治疗DN的主要手段:在降糖基础上,抑制RAS活化,但在DN的临床治疗中发现以上的治疗,并不能有效地控制其发展的进程[5]。近几年的研究表明,炎症是糖尿病肾病发生发展的关键因素[1],NF-κB及许多炎症因子均发挥致病作用。我们的前期实验研究显示[6],高脂高糖加小剂量STZ复制的2型糖尿病大鼠,随着病变的加重,肾脏组织出现炎细胞的浸润,大鼠血清ICAM-1、MCP-1和TNF-α的含量增加。本实验结果显示,高糖可引起系膜细胞活力下降,氧化应激加强,炎症因子MCP-1、VCAM-1、TNF-α和TGF-β1表达增加,也进一步证实炎症在糖尿病肾病中的损伤作用。
NF-κB是一种介导细胞内信号转导的核转录因子,在炎症反应中发挥重要作用[7]。众多研究表明,NF-κB与糖尿病肾病的发病密切相关[8-9]:在糖尿病状态下,高血糖、AGEs、血管紧张素Ⅱ及氧化应激等均可激活NF-κB。NF-κB 激活导致多种炎症因子、细胞因子及黏附分子等表达分泌异常,进而引起肾小球血管通透性增加、肾组织炎细胞浸润、系膜区基质堆积及肾小管间质纤维化。因此,抑制NF-κB的活化在防治糖尿病肾病中具有重要的意义。
NF-κB是由p50和p65两个蛋白亚基组成的二聚体。在静息状态下,NF-κB与其抑制因子IκB相结合,使NF-κB以无活性的形式存在于胞质中。当细胞受到各种刺激后,IκB 发生酶解,NF-κB被活化。近年研究表明,NF-κB p65的乙酰化水平调控NF-κB的转录活性[10-11]:在p300和CBP的乙酰化作用下,NF-κB p65 310赖氨酸残基乙酰化,RelA/p65亚单位不能与IκBα结合,进入核内,与DNA相关元件结合,刺激相关基因表达。相反,RelA/p65亚单位的去乙酰化,允许NF-κB/IκBα相互作用,进而抑制NF-κB活性。
SIRT1 是烟碱腺嘌呤二核苷酸依赖性的sirtuin(silent mating type information regulation 2 homolog)去乙酰化酶家族中的一员,在哺乳动物组织中广泛表达。它不仅调节组蛋白去乙酰化,还通过表观遗传修饰调节转录因子活性,参与基因沉默,与细胞衰老、寿命延长、抗氧化应激和能量代谢调节等细胞多种功能活动有关,在衰老性疾病和代谢性疾病的组织保护中起重要作用[2]。
越来越多的证据显示,SIRT1激活能使NF-κB的RelA/p65亚单位去乙酰化,抑制NF-κB的转录活性,在炎症损伤中起保护作用。Jung等[3]研究发现SIRT1高表达通过降低NF-κB亚单位RelA/p65乙酰化从而减轻cisplatin对肾小管细胞的毒性作用;Chen等[4]的实验发现高表达SIRT1可通过NF-κB亚单位RelA/p65去乙酰化,显著降低淀粉样β 蛋白诱导的炎症因子产生,并抑制炎症反应对原皮质神经元的损伤作用;相反,减少SIRT1使NF-κB p65乙酰化升高,进而炎症相关因子表达增加[12]。另外,研究发现[13-15],限制热量摄入可通过激活SIRT1进而抑制炎症和促进自噬改善糖尿病肾病;SIRT1的激活剂白藜芦醇可减轻高糖诱导的系膜细胞氧化应激水平和维持正常的线粒体结构和功能,阻断氧化应激诱导的系膜细胞凋亡,这提示SIRT1对糖尿病肾脏也具有保护作用,可能是治疗糖尿病肾病的有效靶点。但SIRT1的激活是否影响高糖诱导的系膜细胞NF-κB的乙酰化水平及相关因子的分泌,从而起到保护作用,尚未见报道。
本研究发现,经高糖诱导的系膜细胞SIRT1表达减少,NF-κB p65的乙酰化水平降低。SIRT1的激活剂白藜芦醇可降低高糖诱导的NF-κB p65的乙酰化水平,降低TNF-α、MCP-1、VCAM-1、TGF-β1等炎症因子的产生;RMC经沉默SIRT1处理,可使NF-κB p65的乙酰化水平明显升高。以上结果提示,SIRT1的激活,对高糖诱导的系膜细胞具有保护作用,其机制可能是SIRT1通过去乙酰化作用于NF-κB的亚单位RelA/p65,减少NF-κB与核内炎症基因结合,进而减少TNF-α、MCP-1、VCAM-1、TGF-β1等炎症因子的产生。
综上所述,高糖可降低SIRT1水平及活性,引起氧化应激及炎症反应,介导系膜细胞损伤。SIRT1的激活可以拮抗高糖诱导引起的细胞损伤作用,其机制之一可能使NF-κB 的亚单位RelA/p65去乙酰化,从而抑制炎症因子的产生。由此我们相信SIRT1可作为治疗DN的潜在靶点。
[参 考 文 献]
[1] Luis-Rodríguez D, Martínez-Castelao A, Górriz JL, et al. Pathophysiological role and therapeutic implications of inflammation in diabetic nephropathy[J]. World J Diabetes, 2012, 3(1):7-18.
[2] Kong XX, Wang R, Liu XJ, et al. Function of SIRT1 in physiology[J]. Biochemistry (Mosc), 2009, 74(7):703-708.
[3] Jung YJ, Lee JE, Lee AS, et al. SIRT1 overexpression decreases cisplatin-induced acetylation of NF-κB p65 subunit and cytotoxicity in renal proximal tubule cells[J]. Biochem Biophys Res Commun, 2012, 419(2):206-210.
[4] Chen J, Zhou Y, Mueller-Steiner S, et al. SIRT1 protects against microglia-dependent amyloid-beta toxicity through inhibiting NF-κB signaling[J]. J Biol Chem, 2005, 280(48): 40364-40374.
[5] Balakumar P, Arora MK, Ganti SS , et al. Recent advances in pharmacotherapy for diabetic nephropathy: current perspectives and future directions[J]. Pharmacol Res, 2009, 60(1):24-32.
[6] 杜月光,钱俊文,宋光明,等. LOX-1在2型糖尿病大鼠肾小管间质中的表达及其意义[J]. 中国病理生理杂志, 2013, 29(1):50-55.
[7] Hayden MS, Ghosh S. NF-kappaB, the first quarter-century: remarkable progress and outstanding questions[J]. Genes Dev, 2012, 26(3):203-234.
[8] Navarro-González JF, Mora-Fernández C, Muros de Fuentes M, et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J]. Nat Rev Nephrol, 2011, 7(6):327-340.
[9] Chen LF, Greene WC. Regulation of distinct biological activities of the NF-kappaB transcription factor complex by acetylation[J]. J Mol Med, 2003, 81(9):549-557.
[10] Sanz AB,Sanchez-Nio MD,Ramos AM, et al.NF-κB in renal inflammation[J]. J Am Soc Nephrol, 2010, 21(8):1254-1262.
[11] Kiernan R, Bres V, Ng RW, et al. Post-activation turn-off of NF-kappa B-dependent transcription is regulated by acetylation of p65[J]. J Biol Chem, 2003, 278(4):2758-2766.
[12] Zhu X, Liu Q, Wang M, et al. Activation of SIRT1 by resveratrol inhibits TNF-alpha induced inflammation in fibroblasts[J]. PLoS One, 2011, 6(11):e27081.
[13] Kitada M, Takako A, Naqak T, et al. Dietary restriction ameliorates diabetic nephropathy through anti-inflammatory effects and regulation of the autophagy via restoration of SIRT1 in diabetic Wistar fatty (fa/fa) rats: a model of type 2 diabetes[J]. Exp Diabetes Res, 2011, 2011:908185.
[14] Xu Y, Nie L, Yin YG,et al. Resveratrol protects against hyperglycemia-induced oxidative damage to mitochondria by activating SIRT1 in rat mesangial cells[J]. Toxicol Appl Pharmacol, 2012, 259(3):395-401.
[15] Kume S, Haneda M, Kanasaki K, et al. SIRT1 inhibits transforming growth factor beta-induced apoptosis in glomerular mesangial cells via Smad7 deacetylation[J]. J Biol Chem, 2007, 282(1):151-158.
