蛋白激酶Cε对肝癌SK-Hep-1细胞生物学行为的影响*
2014-08-08叶志强杨跃武刘旭辉潘卫东
叶志强, 范 瑾, 杨跃武, 刘旭辉, 赵 坤, 潘卫东△
(中山大学附属第三医院 1急诊科, 3中医科, 4肝胆外科, 广东 广州 510630;2暨南大学附属第一医院妇产科,广东 广州 510632)
蛋白激酶Cε(protein kinase Cε, PKCε)是蛋白激酶C[1]的一个重要亚型,是蛋白激酶C家族中与肿瘤发生发展关系比较密切的蛋白[2],一般认为其可能通过蛋白激酶B (protein kinase B,Akt)[3]、转录信号转导子与激活子3(signal transducers and activators of transcription 3,STAT3)[4]、WNT(wingless type MMTV integration site family)[5]等信号通路影响肿瘤细胞的生长和侵袭等生物学过程,有望成为多种恶性肿瘤的治疗靶点[6]。人肝细胞癌(hepatocellular carcinoma,HCC)是最常见的四大恶性肿瘤之一,目前尚缺乏效果满意的基因治疗手段[7]。目前已经有很多抑制PKCε表达对其它恶性肿瘤具有明显抑制作用的报道,但PKCε与肝细胞癌发生发展之间关系的研究较少,并且其影响肝癌细胞增殖转移的分子机制尚未完全明确。本研究采用针对PKCε的小干扰RNA(PKCε-siRNA)转染肝细胞癌SK-Hep-1细胞,观察其对PKCε基因的沉默作用,及其对肝癌细胞生长增殖和侵袭转移能力的影响[8],并进一步明确其分子生物学机制,为肝癌的基因治疗提供新的靶点和策略。
材 料 和 方 法
1 材料
DMEM高糖培养基、胎牛血清(fetal bovine se-rum, FBS)、胰酶、PBS和Trizol购自Invitrogen;real-time PCR试剂盒购自TaKaRa,引物采用Primer 3软件设计,由Invitrogen合成。兔抗人PKCε抗体和β-actin抗体购自BD。报告基因质粒(pKF-κB-Luc)和内参照质粒(pRL-SV40)购自广州爱科生物技术有限公司。Annexin V-PI双染试剂盒和Dual-luciferaseTMReporter Gene Assay试剂盒购自碧云天生物科技研究所。人肝癌细胞株SK-Hep-1购自复旦大学肝癌研究所。PKCε小干扰RNA(PKCε-siRNA)和阴性对照siRNA(NC-siRNA)购自Santa Cruz。
2 方法
2.1细胞培养和siRNA转染 复苏培养SK-Hep-1肝癌细胞株用含10%胎牛血清的DMEM高糖培养基培养于6孔板中,培养条件为饱和湿度、5%CO2、37 ℃细胞培养箱。细胞融合度达70%时,采用Lipofectamine 2000脂质体转染PKCε-siRNA和NC-siRNA,按照试剂说明书转染后培养48 h,进行后续检测。同时设立空白对照(control)组。
2.2实时荧光定量PCR检测mRNA表达 Trizol法提取各组总细胞RNA,逆转录合成cDNA。PKCε上游引物5’-ATGGTAGTGTTCAATGGCCTTCT-3’,下游引物5’-TCAGGGCATCAGGTCTTCAC-3’;内参照β-actin上游引物5’-TCATGAAGTGTGACGTGGACAT-3’,下游引物5’-CTCAGGAGGAGCAATGATCTTG-3’。PCR反应条件为94 ℃、30 s;94 ℃、5 s;58 ℃、30 s;50个循环,循环延伸末端收集荧光信号。Real-time PCR数值分析采用2-ΔΔCt分析法。
2.3Western blotting法检测蛋白表达 siRNA转染肝癌细胞48 h后收集细胞,提取蛋白,按照常规方法进行Western blotting[9],分析PKCε、细胞核增殖抗原Ki-67、基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)和β-肌动蛋白(β-actin)蛋白的表达。
2.4四甲基偶氮唑盐法检测肝癌细胞增殖能力 各实验组以2×104cells/well重悬于200 μL培养基中,接种于96孔板,每个实验组3个复孔。分组处理后继续培养24和48 h后行MTT检测。每孔加入20 μL 0.5% MTT溶液。在37 ℃培养箱继续培养2 h后,终止培养。弃去培养液,每孔加入200 μL DMSO液,常温缓慢振荡0.5 h使溶解反应完全[10]。酶标仪测490 mn处吸光度(A),如下公式计算细胞增殖率。细胞增殖率(%)=A转染组/A对照组×100%。
2.5Transwell法检测细胞侵袭能力 将Matrigel 1∶3稀释后,每个Transwell小室加入60 μL,37 ℃孵育2 h使其凝固后弃去多余液体。分组转染后的细胞同前接种入Transwell小室上室,下室加入600 μL完全培养基。常规培养24 h、48 h后取出小室,棉签擦去未过膜细胞,多聚甲醛固定后行Giemsa染色[11]。醋酸溶解上室底膜,分光光度计检测570 nm处A值。
2.6萤光素酶报告基因实验 各实验组细胞铺24孔板,进行pKF-κB-Luc质粒和pRL-SV40质粒共转染后,裂解细胞,采用Dual-luciferaseTMReporter Gene Assay 试剂盒处理后,于多功能酶标仪中按照Gen5软件步骤进行检测。取萤光素酶活性值与内参萤光素酶活性值的比值为萤光素酶相对活性。
3 统计学处理
采用SPSS 16.0软件分析。数据用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析,2组之间比较采用t检验。以P<0.01为差异有统计学意义。
结 果
1 siRNA干扰对SK-Hep-1细胞PKCε mRNA表达的影响
PKCε-siRNA组 PKCε mRNA表达量为对照组的12.1%,即干扰效率达到87.9%。而NC-siRNA组与对照组之间PKCε mRNA的表达差异无统计学意义(P>0.05),见图1。这说明siRNA沉默PKCε基因的效果明显。
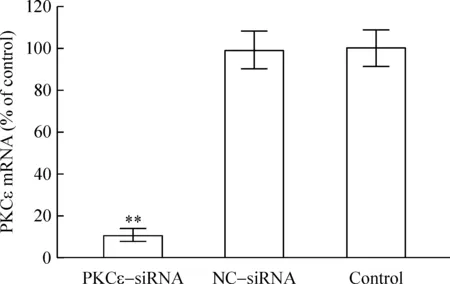
Figure 1. Effects of PKCε-siRNA on expression of PKCε mRNA in SK-Hep-1 cells detected by real-time PCR.Mean±SD. n=6. **P<0.01 vs control.
2 siRNA干扰对蛋白表达的影响
实验组PKCε、Ki-67和MMP-9蛋白的表达量明显降低,而NC-siRNA组与对照组之间的蛋白表达无明显差异,见图2。Western blotting结果与real-time PCR结果一致,说明siRNA抑制PKCε蛋白表达的效果明显,且同时对Ki-67和MMP-9蛋白的表达产生了影响。

Figure 2. Effects of PKCε-siRNA on protein expression of PKCε, Ki-67 and MMP-9 in SK-Hep-1 cells. Mean±SD. n=6.**P<0.01 vs control.
3 siRNA干扰对增殖能力的影响
转染24 h、48 h和72 h后,对照组和NC-siRNA组的生长未受到明显抑制,而PKCε-siRNA组细胞的生长在转染24 h后即出现抑制作用,到72 h时抑制作用最大,与空白对照组比较差异有统计学意义(P<0.01),见图3。转染PKCε-siRNA 24 h、48 h和72 h后增殖率分别为78.79%、69.64%和55.66%,说明PKCε-siRNA对肝癌细胞的生长产生了明显的抑制作用。
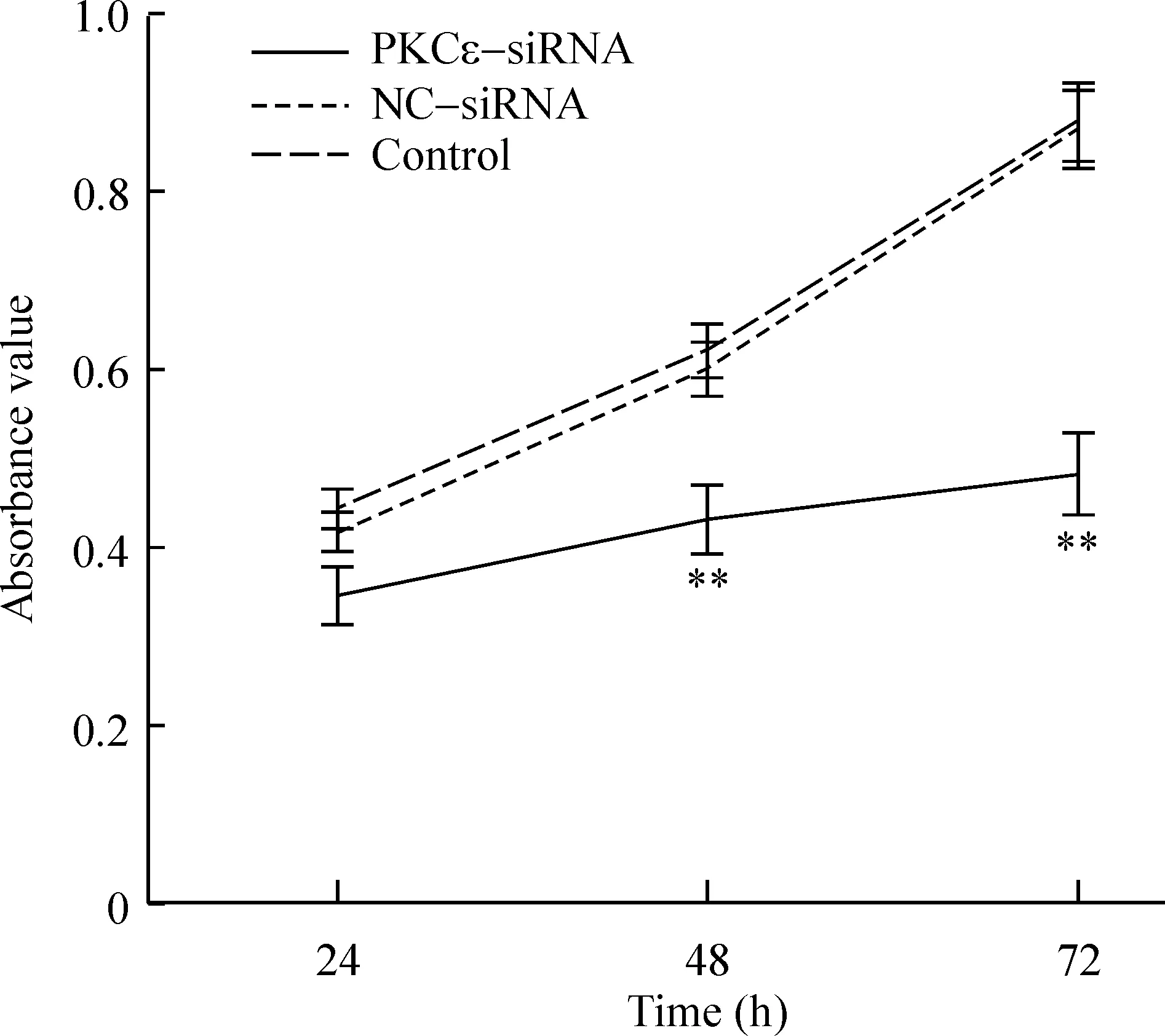
Figure 3. Effects of PKCε-siRNA on SK-Hep-1 cell growth.Mean±SD. n=6.**P<0.01 vs control.
4 siRNA对细胞侵袭能力的影响
培养24和48 h后,发现实验组穿膜细胞数明显低于对照组(P<0.01),而NC-siRNA组与对照组之间的差异无统计学意义(P>0.05),见图4。

Figure 4. Effects of PKCε-siRNA on SK-Hep-1 cell invasion. Mean±SD. n=6.**P<0.01 vs control.
5 siRNA干扰对NF-κB通路活性的影响
如图5所示,萤光素酶报告基因实验数据显示,PKCε表达的变化明显抑制NF-κB通路的转录活性,相对于对照组,差异有统计学意义(P<0.01)。而NC-siRNA组相对于对照组,NF-κB通路的转录活性没有明显差异。

Figure 5. Effects of PKCε-siRNA on the luciferase activity of NF-κB reporter. Mean±SD.n=6.**P<0.01 vs control.
讨 论
RNA干扰是由siRNA介导的高效基因沉默技术。在细胞内,RNA诱导的沉默复合体结合siRNA,可发挥特异性降解靶基因的作用[12]。在本研究中,siRNA通过降低PKCε mRNA和蛋白的表达,有效发挥了抑制肝癌细胞增殖、促进凋亡、减少侵袭的作用。
我们应用RNA干扰技术,将合成的PKCε-siRNA通过阳离子脂质体转染SK-Hep-1人肝癌细胞后,real-time PCR法检测其mRNA的表达水平,Wes-tern blotting法检测其蛋白表达水平,结果显示PKCε-siRNA能有效降解SK-Hep-1细胞中的PKCε mRNA,使PKCε蛋白表达明显下调。利用RNA干扰技术降低SK-Hep-1细胞中的PKCε蛋白表达的效果是明显的。
我们进一步利用MTT法检测了沉默PKCε表达后SK-Hep-1细胞的增殖能力[13]。结果显示细胞在转染24 h后增殖率就受到明显抑制,一直到转染后72 h,增殖能力降低到55.66%,与对照组相比有统计学意义。进一步研究发现,转染后Ki-67蛋白表达水平降低,说明PKCε-siRNA可能通过降低Ki-67的表达改变了细胞的增殖状态,抑制了肝癌细胞的增殖。
我们采用Transwell法检测细胞侵袭能力,验证了PKCε蛋白与SK-Hep-1细胞侵袭能力的相关性[14]。结果显示RNA干扰后能通过凝胶的细胞数目明显减少,差异有统计学意义。肿瘤细胞的侵袭能力较2个对照组均明显下降,提示肿瘤的侵袭能力随着PKCε蛋白表达的降低而受限[15]。我们进一步对细胞侵袭能力变化的分子机制进行了研究,发现PKCε-siRNA的抗侵袭作用可能是通过下调PKCε蛋白,进而降低MMP-9的表达实现的。
Ki-67是一种增殖细胞相关的核抗原,其功能与有丝分裂密切相关,其表达水平一般与肿瘤细胞的增殖呈正相关[16]。MMP-9的表达对肿瘤实现侵袭转移和血管生成具有重要作用[17],它最主要的功能是降解基质,为内皮细胞移行创造必要条件。已有相关研究证实,在肝癌等恶性肿瘤中,可通过对NF-κB信号通路的抑制,降低Ki-67[18]、MMP-9[19]等蛋白表达,进而抑制其增殖、转移活动[20]。本研究的结果显示,PKCε-siRNA降低SK-Hep-1细胞中的PKCε蛋白表达后,可能通过影响NF-κB信号通路的转录活性,进而选择性影响了Ki-67蛋白和MMP-9蛋白的表达,从而抑制了细胞的增殖和侵袭能力。这可能是PKCε-siRNA抑制PKCε蛋白表达后,影响肿瘤细胞生物学特性的主要分子机制。
SK-Hep-1细胞为典型的人肝癌细胞株,在抑制PKCε蛋白表达后,通过干预NF-κB信号通路,其增殖和侵袭能力发生明显下降,提示PKCε为可能的致癌因子,有望成为肝癌新的基因治疗靶点。
[参 考 文 献]
[1] Hu CT, Cheng CC, Pan SM, et al. PKC mediates fluctuant ERK-paxillin signaling for hepatocyte growth factor-induced migration of hepatoma cell HepG2[J].Cell Signal,2013,25(6):1457-1467.
[2] Jain K, Basu A. The multifunctional protein kinase C-ε in cancer development and progression[J]. Cancer,2014,6(2):860-878.
[3] Jain K, Basu A. Protein kinase C-ε promotes EMT in breast cancer[J]. Breast Cancer (Auckl),2014,8:61-67.
[4] Xie X, Piao L, Cavey GS, et al. Phosphorylation of Nanog is essential to regulate Bmi1 and promote tumorigenesis[J]. Oncogene,2014,33(16):2040-2052.
[5] Lutzny G, Kocher T, Schmidt-Supprian M, et al. Protein kinase C-β-dependent activation of NF-κB in stromal cells is indispensable for the survival of chronic lymphocytic leukemia B cellsinvivo[J]. Cancer Cell,2013,23(1):77-92.
[6] Körner C, Keklikoglou I, Bender C, et al. MicroRNA-31 sensitizes human breast cells to apoptosis by direct targeting of protein kinase C(PKC)[J]. J Biol Chem,2013,288(12):8750-8761.
[7] 刘 娟,殷 飞,姚树坤. 细胞周期素D1、视网膜母细胞瘤样蛋白2及微小染色体维持蛋白7在肝细胞癌中的表达及对预后的意义[J]. 中国病理生理杂志,2011,27(2):304-309.
[8] 肖 海,贺兴波,黄才斌,等. 靶向泛素连接酶 SIAH2 的 shRNA 对人肝癌细胞株 HepG2 细胞周期和凋亡的影响'[J]. 中国病理生理杂志,2013,29(8):1406-1411.
[9] Guo Y, Chen W, Wang W, et al. Simultaneous diagnosis and gene therapy of immuno-rejection in rat allogeneic heart transplantation model using a T-cell-targeted theranostic nanosystem[J]. ACS Nano,2012,6(12):10646-10657.
[10] Ye X, Guo Y, Zhang Q, et al. βKlotho suppresses tumor growth in hepatocellular carcinoma by regulating Akt/GSK-3β/cyclin D1 signaling pathway[J].PLoS One,2013,8(1):e55615.
[11] Guo Y, Liang X, Lu M, et al. Mammalian target of rapamycin as a novel target in the treatment of hepatocellular carcinoma[J]. Hepatogastroenterology,2010,57(101):913-918.
[12] Dudek H, Wong DH, Arvan R, et al. Knockdown of β-catenin with dicer-substrate siRNAs reduces liver tumor burdeninvivo[J]. Mol Ther,2014,22(1):92-101.
[13] 嵇晓辉,范秉琳,张红鸽,等. MicroRNA-100 对肝癌细胞增殖活力和细胞周期的影响[J]. 中国病理生理杂志,2013,29(1):108-111.
[14] 张承彦,谢 鑫,张春喜,等. 糖蛋白非转移性黑色素瘤蛋白 B 对人肝癌细胞增殖、凋亡和侵袭能力的影响及其分子机制[J]. 中国病理生理杂志,2013,29(8):1441-1446.
[15] Bordeleau F, Galarneau L, Gilbert S, et al. Keratin 8/18 modulation of protein kinase C-mediated integrin-dependent adhesion and migration of liver epithelial cells[J]. Mol Biol Cell,2010,21(10):1698-1713.
[16] 阚和平,谭永法,周 杰. 索拉非尼治疗肝移植术后肝癌复发的疗效与肿瘤组织 Ki-67 表达及微血管密度的关系[J]. 中国病理生理杂志,2011,27(8):1549-1551.
[17] 周晓燕,王红梅,蔡震宇,等. 脂氧素 A4 对肝细胞生长因子诱导 HepG2 肝癌细胞血管生成相关细胞因子表达的影响[J]. 中国病理生理杂志,2011,27(2):300-303.
[18] Wang L, Zhu R, Huang Z, et al. Lipopolysaccharide-induced Toll-like receptor 4 signaling in cancer cells promotes cell survival and proliferation in hepatocellular carcinoma[J].Dig Dis Sci,2013,58(8):2223-2236.
[19] Zhang J, Zhang DL, Jiao XL, et al. S100A4 regulates migration and invasion in hepatocellular carcinoma HepG2 cells via NF-κB-dependent MMP-9 signal[J]. Eur Rev Med Pharmacol Sci,2013,17(17):2372-2382.
[20] Gong Y, Wang L, Wang H, et al. The expression of NF-κB, Ki-67 and MMP-9 in CCOT, DGCT and GCOC[J].Oral Oncol,2009,45(6):515-520.
