冠状动脉结扎(孙络疏失)模型大鼠血浆内皮细胞活性因子及微血管舒缩因子的动态变化研究
2014-08-07张俊修霍旺王朋李绍旦刘毅杨明会
张俊修 霍旺 王朋 李绍旦 刘毅 杨明会
·论著·
冠状动脉结扎(孙络疏失)模型大鼠血浆内皮细胞活性因子及微血管舒缩因子的动态变化研究
张俊修 霍旺 王朋 李绍旦 刘毅 杨明会
目的探讨冠状动脉结扎(孙络疏失)模型大鼠血浆血管疏缩因子内皮素-1、血栓素B2、6-酮-前列腺素F1а、血管紧张素Ⅱ的变化规律。方法将心电图正常的60只雄性SD大鼠随机分为假手术组、造模30分钟组、造模1小时组、造模6小时组、造模12小时组、造模24小时组。通过结扎大鼠冠状动脉前降支的方法造成急性心肌缺血模型(“孙络疏失”模型),假手术组只穿线不结扎。放射免疫法检测血浆血管疏缩因子内皮素-1、血栓素B2、6-酮-前列腺素F1а、血管紧张素Ⅱ水平。结果经单因素方差分析LSD检验,与假手术组比较,血浆血管疏缩因子内皮素-1水平在造模1小时组、造模6小时组、造模12小时组显著升高(P<0.05),并于24小时恢复正常;血浆6-酮-前列腺素F1а水平在各个模型组均显著下降(P<0.01或P<0.05),于12小时达到最低水平;血浆血栓素B2水平在造模6小时组显著升高(P<0.01),而在造模12小时组、造模24小时组明显下降(P<0.05);血浆血管紧张素Ⅱ在造模30分钟组、造模1小时组显著降低(P<0.01或P<0.05),于1小时达到最低,而造模6小时组、造模12小时组、造模24小时组则回升至正常水平。结论微血管内皮细胞功能紊乱导致的微血管舒缩因子异常分泌、动态平衡遭到破坏,在“孙络疏失”急性期的病理变化过程中发挥重要作用。
孙络疏失; 心肌缺血; 内皮素-1; 血栓素B2; 6-酮-前列腺素F1а; 血管紧张素Ⅱ; 大鼠
中医的“脉”具有双重含义:既是经络系统中以运行血液为主要功能的重要组成部分,又是属于奇恒之腑的独立实体脏器。吴以岭院士提出“脉络—血管系统病”理论,确定了脉络与现代医学血液循环系统的相关性[1],认为络气虚滞与血管内皮功能障碍是病变的基本病机,是脉络绌急与血管痉挛、脉络瘀塞与血管闭塞、脉络瘀阻与动脉粥样硬化的共同病理环节[2]。冠状动脉微循环障碍是急性心肌梗死(acute myocardial infarction,AMI)经皮冠状动脉介入治疗过程中常见的并发症,是影响冠状动脉微循环灌注的主要原因,是AMI患者远期预后不良和死亡率的独立预测因子[3]。现代医学针对冠脉微循环障碍的药物治疗效果有限,课题组提出“营卫承制调平”理论,反映血管病变作为复杂性疾病在生理、病理、治疗、转归不同阶段的内在规律[4],以期发挥中医药整体调节与多靶点的优势,在冠状动脉微循环障碍性疾病中做出一定的突破。本研究遵循课题组指导思想,通过结扎大鼠冠状动脉前降支的方法建立心肌缺血即“孙络疏失”模型,探讨血管内皮细胞活性因子及微血管舒缩因子的动态变化规律,为“脉络—血管系统病”理论和“营卫承制调平”理论认识、治疗冠状动脉微循环障碍提供理论依据。
1 实验材料
1.1 实验动物
SPF级雄性SD大鼠60只,体重(220±20)g,购自军事医学科学院动物中心,许可证号SCXK-(军)2012-0004。每笼5只饲养于独立通气笼具系统内。温度(22±1)℃,湿度(50±5)%,每日明暗交替12小时。实验期间造模、取材等操作均在超净工作台内进行,添加饲料、换水等由专人负责管理。
1.2 主要试剂
乌拉坦(国药集团化学试剂有限公司,批号T2011110);注射用青霉素钠(华北制药股份有限公司,批号F3047216);血管疏缩因子内皮素-1(endothelin-1,ET-1)、血栓素B2(thromboxaneB2,TXB2)、6-酮-前列腺素F1а(6-keto-prostaglandin1α,PGF1α)、血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)放射免疫试剂盒,均购自北京普尔伟业生物科技有限公司(批号20131021)。
1.3 主要仪器
电子秤(长沙湘平科技发展有限公司,EPS-2001);小动物心电图机(北京福田电子医疗仪器有限公司,FX-211);动物呼吸机(上海奥尔科特生物科技有限公司,ALC-V9);高速离心机(Perkin Elmer VICTOR X5);超净工作台(北京长城空气净化工程公司);SN-697B放射免疫计数器(上海原子核研究所日环仪器厂)。
2 研究方法
2.1 造模方法及分组
选取心电图正常大鼠60只,随机数字表法分成假手术组、造模30分钟组、造模1小时组、造模6小时组、造模12小时组和造模24小时组。“孙络疏失”大鼠模型参照文献[5],大鼠以20%乌拉坦按5 ml/kg腹腔注射麻醉后,经口气管插管连接呼吸机,设定呼吸频率80次/分、潮气量15 ml/kg、呼吸比1∶1。于大鼠左侧胸壁3~4肋间横向开胸,暴露心脏,撕开心包膜,在冠状动脉左侧主干处,左心耳下方约2~3 mm处以左心耳与肺动脉圆锥间左冠状静脉主干为标志结扎(假手术组只穿线,不接扎),进针深度约1~1.5 mm,宽约2.0 mm,逐层关闭胸腔,待大鼠自主呼吸恢复后,移除呼吸机。以室壁运动减弱,结扎下部心肌组织颜色变白,心电图可见胸前各个导联的ST段抬高、T波高耸为造模成功标志,造模后每只大鼠一次性注射青霉素钠40万单位预防感染。
2.2 指标检测与标本处理
各组大鼠于规定时间点腹主动脉取血4 ml,均分为4分,分别以放射免疫法测定ET-1、TXB2、6-keto-PGF1а和AngⅡ水平。
2.3 统计学方法
3 结果
3.1 血浆TXB2、6-keto-PGF1а水平变化
与假手术组比较,血浆TXB2水平在造模6小时组显著升高,差异有统计学意义(P<0.01),而在造模12小时组、造模24小时组,则明显下降,差异有统计学意义(P<0.05);血浆6-keto-PGF1а水平,在各个组均较假手术组显著下降,差异具有统计学意义(P<0.01或P<0.05),并于12小时达到最低水平,见表1。
3.2 血浆ET-1、AngⅡ水平变化
与假手术组比较,造模1小时组、造模6小时组、造模12小时组血浆ET-1水平显著升高,差异有统计学意义(P<0.05),造模30分钟组与造模24小时组较假手术组无明显变化;与假手术组比较,造模30分钟组、造模1小时组血浆AngⅡ水平显著降低,在1小时组达到低峰,此后恢复正常水平,见表1。
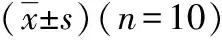
表1 各组血浆TXB2、6-Keto-PGF1α、ET-1、AngⅡ水平
注:各组与假手术组比较,aP<0.05,bP<0.01
4 讨论
4.1 关于“孙络疏失”模型
“孙络疏失”是基于“脉络—血管系统病”理论提出的新概念,中医学认为,孙络是人体络脉的最小单位,对应现代医学的小血管、微血管,孙络与微循环在结构分布、生理功能、病理变化等方面具有同一性[6]。“孙络疏失”的病变基础在微循环,“疏”指数量的减少,“失”是“疏”的进一步加重,造成了小范围内的孙络消失,同时“疏失”也指功能的缺失。大鼠冠状动脉前降支结扎制作的心肌缺血模型,已被广泛证实其微血管密度降低[7],正与“孙络疏失”相对应,而孙络渗灌气血、濡养脏腑的功能受损,会导致“心主血脉”一系列正常生理功能受损,与心肌梗死后心功能各项指标的异常表现相一致[8]。因此选择结扎大鼠冠状动脉前降支的方法来制作心之络病“孙络疏失”的大鼠模型。
4.2 “孙络疏失”模型微血管疏缩因子的动态变化
心之络病“孙络绌急—孙络疏失—孙络瘀阻—孙络新生”作为“脉络—血管系统病”提出的孙络病变的演变过程,与“脉络—血管系统病”整体上具有一致性[9],既往对“孙络绌急”的研究中,已证明微血管内皮功能紊乱是其发病基础[10],本研究在此基础上继续探讨“孙络疏失”与微血管内皮功能紊乱的相关机制,以期为通络药物及应用络病理论治疗“孙络疏失”[11]提供更全面的机制研究,这对应用络病理论治疗心系疾病有重要参考价值。
血栓素A2(thromboxane A2,TXA2)与前列腺素I2(prostacyclin,PGI2)是生物活性完全相反的血管活性物质,TXA2具有很强的诱导血小板聚集和血管收缩作用,而PGI2是内皮细胞合成并分泌的血管舒张因子,其主要作用是抑制血小板的黏附与聚集,拮抗TXA2,使血管扩张。TXA2和PGI2的性质极不稳定,不易检测,而其相应的代谢产物TXB2和6-keto-PGF1α则较稳定,因此测定TXB2和6-keto-PGF1α的浓度,可反映TXA2和PGI2的含量[12]。AngⅡ是肾素—血管紧张素—醛固酮系统(renin-angiotensin-aldosterone system,RAAS)中最重要的活性成分,是强有力的内源性血管收缩剂。其通过兴奋醛固酮分泌、肾上腺髓质及其交感神经系统作用于其受体,从而发挥增加血容量及升高外周阻力的作用[13]。ET-1主要源于血管内皮,具有很强的血管收缩功能,并可引起血小板聚集、促进血管平滑肌细胞增生[14]。
本研究结果显示,血浆TXB2在造模6小时显著增高,而在造模12小时、24小时则显著下降;血浆6-keto-PGF1а在五个模型组中均显著下降;血浆ET-1在造模1、6、12小时组显著升高。表明“孙络疏失”急性期血管舒张因子的变化更为明显,提示“孙络疏失”急性期是通过减少血管舒张因子的分泌而导致内皮功能的紊乱。血浆AngⅡ在造模开始30分钟、1小时组降低,而后回升至正常水平,这提示RAAS系统在“孙络疏失”急性期尚未被激活,考虑综合其他RAAS系统作用因子,进一步研究血浆AngⅡ及RAAS系统在“孙络疏失”中的作用规律及机制。以上结果表明“孙络疏失”急性期以微血管舒缩因子动态平衡的破坏,从而导致内皮细胞功能紊乱为特点。
综上所述,在心之络病“孙络疏失”急性期内,并未出现明显的血浆AngⅡ水平升高,而是以微血管内皮细胞功能紊乱为主要病理机制,其中微血管舒缩因子TXA2、PGI2及ET-1异常分泌,伴随它们之间动态平衡遭到破坏,从而诱发或加重“孙络疏失”,多种源于血管内皮细胞的微血管调节因子在“孙络疏失”急性期协同发挥作用,更体现了微血管内皮细胞的功能状态对“心之络病”的重要性。
[1]吴以岭.脉络论[M].北京:中国科学技术出版社,2010:55
[2]贾振华,吴以岭,高怀林,等.“脉络-血管系统病”辨证诊断标准[J].中医杂志,2007,48(11):1027-1032.
[3]Morishima I, Sone T, Okamura K.Angiographic no-reflow phenomenon as a predictor of adverse long-term outcome in patients treated with percutaneous transluminal coronary angioplasty for first acute myocardial infarction[J].J Am Coll Cardiol,2000,36(4):1202-1209.
[4]吴以岭,魏聪,贾振华,等. 脉络学说的核心理论——营卫承制调平[J]. 中医杂志,2013,54(1):3-7.
[5]李贻奎,宁可永,梁嵘,等.大鼠冠状动脉结扎心肌缺血模型方法的改进[J].中国新药杂志,2005,14(4):427-428.
[6]王朋,杨明会,李绍旦,等.孙络与微血管相关性探析[J].环球中医药,2012,5(10):736-738.
[7]祝光礼,陈启兰,陈铁龙,等.冠心合剂对急性心梗大鼠心肌bFGF表达及血管新生的影响[J]. 浙江中西医结合杂志,2011,21(11):758-761,750.
[8]林蔚,白旭东,刘美佳.Tei指数评价大鼠超急性期心肌梗死左心功能[J].中国医学影像技术,2012,28(9):1623-1626.
[9]吴以岭.络病学[M].北京:中国中医药出版社,2006:198.
[10]霍旺,杨明会,李绍旦,等.心之络病“孙络绌急”模型大鼠血浆ET-1、TXB2、6-keto-PGF1а及ANGⅡ的动态变化研究[J].北京中医药,2013,32(10):789-792.
[11]沈晓飞,李佳川,曾勇,等.益心通络颗粒对大鼠急性心肌缺血和血液流变学的影响[J]. 中药药理与临床,2010,26(5):110-112.
[12]黄仕文,戴启刚. 乌头赤石脂丸对寒凝胸痹大鼠血液黏度、TXB_2、6-keto-PGF_(1α)、ET、NO、SOD及MDA的影响[J]. 山西中医学院学报,2012,13(3):56-58.
[13]Ohuchi H, Takasugi H, Ohashi H,et al. Echigo S: Abnormalities of neurohormonal and cardiac autonomic nervous activities relate poorly to functional status in Fontan patients[J].Circulation 2004,110(17):2601-2608.
[14]曹绍华,王云,井雷,等.肺内皮功能障碍与肺动脉高压病变研究进展[J].中国老年学杂志,2012,32(2):433-436.
(本文编辑:蒲晓田)
DynamicalterationsofTXB2,6-keto-PGF1α,ET-1andAngⅡinmodeledratswithcoronaryarteryligation(thepatternofloosenedandweakenedminutecollateralsinthedomainofChinesemedicine):Anobservationalstudy
ZHANGJun-xiu,HUOWang,WANGPeng,etal.
TraditionalChinesemedicinedepartment,People’sLiberationArmyGeneralHospital,Beijing100853,China
YANGMing-hui,E-mail:ymh9651@sina.com
ObjectiveTo explore the way how endothelin-1(ET-1),thromboxaneB2(TXB2), 6-keto-prostaglandin1α(PGF1α) and angiotensinⅡ(AngⅡ) changes in modeled rats with coronary artery ligation (the pattern of loosened and weakened minute collaterals in the domain of Chinese medicine).MethodsA total of 60 male Sprague-Dawley rats with regular ECG performance were randomized into Sham-operation group, 30min-modeling group, a 1h-modeling group, a 6h-modeling group, a 12h-modeling group and a 24h-modeling group. The model of loosened and weakened minute collaterals in heart was established after ligation of the left anterior descending coronary artery, while the sham group was punctured without ligation. The level of plasma ET-1, TXB2, 6-Keto-PGFla and AngⅡ were detected with radioimmunoassay.ResultsCompared with the sham group,the ET-1 levels in the 1h-modeling group, the 6h- modeling group and the 12h- modeling group were significantly increased(P<0.05), then returned to nomal states at 24h. The TXB2levels were obviously increased in the 6h- modeling group(P<0.01), while decreased apparently at the 12h- modeling group and the 24h- modeling group (P<0.05). The 6-keto-PGFlα levels in all the model groups were significantly decreased (P<0.01 orP<0.05), then reached the lowest peak at 12h. The AngⅡ levels in the 30min-group and the 1h-group were obviously decreased (P<0.01 orP<0.05), then reached the low peak at 1h, while returned to nomal level in the 6h- modeling group, the 12h- modeling group and the 24h- modeling group.ConclusionsThe abnormal expression of vasomotor activity factor accompanies with the dynamic equilibrium destruction, due to the dysfunction of microvascular endothelial cell, and it exerts an important effect during the process of pathological change in acute phase of loosened and weakened minute collaterals .
Decrease of minute collaterals; Myocardial ischemia; Endothelin-1; Thromboxane B2; 6-keto-prostaglandin-Flα; AngiotensinⅡ; Rat
国家重点基础研究发展计划(973计划)(2012CB518601)
100853 北京,中国人民解放军总医院中医院中医内科[张俊修(硕士研究生)、霍旺(硕士研究生)、王朋(博士研究生)、李绍旦、刘毅、杨明会]
张俊修(1988-),2012级在读硕士研究生。研究方向:中西医结合基础。E-mail:zjx6373120@126.com
杨明会(1962-),博士,教授,主任医师,博士生导师,中华中医药学会副会长,解放军中医药学会会长,北京中医药学会副会长,北京市中西医结合学会副会长。研究方向:中西医结合基础与临床。E-mail:ymh9651@sina.com
R542.22
A
10.3969/j.issn.1674-1749.2014.02.001
2013-12-12)
