湘莲腐败病菌的鉴定和抑菌药剂筛选
2014-08-07,,,
, ,,
(湖南农业大学植物保护学院/植物病虫害生物学与防控湖南省重点实验室,长沙 410128)
莲藕是促进立体农业发展,整合农、林、牧、渔产业结构的一种重要水生作物品种[1]。湘莲是湘潭市最富特色及最具增长潜能的产业,其年种植面积3 400~4 000 hm2,总产5 000 t左右。在湘莲产业做大做强的过程中,湘莲腐败病的问题也日趋严重。控制该病不仅是广大种植湘莲农户的迫切要求,同时也是湘莲持续发展的需要[2]。为加强对湘莲腐败病的综合防治,本研究对湘莲腐败病病原菌进行鉴定,以了解相关生物学性状;并选择生产中常用的农药,包括百菌清、多菌灵、福美双等,对湘莲腐败病病原菌生长抑制作用进行测定,以找到最适药剂和相应的浓度,为湘莲腐败病的综合治理策略的制定提供技术基础。
1 湘莲腐败病病原菌鉴定
1.1 试验材料
1.1.1 病藕样品采集
选取湖南省湘潭县花石镇粒粒珍湘莲生产基地中发病莲的种藕。采取的病样埋于土壤表层及以下5~15 cm。
1.1.2 试剂与药品
甲醇为HPLC醇(Tedia公司),二甲基亚砜(国药集团),酵母粉,蛋白胨粉,琼脂粉,试验所需无机盐。
1.1.3 培养基
PDA培养基(g/L): 葡萄糖粉20,马铃薯200,琼脂粉18,自然pH。
固体LB培养基(g/L):蛋白胨 10,酵母粉5,氯化钠10,琼脂粉18,调节pH至7.0~7.3。
1.1.4 引物
采用16S rDNA通用引物,序列由上海生工合成并提供,5’端引物5’- AGA GTT TGA TCM TGG CTC AG-3’; 3’端引物5’-TAC GGC TAC CTT GTT ACG ACT T-3’。从北京全式金生物技术有限公司购进Taq酶、dNTP及各类试剂盒。
1.1.5 主要仪器
PCR检测仪器:ABI应用生物系统公司;显微镜带荧光(80I):尼康电器有限公司;强压蒸汽除菌锅:三洋电器有限责任公司;台式冷冻离心机(Micro17R):赛默飞世尔公司;超净工作台(SW-CJ-2G):苏州净化设备有限公司;凝胶成像仪(H6ZO812M):protein simple;恒温振荡器(IS-RDH1):Crystal;电热恒温箱(DHP-9082A):上海飞越试验仪器有限公司;干燥箱(101A-2):江南仪器仪表有限公司;电泳仪(TY0736):伯乐生命科学产品有限公司;冰浴器(ICE01):明日百傲科技有限公司;迷你微离心机(MiniStar):托莫斯科学仪器有限公司; 冰箱(BCD-211we):海尔股份有限公司;涡旋震荡器:其林贝尔精密仪器仪表制造有限公司;电子天平: SHIMADZU。
1.2 试验方法
1.2.1 病原菌的分离和纯化
将感染湘莲腐败病的莲藕样品洗净,切下5 cm长藕段先用无菌水漂洗一次,从罹病藕的病健交界处切取若干块约1.0 cm×1.0 cm×0.4 cm的病组织。用0.1%升汞溶液消毒处理3.5 min,反复用清洁无菌水清洗4次,然后置于灭菌滤纸上。用手术刀切成小块,将带有湘莲腐败病病菌的小块组织接种于PDA平板上(含氨苄青霉素50 mg/L,pH=7),25℃培养7 d。用接种针挑取少量从病组织长出的真菌,用PDA继代培养,再用平板划线法进行菌落分离[4,5]。
1.2.2 形态学鉴定
根据病害症状、菌落形态大小、孢子、菌丝形状长短等的特征来确定病原菌的种属。病菌鉴定方法:根据单孢子菌落直径、产生分生孢子的方法、分生孢子的形状大小、是否有厚垣孢子等方面,从形态学上进行鉴别[6]。
1.2.3 主要病原真菌ITS序列分析
(1)PCR扩增。提取DNA,将培养基上的菌丝加50 μL无菌水用镊子捣碎。经冰浴2 min后,随之沸水浴1 min。如此重复3次后离心(12 000 r/min)。PCR反应体系总体积为200 μL。其中:EsayTaq Duffer 20 μL,正引物4 μL,反引物4 μL,模板4 μL,dNTPs 3 μL,taq酶3 μL,加ddH2O至200 μL。在离心管中用枪头轻轻吸取混匀,分装为4个50 μL的PCR管。采用ITS通用引物ITS1和ITS4(ITS1:5-TCCGTAGGTGAACCTGCGG-3;ITS4:5-TCCTCCGCTTATTGATATGC-3)进行PCR扩增获得ITS序列。PCR反应条件:94℃预变性 5 min,94℃变性30 s,55℃退火40 s,72℃延长60 s;40个循环;最后于72℃延伸10 min,保温于4℃。检验:取PCR产物5 μL和Loading Bμffer 3 μL混匀于1.2%的琼脂糖胶(含1 μL/mL的GelStain)上,用稳定电压110 V电泳30 min。
(2)PCR产物的纯化(使用EasyPure PCR Purification Kit试剂盒)。加40 mL100%乙醇到10 mL WB,取100 μL PCR产物,加入5倍容积的液体BB,充分搅匀后放入吸附柱中,静置1 min,10.000*g离心60 s,弃去流出液。加进650 μL WB,10.000*g离心1 min,弃去流出液。10,000*g离心1 min,去除残留的WB。在清洁的离心管中置入吸附柱,中心放入30 μL EB。洗脱DNA,于-20℃度保存。检验:取PCR产物5 μL和Loading Buffer 3 μL混合均匀在1.2%的琼脂糖胶(含1μL/mL的GelStain)上,用稳定电压100 V电泳55 min。用紫外线测定器观察分析并照相。
(3)克隆(使用pEASY-T3 Cloning Kit试剂盒)反应体系的鉴定。将PCR产物0.4 μL加pEASY-T3 Cloning Vector 1 μL,常温下混匀5 min,反应结束后在冰上放置。转化:将连接产物与50 μL Trans1-T1的感受态细胞混合,在感受态细胞刚刚解冻时加入,轻弹混匀,冰浴20 min。42℃温度下热激30 s,马上放于冰上2 min。加250 μL室温的LB,200 rpm,37℃孵育1 h。取8 μL IPTG与40 μL 20 mg/mL X-gal混合,均匀涂在预备的平板上,37℃温度下静置30 min。设置一个对照组,不放X-gal。取200 μL菌液,4 000 rpm离心60 s,部分上清液弃去。悬浮菌液经微弹,全部菌液用于涂板,37℃培养过夜。
(4)阳性重组子的鉴定。挑选6个白色克隆并编号,分别用10 μL无菌水稀释,涡旋混匀。取1 μL菌液做模板,在25 μL PCR反应体系下,以M13的正引物和反引物进行扩增,对重组子鉴定。PCR参照扩增反应条件。检验:取PCR产物5 μL和Loading Bμffer 3 μL混匀于1.2%的琼脂糖胶(1 μL/mL的GelStain),用稳定电压100 V电泳55 min。用紫外线测定器观察分析并照相。
(5)扩增。取4个50 mL烧瓶分别加20 mL的BL培养基(加40 μL 50 mg/mL的氨苄青霉素),分别加入有阳性反应的菌落,200 rpm37℃过夜培养。扩大培养以后送往铂尚生物技术有限公司长沙测序部 C1测序。测序结果经校对后,采用BLAST软件,在序列雷同性方面进行对比搜索, 找出同源性稍高的相近序列,然后使用MEGA 4.0软件以相邻法(Neighbor-Joning) 建成系统发育树,探究之间的亲缘联系。
1.2.4 致病性测定
采用柯赫氏法则开展。将分离纯化的单菌落用于藕块接种。
各供试菌种在PDA培养基上培养7 d,在无菌情况下,用7 mm无菌打孔器由外向内取饼,在藕块中心接种,注意朝下应为菌丝面,接种完成后在28℃温度条件下的培养箱中对藕块进行保湿培养,5 d后拍照[7]。
1.3 结果与分析
1.3.1 病原菌分离
分离到的病原菌株XL菌丝白色,菌落圆形,呈辐射状,初白色,后呈紫色或紫红色,菌落边缘无色,如图1。

图1 分离到的病原菌株XL
1.3.2 形态学观察
在电子显微镜下观察到菌丝发达,透明无色,有隔,有分枝,如图2。

图2 病原菌株XL的菌丝
在电子显微镜下观察到孢子形状不一,一般为椭圆形、圆柱状或略呈弯曲状,无色,单孢,如图3。

图3 病原菌株XL的孢子
1.3.3 ITS分析
(1) PCR扩增结果图与蓝白斑培养基图。经引物ITS1和ITS4 PCR扩增完毕后,可获得一600 bp上下的条带,如图4。

图4 PCR纯化产物扩增结果
以pEASY载体为载体克隆后筛选到阳性重组子,出现蓝色和白色的菌落,如图5。
图5 克隆蓝白斑培养基图
(2)测序与分析。病原ITS序列测序结果如下:
AGGTGAACCTGCGGAGGGATCATTACCGAGTT TACAACTCCCAAACCCCTGTGAACATACCACTTGTT GCCTCGGCGGATCAGCCCGCTCCCGGTAAAACGGG ACGGCCCGCCAGAGGACCCCTAAACTCTGTTTCTAT ATGTAACTTCTGAGTAAAACCATAAATAAATCAAAA CTTTCAACAACGGATCTCTTGGTTCTGGCATCGATGA AGAACGCAGCAAAATGCGATAAGTAATGTGAATTGC AGAATTCAGTGAATCATCGAATCTTTGAACGCACAT TGCGCCCGCCAGTATTCTGGCGGGCATGCCTGTTCG AGCGTCATTTCAACCCTCAAGCCCTCGGGTTTGGTG TTGGGGATCGGCGAGCCCTTGCGGCAAGCCGGCCC CGAAATCTAGTGGCGGTCTCGCTGCAGCCTCCATTG CGTAGTAGTAAAACCCTCGCAACTGGAACGCGGCG CGGCCAAGCCGTTAAACCCCCAACTTCTGAATGTTG ACCTCGGATCAGGTAGGAATACCCGCTGAACTTAAG CATATCAATAAGCGGAGGA
将检测的序列结果与GenBank中的16S rDNA序列通过Blast软件,进行同源性比对。采用Clustalx2.0对在NCBI查找的具有同源性的基因序列进行多序列比对,采取邻位相连法在软件Mega4.0中建立系统发育进化树,可知相似度最高的是尖镰孢菌。病原菌株XL的系统发育树如图6。

图6 病原菌株XL的系统发育树
1.3.4 致病性回接试验
接种5 d后藕块表面呈褐色,剖面茎部可见近中心的维管束变浅褐色至黑褐色,如图7。
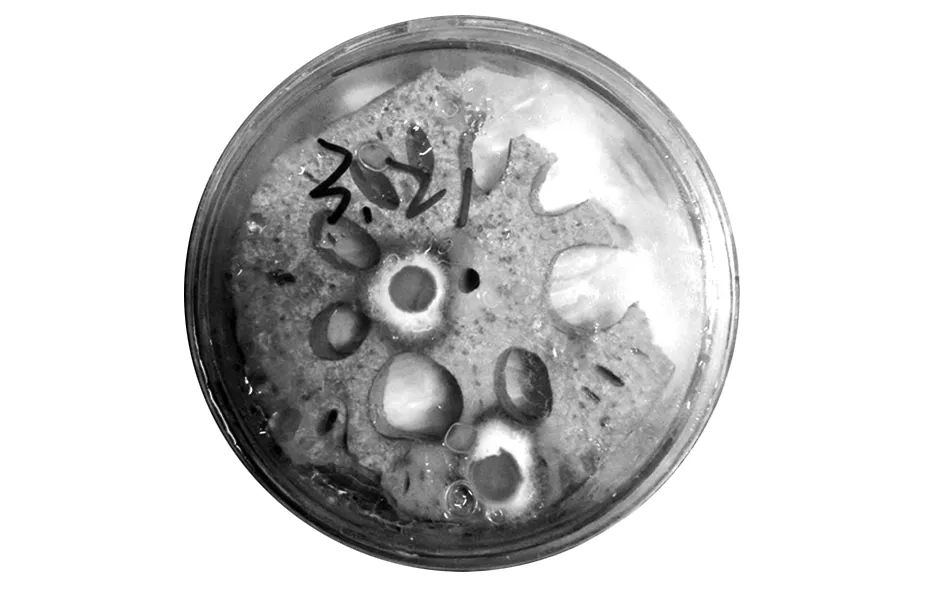
图7 霉菌菌株R1的菌丝
2 不同药剂对湘莲腐败病病原菌的抑制作用
2.1 试验材料
2.1.1 供试材料
本实验室分离的湘莲腐败病病原菌。
2.1.2 供试药剂

表1 6种农药的有效成分、生产厂家和剂型
培养基和主要仪器同前。
2.2 试验方法
2.2.1 强致病性菌株的筛选
采用病原菌菌丝块接种藕块的筛选方法,将接种的藕块置于28℃培养箱中保湿培养,5 d后测定发病病斑的大小和发病藕块的数量。选择发病率最高、所致病斑最大的病原菌作为供试菌株[8]。
2.2.2 常用化学药剂对腐败病菌的室内毒力测定
采用生长速率法用药剂对病原菌毒力的大小进行测定:将供试药剂依据预试验的结果,用无菌水调配成浓度适宜的且具有有效成分的母液,再将供试药剂用巴氏消毒法灭菌(62℃水浴加热30 min[5]),调配相对应的浓度,化学药剂的最终浓度分别为400×、500×、600×、700×等,取2 mL药剂和18 mL融化的PDA混匀,静置冷却成平板。将筛选出的强致病性菌株在PDA上培养5~6 d后,用直径7.0 mm灭菌打孔器取菌饼。将菌丝片接种在具有相应浓度药剂的PDA平板上,设空白灭菌培养基为对照。28℃恒温培养箱培养后,用十字交叉法测量菌落直径。以菌落直径或半径长短平均数值计算菌丝生长抑制比例。然后以药剂浓度的对数为x,药剂抑制率换算的几率值为y,求得药剂对莲藕腐败病菌的毒力回归方程y=a+bx,并由方程计算各供试药剂的抑制中浓度(EC50值)。根据各药剂的抑制中浓度比较其对腐败病菌毒力的大小。所用公式如下:
纯生长量=菌落平均直径-菌饼直径

2.3 室内毒力测定
供试农药对湘莲腐败病菌丝生长的抑制结果见表2。6种农药对湘莲腐败病菌的毒力回归方程、抑制中相关系数r以及浓度(EC50)见表3。比较各供试药剂的EC50值发现,6种农药对湘莲腐败病菌都有一定毒力,但毒力大小差异很大。其中50%硫磺·多菌灵的抑菌效果最好,EC50为19.87 μg/mL;其次为50%多菌灵WP,其EC50为104.11 μg/mL;此外,75%百菌清抑制效果较好,EC50值为108.85 μg/mL;25%腐霉·福美双的效果较差,EC50为381.95 μg/mL;毒力最低的是50%福美双WP,其EC50高达421.63 μg/mL。
表2 6种农药对湘莲腐败病菌丝生长的抑制效果

(续表2)

表3 各处理药剂的毒力回归方程、相关系数和抑制中浓度
3 小结与讨论
从湖南省湘潭县花石镇粒粒珍公司湘莲生产基地中采集的带病种藕上,通过分离、纯化得到病原菌株。该菌落圆形,呈辐射状,初白色,后呈紫色或紫红色,菌落边缘无色,菌丝白色。综合形态学、16S rDNA序列测定及系统发育分析结果,最终将湘莲腐败病病原鉴定为尖镰孢菌。
通过菌丝体生长速率法,测定了生产中防治尖镰孢菌所引起病害的常用化学农药对湘莲腐败病菌强致病株的室内毒力。试验结果表明,不同农药对湘莲腐败病菌都有一定毒力,但毒力大小差异很大。其中50%硫磺·多菌灵的抑菌效果最好,EC50为19.87 μg/mL,其次为多菌灵,福美双的效果最差。这也许是由于各种农药的作用机制不同所致。目前虽然还没有湘莲腐败病菌对农药产生抗药性的报道,但为了延长高效农药的使用年限,避免该病原菌因产生严重抗药性而降低药效,应根据所用药剂的持效期,尽量减少用药次数,并且交替使用作用机理不同的农药。但不同农药之间有无协同增效、交互抗药性,还有待进一步研究。本试验结果虽然证明了化学药剂对莲藕腐败病具有一定的防效,田间施用化学农药仍是控制莲藕腐败病的重要手段,所以有待继续深入研究化学药剂的田间防治,但在今后的研究中,应进一步对其它生物学特性进行研究并提出新的防治方法,尤其探索有效的生物防治方法是今后研究的重点。
[1] 罗海莉,李 洁,严守雷,等.莲藕贮藏期主要致病真菌分离鉴定及其致病相关酶酶学特征研究[J].长江蔬菜,2011,10(16):68-72.
[2] 曾凡荣,曾敬富,桂良杰,等.莲藕腐败病的诊断及综合防控技术初报[J].现代园艺,2010(8):111-112.
[3] 方中达.植病研究方法[M].北京:中国农业出版社,1979.634.
[4] 李志敏.苹果腐烂病的发生与防治[J].河北农业科技,1994(9):27-28.
[5] 蔡信之,黄君红.微生物学(第二版)[M].北京:高等教育出版社,2002.142.
[6] 魏景超,真菌鉴定手册[M].上海:上海科学技术出版社,1979.560.
[7] 梁志怀,魏 林,安哲宇.莲藕腐败病病原菌致病性及遗传差异性的研究[J].长江蔬菜(学术版),2010(14):103-105.
[8] 梁志怀,魏 林,成燕清,等.不同杀菌剂对莲藕腐败病菌的室内毒力测定及田间防治效果[J].长江蔬菜(学术版),2011 (16):60-63.
