铁螯合剂治疗重型β-珠蛋白生成障碍性贫血安全性的Meta分析
2014-08-06张思恒夏苏建
许 燕,张思恒,夏苏建*,江 鸿
(1.暨南大学医学院医学统计学教研室,广州 510632;2.浙江省疾病预防控制中心健康教育所,杭州 310051)
珠蛋白生成障碍性贫血(thalassemia,亦称地中海贫血)是由于血红蛋白的珠蛋白链合成受到部分或完全抑制所引起的一组遗传性溶血性贫血[1]。重型β-珠蛋白生成障碍性贫血(β-thalassemia major,BTSM)患儿出生后3~6个月开始发病,3.4%患儿在5岁之前死亡。定期输血和规范化的去铁治疗是维持病人生存最常见和有效的方法,临床用于去铁治疗的铁螯合剂主要有去铁胺(deferoxamine)和去铁酮(deferiprone)两种药物。去铁胺和去铁酮联合治疗的疗效已经被广泛报道,但是安全性仍然存在争议。本研究以Meta分析的手段,根据已经发表的文献对去铁胺和去铁酮联合治疗BTSM的安全性进行综合定量分析,为BTSM的临床去铁治疗提供参考依据。
1 资料和方法
1.1 检索范围和方法 检索Cochrane图书馆、PubMed、EMBASE、Springer、Ovid、中国期刊全文数据库、中国生物医学文献数据库和维普期刊数据库,文献起止时间均为1985-01-01至2012-09-30。英文检索词:deferiprone,deferoxamine,thalassemia和iron chelation。中文检索词:去铁胺、去铁酮、珠蛋白生成障碍性贫血、地中海贫血和去铁螯合剂。将这些关键词组合不同的检索式进行检索,还手工检索有关珠蛋白生成障碍性贫血的学术会议论文。
1.2 纳入和排除标准[2]由两名评价者各自独立检索和阅读文献,独立摘录相关信息,按照Cochrane图书馆推荐的质量评价表和资料提取表进行质量评价和数据提取,同时对入选研究的设计、实施和分析过程进行再评价,纳入和排除标准[3]:(1)入选的病人不论年龄、性别,但必须为输血依赖性BTSM病人;(2)研究类型必须为随机对照试验(randomized controlled trails,RCTs),不可为评论、书信、观点、案例分析、横断面研究、非随机对照试验和半随机对照试验;(3)试验对照为去铁酮或去铁胺单独治疗,与去铁酮和去铁胺联合治疗比较;(4)安全性判定指标为胃肠道药物不良反应(adverse drug reactions,ADRs)、关节ADRs、粒细胞减少症及皮肤ADRs。
1.3 质量评价 按照Cochrane系统评价员手册所表述的质量评价标准,对纳入文献进行质量评价。评分标准基于以下6点,主要评价项目包括:(1)研究的随机方法是否恰当;(2)是否做到分配隐藏;(3)是否正确采用双盲法;(4)数据是否完整,有无失访或者退出;(5)是否存在选择偏倚;(6)是否存在其他偏倚。根据内容中是、否以及未提及来进行文献等级划分,分A、B、C三等。若满足全部6个条件,则为A等,满足3个及以上条件为B等,3个以下则为C等。
1.4 统计学处理 由于纳入的文献均为前瞻性研究,不良反应的效应量用相对危险度(relative risk,RR)来反映。采用RevMan 5.0统计软件对入选文献进行分析,对各研究进行异质性检验,若异质性检验结果P>0.05,则认为数值为同质性,否则为异质性。同质性数值采用固定效应模型(fixed model)进行Meta分析;异质性数值采用随机效应模型(random model)进行Meta分析。
2 结 果
2.1 文献基本情况 检索到相关文献514篇,通过阅读题目,初筛到临床试验类文献504篇,通过阅读摘要或全文,其中467篇文献因观察指标、研究目的与本研究设计不符,研究对象中包括了其他疾病或为自身对照试验而被剔除。筛选出37篇临床对照试验,通过详细阅读全文,最终纳入10篇有关RCTs文献,均为英文文献,共486名病人,一般情况见表1。根据文献质量评判标准,评判结果如下:A等1篇,B等8篇,C等1篇。
2.2 联合治疗组和单药治疗组的ADRs 由于纳入各研究报道的ADRs之间存在偏差, 首先选择胃肠道、关节、粒细胞减少症和皮肤ADRs作为主要评价指标进行亚组分析, 然后合并分析以比较联合治疗组和单独治疗组在安全性上的差异。
2.2.1 胃肠道ADRs 10篇文献[3-12]均报道了轻到重度的胃肠道ADRs,主要表现为恶心、 呕吐、 腹泻及腹痛等,多见于用药后第一个月。本亚组无异质性(P=0.12,I2=36%),采用固定效应模型,结果显示去铁酮+去铁胺联合治疗组胃肠道ADRs发生率高于单用组,差异具有统计学意义 [RR=5.32,95%CI(3.00,9.46),P<0.000 01]。
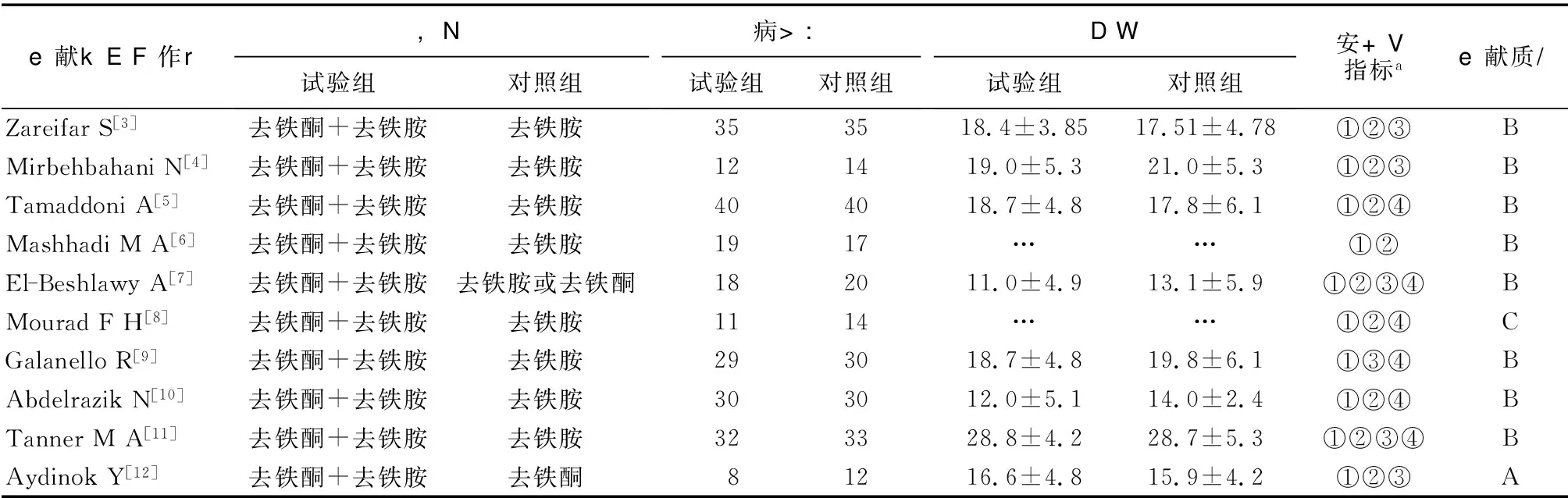
表1 纳入的10篇文献基本情况
2.2.2 关节ADRs 共9篇文献[3-8,10-12]报道了病人出现关节痛、肿胀等症状。本亚组无异质性(P=0.43,I2=1%),采用固定效应模型显示去铁酮+去铁胺联用组关节ADRs发生率高于单用组,差异具有统计学意义[RR=2.50,95%CI(1.25,4.99),P=0.009]。
2.2.3 粒细胞减少症 共6篇文献[3,4,7,9,11,12]报道了粒细胞减少症。研究间具有同质性(P=0.19,I2=33%),采用固定效应模型显示去铁酮+去铁胺联合治疗组粒细胞减少症发生率高于单用组,差异具有统计学意义[RR=2.97,95%CI(1.23,7.13),P=0.02]。
2.2.4 皮肤ADRs 共6篇文献[5,7-11]报道了不同程度的皮肤ADRs,主要表现为注射部位发炎、化脓,皮肤过敏等。研究间具有同质性(P=0.91,I2=0%),采用固定效应模型提示单用去铁胺组皮肤ADRs发生率高于去铁酮+去铁胺联合治疗组,差异具有统计学意义,[RR=0.27,95%CI(0.10,0.69),P=0.006]。
将4个亚组进行合并分析,各亚组间同质性较好(P=0.03,I2=36%),采用固定效应模型,安全性RR合并值为2.38,Z=5.29,95%CI(1.72,3.27),P<0.000 01,差异有统计学极显著意义。安全性比较的Meta分析森林图(图略)显示菱形处于中间线的右侧,提示有去铁胺与去铁酮联合治疗ADRs发生率高于单独治疗组的趋势。
3 讨 论
铁超载是BTSM病人致残和致死的首要原因[13]。20世纪80~90年代,去铁治疗主要采用去铁酮和去铁胺轮换治疗。2003年Mourad等[8]对25名BTSM病人随机应用去铁酮+去铁胺联合治疗或单独治疗,发现联合治疗的疗效优于单独治疗,但ADRs发生率较高。近10年来去铁酮+去铁胺联合治疗越来越多地应用于临床,其ADRs的发生率成为决定病人依从性的关键。
去铁酮+去铁胺联合治疗组发生的ADRs最主要为胃肠道ADRs、关节ADRs和粒细胞减少症,三者发生率均高于单独治疗组。去铁胺安全性好,因其给药途径主要为肌内注射或腹壁皮下注射,因此常见的ADRs为皮肤反应,高剂量时可出现听力损伤。去铁酮为口服用药,常见的ADRs为胃肠道反应、关节病和可逆性粒细胞缺乏症[14]。联合治疗组胃肠道ADRs大多发生于治疗后1个月内。Tamaddoni等[5]报道,部分受试者餐后服用去铁酮可缓解胃肠道症状;部分受试者将去铁酮的剂量暂时减少,然后剂量再逐渐增加,胃肠道症状没有再发生。关节ADRs主要是服用去铁酮引起的,服用剂量减少时症状缓解。粒细胞减少症和粒细胞缺乏症是去铁酮治疗BTSM时一种最严重的ADRs,多出现于服药早期,给予相应治疗后可继续使用去铁酮[15],停药后症状缓解。本次Meta分析显示,粒细胞减少症基本发生于联合治疗组,也有少数发生在单独应用去铁胺时。研究表明,感染丙型肝炎病毒的珠蛋白生成障碍性贫血病人进行去铁治疗时,更易引起粒细胞缺乏或轻度粒细胞减少[16],所以对HCV-RNA阳性的珠蛋白生成障碍性贫血病人应慎用联合治疗。去铁胺单独治疗组皮肤ADRs发生率高于去铁酮+去铁胺联合治疗组,去铁胺静脉给药时每次治疗需连续滴注8~12 h,病人易出现注射部位发炎、过敏。联合治疗大大缩短了珠蛋白生成障碍性贫血病人静脉注射去铁胺的时间,减少了病人的皮肤ADRs发生率。尚有文献报道病人使用去铁酮治疗出现小脑综合征伴随抽搐和耳鸣,因而中断治疗[12],但纳入文献中未见听力损伤等ADRs的报道。本研究文献质量有限,仅一篇为A等,随机方法使用不恰当、未使用盲法等不足可能会影响到结果的客观性和可靠性。
【参考文献】
[1]Zurlo M G,De Stefano P,Borgna-Pignatti C,etal.Survival and causes of death in thalassaemia major[J].Lancet,1989,334 (8653):27-30.
[2]Maggio A,Filosa A,Vitrano A,etal.Iron chelation therapy in thalassemia major:A systematic review with meta-analyses of 1520 patients included on randomized clinical trials[J].Blood Cells Mol Dis,2011,47(3):166-175.
[3]Zareifar S,Jabbari A,Cohan N,etal.Efficacy of combined desferrioxamine and deferiproneversussingle desferrioxamine therapy in patients with major thalassemia[J].Arch Iran Med,2009,12(5):488-491.
[4]Mirbehbahani N,Jahazi A,Rahim Abad H H.The effect of combined therapy with deferoxamine and deferiprone on serum ferritin level of beta-thalassemic patients[J].Hematology,2012,17(3):183-186.
[5]Tamaddoni A,Ramezani M S.Comparison between deferoxamine and combined therapy with deferoxamine and deferiprone in iron overloaded thalassemia patients[J].Iran Red Crescent Med J,2010,12(6):655-659.
[6]Mashhadi M A,Rezvani A R,Naderi M,etal.The best chelation therapy in major thalassemia patients is combination of desferrioxamine and deferiprone[J].Int J Hematol Oncol Stem Cell Res,2011,5(2):19-22.
[7]El-Beshlawy A,Manz C,Naja M,etal.Iron chelation in thalassemia:combined or monotherapy? The Egyptian experience[J].Ann Hematol,2008,87(7):545-550.
[8]Mourad F H,Hoffbrand A V,Sheikh-Taha M,etal.Comparison between desferrioxamine and combined therapy with desferrioxamine and deferiprone in iron overloaded thalassaemia patients[J].Br J Haematol,2003,121(1):187-189.
[9]Galanello R,Kattamis A,Piga A,etal.A prospective randomized controlled trial on the safety and efficacy of alternating deferoxamine and deferiprone in the treatment of iron overload in patients with thalassemia[J].Haematologica,2006,91(9):1241-1243.
[10]Abdelrazik N.Pattern of iron chelation therapy in Egyptian beta thalassemic patients:Mansoura University Children’s Hospital experience[J].Hematology,2007,12(6):577-585.
[11]Tanner M A,Galanello R,Dessi C,etal.A randomized,placebo-controlled,double-blind trial of the effect of combined therapy with deferoxamine and deferiprone on myocardial iron in thalassemia major using cardiovascular magnetic resonance[J].Circulation,2007,115(14):1876-1884.
[12]Aydinok Y,Ulger Z,Nart D,etal.A randomized controlled 1-year study of daily deferiprone plus twice weekly desferrioxamine compared with daily deferiprone monotherapy in patients with thalassemia major[J].Haematologica,2007,92(12):1599-1606.
[13]Borgna-Pignatti C,Rugolotto S,De Stefano P,etal.Survival and disease complications in thalassemia major[J].Ann N Y Acad Sci,1998,850(1):227-231.
[14]黄铭辉,王云龙,李永曙.铁螯合剂在地中海贫血治疗中的研究进展[J].中国新药杂志,2012,21(16):1900-1907.
Huang MingHui,Wang YunLong,Li YongShu.Progress of research on the treatment of thalassemia with iron chelators[J].Chin J New Drugs,2012,21(16):1900-1907.In Chinese with English abstract.
[15]黄晓红,罗序峰.去铁酮治疗高量输血的重型β-地中海贫血患儿临床观察[J].临床儿科杂志,2011,29(5):487-489.
Huang XiaoHong,Luo XuFeng.Hypertransfusion β-thalassemia major children treated by deferiprone[J].J Clin Pediatr,2011,29(5):487-489.In Chinese with English title.
[16]Alymara V,Bourantas D,Chaidos A,etal.Effectiveness and safety of combined iron-chelation therapy with deferoxamine and deferiprone[J].Hematol J,2004,5(6):475-479.
