少棘蜈蚣钠通道毒素NTX-Ssm97的表达、纯化和鉴定
2014-08-06尹世金李羽欣陆春兰邸智勇胡青兰
尹世金 ,李羽欣 ,陆春兰,邸智勇 ,兰 珍 ,胡青兰
(1中南民族大学 药学院,武汉430074;2中南民族大学 生物医学工程学院,武汉430074;3 武汉大学 生命科学学院,武汉430071)
异常的神经病理性疼痛持续时间长、程度强烈,影响了超过20%的人类正常生活[1],神经病理性疼痛的治疗是一个世界性难题[2].针对初级感觉神经元细胞膜电压门控性钠通道寻找和设计高特异性强效抑制剂,是当今开发镇痛药物的重要方向[3]. Nav1.7[4]、Nav1.8[5]和Nav1.9[6]等3个亚型选择性表达在背根神经节、三叉神经节等初级感觉神经元细胞膜上,3类钠通道的表达或功能异常直接导致初级感觉神经元功能异常,是神经病理性疼痛产生的重要分子基础. Nav1.7钠通道由SCN9A基因编码,基因突变导致Nav1.7钠通道功能增强则会引发严重的神经病理性疼痛[7],而引起Nav1.7钠通道功能减弱或丧失的基因突变导致哺乳动物疼觉缺失[8], Nav1.7特异性阻断剂甚至会产生强于吗啡的镇痛效应[9],以Nav1.7钠通道为靶标的抑制剂有望成为治疗神经病理性疼痛的先导药物.
蛇[10]、蝎子[11]、蜈蚣[9]等有毒动物的毒腺组织富含离子通道调节肽,是离子通道调节剂的重要资源库.五毒动物之一的蜈蚣具有祛风止痉、通络止痛、攻毒散结的功效,其毒液是现代医药资源的宝库,Yang S等[9]从蜈蚣毒液中识别了26种神经毒素或神经毒类似物能识别并调节Na+、K+、Ca2+等离子通道功能. Liu ZC等[12]利用构建蜈蚣毒腺cDNA文库和多种生物功能研究相结合,进一步揭示了多种蜈蚣毒腺中肽类生物活性物质.
本文从构建的湖北少棘蜈蚣转录组数据库中筛选到了一种新的毒素多肽基因NTX-Ssm97(图1),经同源序列比对显示该基因编码的成熟肽与哺乳动物Nav1.7钠通道阻断剂μ-SLPTX-Ssm6a[9]高度同源,采用基因工程方法成功获得了NTX-Ssm97成熟肽,将蜈蚣毒腺转录组数据库和基因工程技术结合,为挖掘和生产生物活性多肽提供了有效方法.
1 材料与方法
1.1 材料与试剂
PGEX-4T-1、实验菌株DH5α、E.coli/Rosetta(DE3)等由武汉大学李文鑫教授实验室提供.限制性核酸内切酶BamHI和XhoI、异丙基-β-D-硫代半乳糖苷(IPTG)、PCR所用pfu酶(TakaRa, 日本),PCR产物回收试剂盒、T4DNA连接酶、DNA Marker(Fermentas,加拿大),EGTA、HEPES、Na2-ATP(Sigma),琼脂糖胶回收试剂盒、质粒小量快速提取试剂盒(武汉众一生物技术公司),小分量蛋白Marker(武汉凌飞生物技术公司),小肠激酶(武汉摩尔生物公司),其他试剂均为国产分析纯.
1.2 PGEX-4T-1-NTX-Ssm97重组表达载体的构建
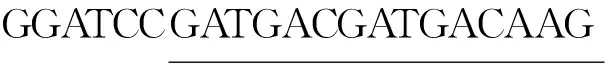
NTX-Ssm97-RP:▲CCGCTCGAGTCATTTGTGCAGCAAAT
CCTGACA (*单下划线为BamHI的酶切位点,双下划线为EK酶的酶切位点;▲单下划线为XhoI的酶切位点).
以少棘蜈蚣毒腺mRNA为模板,反转录得到NTX-Ssm97cDNA,进行PCR反应:94℃预变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,72℃终延伸2 min,循环28次.PCR产物经2%的琼脂糖凝胶电泳后,利用凝胶成像系统进行分析,并用PCR产物回收试剂盒纯化.PGEX-4T-1-NTX-Ssm97重组表达载体的构建方法类似于蝎毒素多肽IM58的表达载体构建[13],即将纯化的NTX-Ssm97PCR产物和质粒PGEX-4T-1用BamHI和XhoI双酶切后连接过夜,将连接产物转化到DH5α感受态细菌中,挑选阳性克隆子分别进行PCR、双酶切和测序鉴定.
1.3 NTX-Ssm97成熟肽的表达、纯化和质谱鉴定
NTX-Ssm97成熟肽的表达、纯化及质谱鉴定方法同蝎毒素多肽IM58[13].将测序正确的PGEX-4T-1-NTX-Ssm97重组质粒转化入受体表达菌E.coliRosetta.挑选阳性菌株在37℃下培养到OD600=0.6时,取10 mL菌液到不同试管中,分别加入不同浓度的IPTG 28℃培养,于2,3,4 h等不同时间点取2 mL菌液,离心收集菌体并加PBS重悬后超声破碎,离心后去取上清液,进行Tricine系统的SDS-PAGE电泳鉴定.在合适的诱导表达条件下进行GST-NTX-Ssm97融合蛋白的大量表达,采用GSH亲和层析法对融合蛋白进行纯化.纯化后经EK酶酶切进行RP-HPLC分离纯化,得到NTX-Ssm97成熟肽,并采用MALDI-TOF-MS精确测量多肽的分子量.
2 实验结果
2.1 NTX-Ssm97基因序列特征分析
NTX-Ssm97的先导cDNA序列全长394 bp,由5′未翻译区(5′UTR)、开放阅读框(ORF)和3′未翻译区(3′UTR)3部分组成,其中5′UTR长13 bp,3′UTR长168 bp,在3′UTR区多聚腺苷酸尾巴上游15 bp处可发现AATAAA加尾信号(见图1a).ORF编码70个氨基酸残基的前肽,SignalPV3.0(http://www.cbs.dtu.dk/services/SignalP/)在线预测提示NTX-Ssm97前肽中含有23个氨基酸残基构成的信号肽,紧跟其后的是由47个氨基酸残基构成的成熟肽,成熟肽通过6个半胱氨酸形成的三对二硫键维持空间结构.同源序列比对分析发现,与已报道的蜈蚣毒素多肽μ-SLPTX-Ssm6a相比[9],NTX-Ssm97除多了一个酸性谷氨基酸残基外,其它46个氨基酸残基序列完全相同,二者具有极高的同源性(见图1b).μ-SLPTX-Ssm6a能选择性阻断哺乳动物Nav1.7通道电流[9],故推测NTX-Ssm97成熟肽可能具有类似功能.

单下划线:信号肽;双下划线:加尾信号aataaa;灰色背景字体:半胱氨酸残基;数字:氨基酸残基位次图1 NTX-Ssm97的cDNA和氨基酸序列(a)及其与μ-SLPTX-Ssm6a成熟肽序列比对结果(b)Fig.1 The cDNA and amino acids sequence of NTX-Ssm97(a) and sequence alignments of peptide NTX-Ssm97 with μ-SLPTX-Ssm6a(b)
2.2 PGEX-4T-1-NTX-Ssm97原核表达载体的构建
PGEX-4T-1质粒为基因工程中最常用的原核诱导表达载体之一,自身携带的谷胱甘肽转移酶(GST)编码基因为外源目的多肽表达和分离纯化提供了良好的分选标签(见图2a).本文拟利用BamH I和XhoI内切酶将NTX-Ssm97成熟肽编码基因插入到PGEX-4T-1质粒GST编码基因下游的多克隆位点中,构建PGEX-4T-1-NTX-Ssm97原核表达载体[13](见图2a).对少棘蜈蚣毒腺组织cDNA进行PCR扩增,获得了NTX-Ssm97成熟肽全长编码片段,电泳可见一条约180 bp的亮带,与理论值相符(见图2b).对PCR产物和PGEX-4T-1质粒进行BamH I和XhoI双酶切连接转化后,获得了转化有PGEX-4T-1-NTX-Ssm97重组质粒的Rosetta阳性菌落,阳性菌提取质粒后进行BamH I和XhoI双酶切,也获得了约180 bp的DNA片段(见图2c),测序证明了重组的原核表达载体PGEX-4T-1-NTX-Ssm97构建成功,可用于GST-NTX-Ssm97融合蛋白的诱导表达.
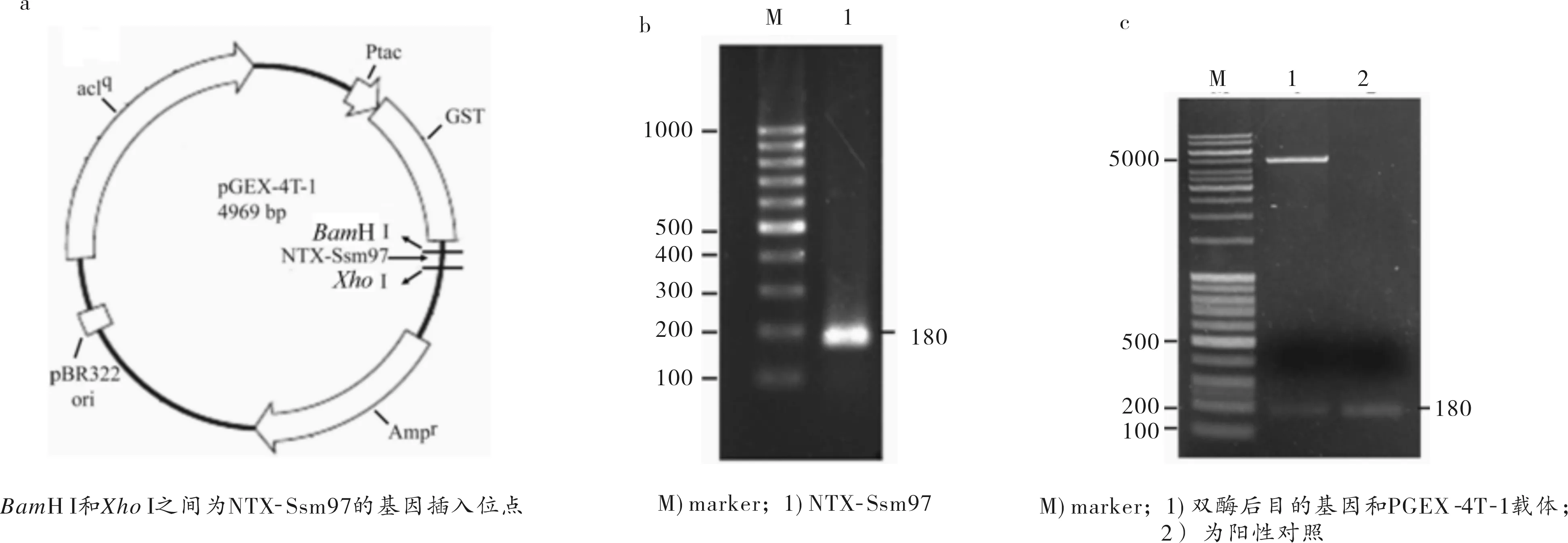
图2 a) PGEX-4T-1-NTX-Ssm97载体的构建;b) NTX-Ssm97基因扩增产物;c) PGEX-4T-1-NTX-Ssm97的BamH I和Xho I双酶切结果Fig.2 a)The construction of PGEX-4T-1-NTX-Ssm97 vectors;b)The amplification product of NTX-Ssm97 gene;c) The restriction enzyme digestion of PGEX-4T-1-NTX-Ssm97 by BamH I and Xho I
2.3 GST-NTX-Ssm97融合蛋白诱导表达条件的优化
Rosetta为基因工程中常用的原核表达菌株,其对外源蛋白的表达产量受多种因素的影响,细菌生长温度、加入诱导剂前细菌的生长浓度、诱导剂IPTG的浓度和诱导时程最为关键[14]. 根据已有文献[14],将细菌生长环境温度设定为28℃,当Rosseta培养到OD600=0.6时,通过改变加入的IPTG浓度和诱导时程来优化GST-NTX-Ssm97融合蛋白诱导表达条件,.结果如图3所示.由图3可见,28℃IPTG浓度为1.0 mmol/L时,在一定时程内,随着诱导时间的延长,多肽表达产量逐渐升高,当诱导4 h后产量最高,与诱导5 h无差异. 28℃诱导4 h对比不同浓度的IPTG对GST-NTX-Ssm97融合蛋白表达产量的影响,发现1.0 mmol/L IPTG诱导效果好,故以28℃,1.0 mmol/L IPTG诱导4 h后收获细菌进行蛋白纯化和鉴定.
2.4 NTX-Ssm97成熟肽的分离纯化和鉴定
根据优化的诱导表达条件,含有重组质粒PGEX-4T-1-NTX-Ssm97的大肠杆菌Rosseta培养至OD600=0.6时,加入1.0 mmol/L的IPTG诱导4 h后离心破菌收集菌体上清液,SDS-PAGE电泳显示菌体上清蛋白中多出一道约31 KD的条带,该条带是GST-NTX-Ssm97融合蛋白.经GST亲和层析柱纯化的GST-NTX-Ssm97融合蛋白通过超滤脱盐浓缩后,用EK酶酶切,在SDS-PAGE电泳图上显示两条主要的条带,一条为26KD的GST,另一条为5KD的NTX-Ssm97成熟肽(见图4a).经EK酶酶切后的蛋白混合物进行RP-HPLC的C18柱分离纯化,经47 min的溶液多梯度洗脱后,230 nm紫外波长下检测显示,NTX-Ssm97成熟肽和GST蛋白分离良好,于19 min和29.5 min出峰(见图4b). RP-HPLC分离纯化的NTX-Ssm97成熟肽经MALDI-TOF-MS测定其分子量为5447.7(见图4c),与NTX-Ssm97成熟肽理论值一致,说明NTX-Ssm97成熟肽表达成功并获得了良好的分离纯化.
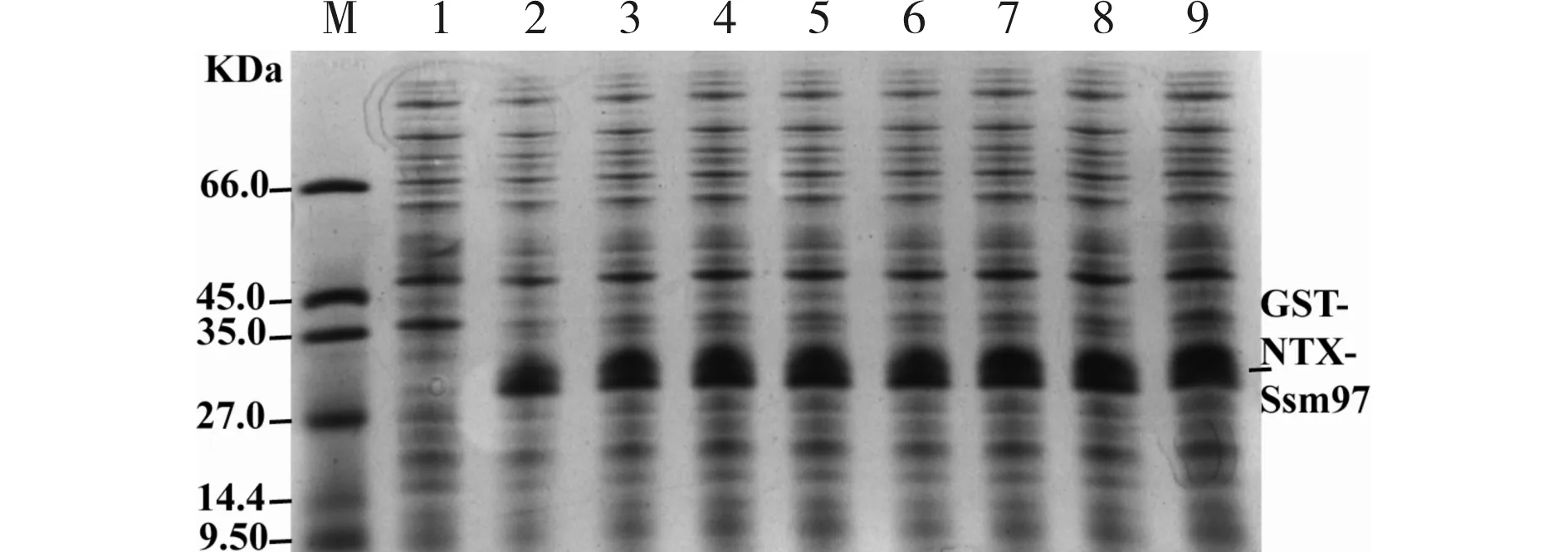
M) 标准蛋白marker;1) 未加IPTG诱导;2~5) 分别为28℃1mmol/L IPTG诱导2, 3, 4, 5 h ;6~9) 分别为0.5, 1.0, 1.5, 2.0 mmol/L IPTG在28℃诱导4 h图3 不同诱导条件下表达的GST-NTX-Ssm97融合蛋白SDS-PAGE电泳分析Fig.3 The electrophoresis analysis of GST-NTX-Ssm97 fusion protein by SDS-PAGE under different inducing conditions
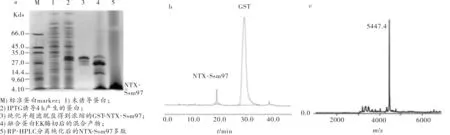
图4 a) 纯化的NTX-Ssm97多肽SDS-PAGE电泳分析;b) NTX-Ssm97多肽的RP-HPLC纯化结果;c) NTX-Ssm97多肽的MALDI-TOF-MS质谱分析Fig.4 a) The electrophoresis analysis of purified NTX-Ssm97 peptides by SDS-PAGE;b) The purification result of NTX-Ssm97 peptides by RP-HPLC;c) The mass spectrometry of NTX-Ssm97 peptides by MALDI-TOF-MS
3 讨论
本研究从湖北少棘蜈蚣毒腺转录组数据库中发现了一条新的蜈蚣毒素多肽基因NTX-Ssm97,通过基因工程的方法构建了PGEX-4T-1-NTX-Ssm97表达载体,在基因工程菌Rosseta中实现了GST-NTX-Ssm97融合蛋白诱导表达条件的优化,融合蛋白经EK酶酶切后在RP-HPLC系统中进行了NTX-Ssm97成熟肽的分离,并经MALDI-TOF-MS成功鉴定了NTX-Ssm97成熟肽的分子量.
NTX-Ssm97成熟肽与已报道的μ-SLPTX-Ssm6a高度同源[9],除NTX-Ssm97成熟肽多了一个谷氨酸酸性残基外,二者剩余的46个氨基酸残基完全相同,它们来自于同一物种的相同亚种,高度同源性提示二者可能为同一基因编码,因为产地的不同导致了多肽氨基酸序列上的微小差异. 经比较两者cDNA序列发现各自的编码基因不同,提示同一亚种的少棘蜈蚣在不同产地会产生毒素多肽编码基因的变异,丰富了物种多样性的概念,说明不同产地的同一亚种相同生物活性多肽编码基因的微小变异极有可能改变成熟肽的一级结构和空间结构,进而影响多肽的生物功能.
电压门控性钠通道主导了哺乳动物初级感觉神经元动作电位的发放,介导了外周伤害性刺激信息的中枢传入,是开发镇痛药物的良好分子靶标.目前哺乳动物电压门控性钠通道的三维结构尚未得到完整解析,对其结构的推测仅仅依据哺乳动物电压们控性钾通道的空间结构[15],或者参考原核生物钠通道的晶体结构数据[16].靶向离子通道的生物活性多肽作为分子探针,能提供离子通道蛋白重要的结构和功能信息[17],但目前已报道的多肽大多通过改变钠通道门控特性而增强钠通道的功能,如BmkM1[18]、BmαTX14[14]等.μ-SLPTX-Ssm6a是一种新的选择性抑制哺乳动物Nav1.7通道的生物活性肽,具有强于吗啡的镇痛生物活性[9],因其从少棘蜈蚣毒液中直接提取,此法不足以对毒素多肽结构进行精细改造.本研究报道的NTX-Ssm97与μ-SLPTX-Ssm6a和μ-SLPTX-Ssm1a[19]多肽高度同源,μ-SLPTX-Ssm1a也能特异性阻断大鼠背根神经节TTX敏感性钠通道电流,提示NTX-Ssm97可能也具有类似功能.
本研究通过基因工程的方法成功得到NTX-Ssm97成熟肽,其表达纯化条件同样合适μ-SLPTX-Ssm6a多肽,为后者研究Nav1.7钠通道结构与功能成为可能,NTX-Ssm97成熟肽还为研发新型镇痛药物提供了可能的先导药物,为研究哺乳动物电压门控性钠通道提供了分子工具.
参 考 文 献
[1] Brennan F, Carr D B, Cousins M. Pain management: A fundamental human right [J].Anesth Analg, 2007, 105(1):205-221.
[2] Attal N. Pharmacological treatment of neuropathic pain in primary care [J]. Rev Prat, 2013, 63(6):795-802.
[3] Priest B T. Future potential and status of selective sodium channel blockers for the treatment of pain [J]. Curr Opin Drug Discov Devel, 2009, 12(5):682-692.
[4] Shields S D, Cheng X, Uceyler N,et al. Sodium channel Na(v)1.7 is essential for lowering heat pain threshold after burn injury [J]. J Neurosci, 2012, 32(32):10819-10832.
[5] Thakor D K, Lin A, Matsuka Y, et al.Increased periphe-ral nerve excitability and local NaV1.8 mRNA up-regulation in painful neuropathy [J]. Molecular Pain, 2009, 5(14):1-12.
[6] Amaya F, Wang H, Costigan M, et al. The voltage-gated sodium channel Na(v)1.9 is an effector of peripheral inflammatory pain hypersensitivity [J]. J Neurosci, 2006, 26(50):12852-12860.
[7] Hoeijmakers J G, Han C, Merkies I S,et al. Small nerve fibres, small hands and small feet: a new syndrome of pain, dysautonomia and acromesomelia in a kindred with a novel NaV1.7 mutation [J].Brain, 2012, 135(2):345-358.
[8] Duan G, Xiang G, Zhang X, et al.A single-nucleotide polymorphism in SCN9A may decrease postoperative pain sensitivity in the general population [J]. Anesthesiology, 2013,118(2):436-442.
[9] Yang S, Xiao Y, Kang D, et al. Discovery of a selective NaV1.7 inhibitor from centipede venom with analgesic efficacy exceeding morphine in rodent pain models [J].Proc Natl Acad Sci U S A, 2013, 110(43):17534-17539.
[10] Diochot S, Baron A, Salinas M, et al. Black mamba venom peptides target acid-sensing ion channels to abolish pain [J]. Nature, 2012, 490(7421):552-555.
[11] Shijin Y, Hong Y, Yibao M, et al. Characterization of a new Kv1.3 channel-specific blocker, J123, from the scorpion ButhusmartensiiKarsch [J]. Peptides, 2008, 29(9):1514-1520.
[12] Liu Z C,Zhang R,Zhao F,et al. Venomic and transcri-ptomic analysis of centipede Scolopendra subspinipes dehaani [J]. J Proteome Res, 2012, 11(12):6197-6212.
[13] 尹世金, 兰 珍, 李羽欣.海南斑等蝎钾通道阻断剂Im58的克隆、表达、纯化和鉴定[J].中南民族大学学报:自然科学版, 2013, 32(2): 36-40.
[14] Dai H, Yin S, Li T, et al. Recombinant expression, purification, and characterization of scorpion toxin BmαTX14 [J]. Protein Expr Purif, 2012, 82(2):325-331.
[15] O′Reilly A O, Khambay B P, Williamson M S, et al. Modelling insecticide-binding sites in the voltage-gated sodium channel [J].Biochem J,2006, 396(2):255-263.
[16] Payandeh J, Gamal El-Din T M, Scheuer T, et al. Crystal structure of a voltage-gated sodium channel in two potentially inactivated states [J]. Nature, 2012, 486(7401):135-139.
[17] Yin S J, Jiang L, Yi H, et al. Different residues in channel turret determining the selectivity of ADWX-1 inhibitor peptide between Kv1.1 and Kv1.3 channels [J]. J Proteome Res, 2008, 7(11):4890-4897.
[18] Ye X, Bosmans F, Li C, et al. Structural basis for the voltage-gated Na+channel selectivity of the scorpion alpha-like toxin BmK M1 [J].J Mol Biol, 2005, 353(4):788-803.
[19] Yang S, Liu Z, Xiao Y, et al. Chemical punch packed in venoms makes centipedes excellent predators [J]. Mol Cell Proteomics, 2012, 11(9):640-650.
