高糖条件下心脏成纤维细胞对心肌细胞肥大的影响
2014-08-04赵龙刘玲玲李晓丽周艳芳王好张赢予孔彪沈冬丽张国辉
赵龙,刘玲玲,李晓丽,周艳芳,王好,张赢予,孔彪,沈冬丽,张国辉
(江苏大学附属人民医院心内科,江苏镇江212002)
高糖条件下心脏成纤维细胞对心肌细胞肥大的影响
赵龙,刘玲玲,李晓丽,周艳芳,王好,张赢予,孔彪,沈冬丽,张国辉
(江苏大学附属人民医院心内科,江苏镇江212002)
目的:研究高糖条件下心脏成纤维细胞对心肌细胞肥大的影响。方法:将体外分离培养的SD乳鼠心肌细胞、心脏成纤维细胞随机分为心肌细胞低糖组(A组),心肌细胞高糖组(B组),心肌细胞、心脏成纤维细胞共培养高糖组(C组),心肌细胞、心脏成纤维细胞共培养加转化生长因子β1(transforming growth factor-β1,TGF-β1)中和抗体高糖组(D组),心脏成纤维细胞低糖组(E组),心脏成纤维细胞高糖组(F组)。培养0,6,12,24,48,72 h后,倒置显微镜观察细胞形态、拍照并计算心肌细胞表面积,RT-PCR检测心肌细胞肥大标志物心房钠尿肽(atrial natriuretic peptide,ANP)、β-肌球蛋白重链(β-myosin heavy chain,β-MHC)mRNA表达水平,ELISA检测各组培养液中TGF-β1表达量。结果:培养48 h时,B组心肌细胞表面积比A组显著增加(P<0.05),而C组在培养24 h时心肌细胞表面积已显著高于A组(P<0.05)。RT-PCR显示B组和D组细胞在培养12 h时,ANP、β-MHCmRNA显著升高(P<0.05),培养24 h时达高峰;而C组在培养6 h时ANP、β-MHCmRNA即显著升高(P<0.05),培养12 h时达高峰。ELISA检测结果显示,培养12 h起B组、D组TGF-β1的表达均显著高于A组(P<0.05),而在培养6 h时C组TGF-β1的表达即已显著高于A组(P<0.05)。F组各时间点成纤维细胞TGF-β1的表达均高于E组,差异有统计学意义(P<0.05)。结论:心脏成纤维细胞在高糖条件下可能通过旁分泌TGF-β1促进心肌细胞的肥大。
高糖;心脏成纤维细胞;心肌细胞;转化生长因子β1;心肌肥大
糖尿病心肌病(diabetic cardiomyopathy,DCM)病理表现为心肌肥大、细胞外基质沉积和心肌纤维化等,有关心肌细胞肥大的发病机制尚不确切,但高血糖能直接作用于心肌细胞致其肥大已被广泛证实[1-3]。最新研究表明心脏成纤维细胞能够介导心肌细胞的肥大[4],但其机制尚未完全阐明。本实验通过观察高糖条件下心脏成纤维细胞对心肌细胞肥大的作用,以探讨高糖条件下心脏成纤维细胞对DCM心肌细胞肥大的可能作用机制。
1 材料与方法
1.1 实验动物与主要试剂健康的0~3日龄SD乳鼠(江苏大学动物实验中心提供),DMEM、胰蛋白酶、5溴脱氧尿嘧啶核苷(美国Sigma公司),标准胎牛血清(美国Hyclone公司),Millicell插入式培养皿(美国Mlilipore公司),转化生长因子β1(TGF-β1)中和抗体(美国R&D公司),倒置相差显微镜(日本尼康公司),Trizol(上海生工生物工程公司),大鼠TGF-β1ELISA试剂盒(上海奇康生物科技公司),RT-PCR试剂盒(TaKaRa公司),其余生化试剂均为进口分装或国产分析纯。
1.2 方法
1.2.1 SD乳鼠心肌细胞、心脏成纤维细胞的分离、培养 取0~3 d健康SD乳鼠,超净工作台无菌条件下取出心脏,置于4℃预冷的PBS液中吹洗3次,将心脏剪成1 mm3的组织块用0.08%的胰蛋白酶37℃水浴箱中振荡消化8 min,吸弃前2次消化液,以后收集每次消化后的上清置于含等体积20%胎牛血清的DMEM中中和。重复上述消化过程3~5次,将收集的细胞悬液离心、重悬、过滤、接种,接种细胞加入到含10%胎牛血清的DMEM中37℃、5% CO2孵育箱中差速培养1.5 h,心肌细胞和心脏成纤维细胞得以分离并分别培养。心肌细胞的培养基中加入0.1 mmol/mL的5溴脱氧尿嘧啶核苷来抑制心脏成纤维细胞的生长,得到高纯度的心肌细胞,按用途以不同密度接种于6孔板中,置于37℃、5% CO2孵育箱中培养待用。
1.2.2 实验分组 将体外分离的心肌细胞、心脏成纤维细胞随机分为心肌细胞低糖组(A组),心肌细胞高糖组(B组),心肌细胞、心脏成纤维细胞共培养高糖组(C组),心肌细胞、心脏成纤维细胞共培养加TGF-β1中和抗体高糖组(D组),心脏成纤维细胞低糖组(E组),心脏成纤维细胞高糖组(F组)。低糖组葡萄糖浓度为5.6 mmol/L,高糖组葡萄糖浓度为25 mmol/L。用于形态学观察时6孔板中每孔接种心肌细胞密度为(10~20)×104/mL,用于mRNA测定时6孔板中每孔接种心肌细胞密度为(50~60)×104/mL。
1.2.3 共培养体系的建立 C组和D组取第2代成纤维细胞,以心脏成纤维细胞比心肌细胞为1∶4的比例加入到共培养插件Millicell装置中,预培养12 h后将Millicell插件插入到预先培养心肌细胞的6孔板中,建立心肌细胞和心脏成纤维细胞非直接接触的共培养体系。
1.2.4 心肌细胞形态学观察及心肌细胞表面积的计算 倒置相差显微镜下观察心肌细胞形态学变化及搏动情况,并于相应处理后0,24,48,72 h拍照,拍照后每组随机取5个视野,每个视野随机取6个细胞,共30个细胞,使用NIS-Elements软件(Nikon倒置相差显微镜自带软件)计算心肌细胞表面积。
1.2.5 RT-PCR检测心房钠尿肽(ANP)、β-肌球蛋白重链(β-MHC)mRNA的表达 以Trizol法提取细胞总RNA,以β-肌动蛋白为内参。引物由上海生工生物工程公司合成,ANP上游引物:5′-GGGTAGGATTGACAGGATTGG-3′,下游引物:5′-CGTGATAGATGAAGACAGGAAGC-3′,产物长度199 bp;β-MHC上游引物:5′-AGGAACAGGCCAACACCAAC-3′,下游引物:5′-CAAAGGCTCCAGGTCTCAGG-3′,产物长度209 bp;β-肌动蛋白上游引物:5′-CACCCGCGAGTACAACCTTC-3′,下游引物:5′-CCCATACCCACCATCACACC-3′,产物长度207 bp。按试剂盒说明反转录合成cDNA,然后以cDNA为模板进行目的片段的PCR扩增。反应条件:95℃30 s,然后95℃5 s,60℃34 s,共40个循环。PCR产物的特异性通过熔解曲线分析确认。反应结束后,数据以2-ΔΔCT法表达。
1.2.6 ELISA法检测各组细胞培养上清中TGF-β1含量 各培养组在处理前更换为无血清培养基进行培养,分别抽取低、高糖处理0,6,12,24,48,72 h培养液离心后留取上清,按ELISA试剂盒操作,酶标仪(450 nm)检测各孔光密度值,根据标准曲线计算各组细胞培养上清中TGF-β1浓度。
1.3 统计学处理
应用SPSS 19.0统计软件进行数据处理和分析,所有数据以均数±标准差(¯x±s)表示,多组数据比较采用单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 心肌细胞形态学观察及细胞表面积计算结果
刚分离接种后的心肌细胞呈圆形,培养4 h后细胞开始贴壁生长,逐渐由圆形变为梭形,偶见单个细胞开始搏动;24 h后细胞开始伸开,伸出伪足,部分变为棒状、三角形、多边形及不规则形态,90%以上细胞开始搏动,频率75~150次/min,3 d后细胞伪足交织成网,形成细胞单层或细胞簇,其搏动呈现同步化。
心肌细胞贴壁48 h换液做相应处理后,于0,24,48,72 h在倒置相差显微镜下拍照(图1)。根据细胞照片统计心肌细胞表面积,结果显示,24 h时B组心肌细胞表面积和A组间差异无统计学意义(P>0.05),C、D组心肌细胞表面积显著高于A组,且C组显著高于B组、D组,差异均有统计学意义(P<0.05);48 h、72 h时B、C、D组心肌细胞表面积均显著高于A组,且C组心肌细胞表面积均显著高于B组、D组,差异均有统计学意义(P<0.05)(表1)。

图1 培养不同时间后的心肌细胞形态(倒置显微镜×200)
表1 各组心肌细胞培养不同时间表面积 μm3,±s,n=30

表1 各组心肌细胞培养不同时间表面积 μm3,±s,n=30
a:P<0.05,与A组比较;b:P<0.05,与B、D组比较
组别0 h 24 h 48 h 72 h A组 562.26±84.43 667.31±126.42 734.89±120.75 843.38±142.96 B组 569.87±121.98 717.31±134.67 1 107.90±207.41a 1 473.50±306.97a C组 544.32±155.21 1 102.72±239.44a,b 1 458.35±310.42a,b 1 804.10±400.23a,b D组 546.22±55.78 796.40±79.67a 1 137.24±151.56a 1 594.06±64.96a F值>0.05 <0.05 <0.05 <0.05 1.03 46.64 57.21 62.02 P值
2.2 各组心肌细胞ANP、β-MHCmRNA的表达
RT-PCR显示B组和D组细胞在培养12 h时,ANP、β-MHCmRNA显著升高(P<0.05),培养24 h时达高峰;而C组在培养6 h时ANP、β-MHCmRNA即显著升高(P<0.05),培养12 h时达高峰;D组培养24 h时ANP、β-MHC mRNA的表达较B组显著增高(P<0.05),且以后都高于B组,但低于C组。见图2。
2.3 各组细胞培养液中TGF-β1的表达
ELISA法检测结果显示,B、D组细胞在培养12 h以后各时间段TGF-β1的表达均高于A组相应时间(P<0.05),而C组在培养6 h时TGF-β1的表达即已显著显高于A组(P<0.05),C组在培养12,24,48,72 h各时间点TGF-β1的表达均显著高于B组、D组相应时间(P<0.05)(表2)。F组各时间段TGF-β1的表达都明显高于E组相应时间(P<0.05)(表3)。
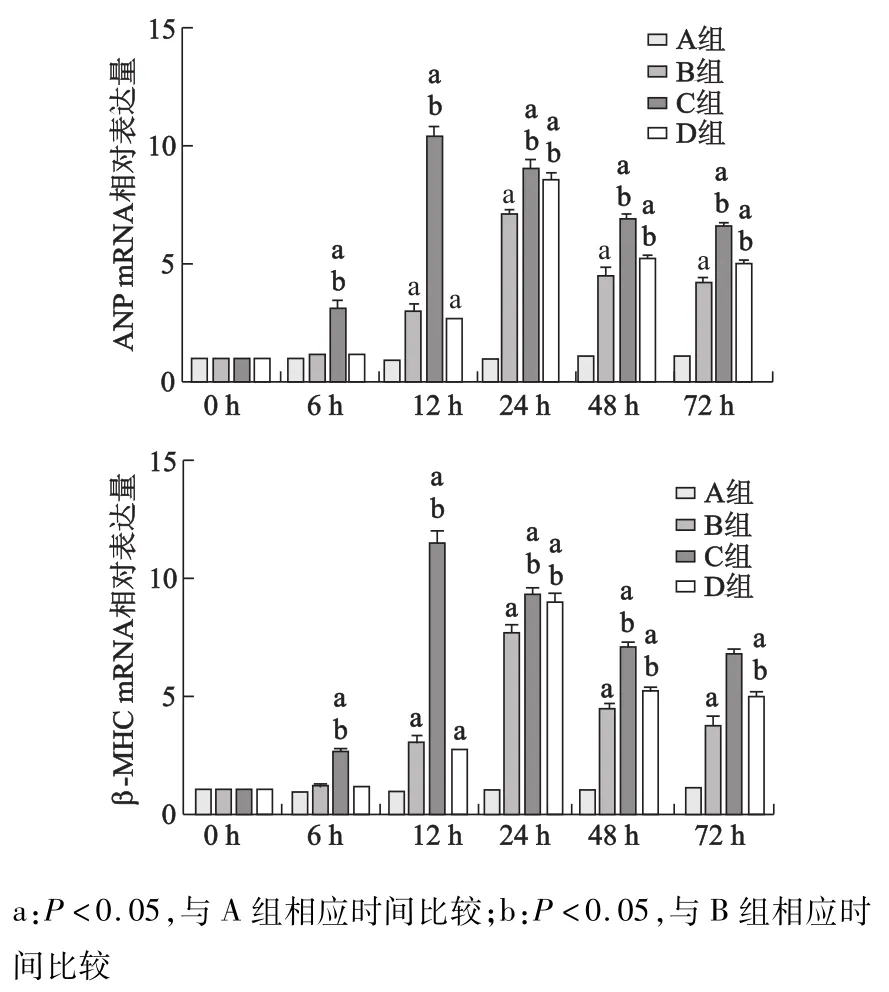
图2 各组心肌细胞不同培养时间ANP、β-MHC mRNA的表达
表2 各组心肌细胞不同培养时间上清中TGF-β1的含量 pg/m L,±s,n=3

表2 各组心肌细胞不同培养时间上清中TGF-β1的含量 pg/m L,±s,n=3
a:P<0.05,与A组比较;b:P<0.05,与B组、D组比较
组别6 h 12 h 24 h 48 h 72 h A组 1 251.98±2.57 1 261.69±16.69 1 272.37±10.08 1293.72±13.18 1 344.40±14.81 B组 1 255.41±14.54 1 302.81±8.35a 1 530.79±25.06a 1 683.82±5.27a 1 696.69±6.37a C组 1 270.45±8.13a 1 365.42±7.96a,b 1 756.16±13.12a,b 1 827.37±27.85a,b 1 850.15±22.05a,b D组 1 267.17±6.65 1 294.25±9.30a 1 532.1±24.09a 1 704.87±6.65a 1 705.61±8.97a F值2.37 45.32 313.26 629.43 671.41 P值 >0.05 <0.05 <0.05 <0.05 <0.05
表3 心脏成纤维细胞培养上清中TGF-β1的含量 pg/m L,±s,n=3

表3 心脏成纤维细胞培养上清中TGF-β1的含量 pg/m L,±s,n=3
组别6 h 12 h 24 h 48 h 72 h E组 1 276.28±12.26 1 331.25±8.81 1 530.91±21.84 1 5.27 7.76 8.70 12.62 16.93 P值550.88±15.09 1 581.16±8.71 F组 1 300.88±5.76 1 468.03±32.34 1 610.43±21.63 1 680.35±5.64 1 780.41±16.17 t值<0.05 <0.05 <0.05 <0.05 <0.05
3 讨论
DCM是一种特异性心肌病,其发病不依赖于高血压、冠心病、心脏瓣膜病、先天性心脏病和其他已知心脏疾病。其发病机制尚不确切,但根本上是由于高血糖、胰岛素缺乏或胰岛素抵抗与高胰岛素血症所引起的一系列级联反应所致,各因素间相互影响,共同促进疾病的进展。作为糖尿病所致心力衰竭的重要原因之一,DCM受到了广泛的关注。
持续的高血糖被认为是DCM的重要发病机制,心肌肥大和继发的心力衰竭是DCM显著的临床表现。研究发现,高糖条件下能够诱导离体大鼠心肌细胞发生肥大,但其机制未明确阐述[1-3]。本实验在高糖条件下对心肌细胞进行单独培养也诱导出了心肌肥大,与上述研究一致。除高血糖能引起心肌细胞肥大外,在成人心脏中成纤维细胞能够调节心肌细胞的肥大[4-5]。心脏成纤维细胞是维持心脏正常功能的主要组成部分,对应激和损伤具有重要作用,其与周围的心肌细胞存在旁分泌作用以及直接的细胞—细胞相互作用。心脏成纤维细胞和心肌细胞通过旁分泌向周围微环境释放蛋白质来调节周围的细胞,心脏成纤维细胞可能通过激素的旁分泌途径调节心肌细胞的表型,心肌细胞也可能通过相同的形式调节心脏成纤维细胞的表型[2]。
研究发现参与成纤维细胞和心肌细胞之间旁分泌的细胞因子有TGF-β1、FGF2、IL-6家族,以及最近发现的IL-33因子。TGF-β1是一种多功能的细胞间信号蛋白,调节多种靶基因的转录和表达,具有多种生物学效应。TGF-β1在心肌细胞和心脏成纤维细胞都有表达,而且高糖能够刺激心脏成纤维细胞高表达TGF-β1[6]。我们的实验也证明了这一结果。研究表明TGF-β1参与心肌肥大的过程[7],其致心肌肥大作用与TGF-β1结合其受体并激活Smad通路有关[8],该过程或许参与了人类肥厚性心肌病的发病机制。
本实验通过建立心肌细胞、心脏成纤维细胞共培养模型,观察高糖条件下心脏成纤维细胞对心肌细胞肥大的作用及可能途径。结果表明,高糖诱导了体外培养心肌细胞的肥大,高糖共培养条件下心脏成纤维细胞明显促进了心肌细胞的肥大,表现在肥大时间的提前和肥大程度的加剧。高糖共培养下应用TGF-β1中和抗体后心肌细胞肥大程度与高糖共培养组相比有所抑制,但仍比高糖组心肌细胞肥大明显。这表明TGF-β1参与了高糖条件下心脏成纤维细胞影响心肌细胞肥大的过程,但不是唯一途径。
综上,高糖条件下心脏成纤维细胞促进了心肌细胞的肥大,心脏成纤维细胞旁分泌的TGF-β1可能参与了这一过程,但具体机制还不明确,有待于进一步的研究。针对心脏成纤维细胞对心肌细胞肥大机制的研究,可能为临床上对DCM及其他心肌病的防治提供新的治疗思路和方法。
[1] Chen S,Khan ZA,Karmazyn M,et al.Role of endothelin-1,sodium hydrogen exchanger-1 and mitogen activated protein kinase(MAPK)activation in glucose-induced cardiomyocyte hypertrophy[J].Diabetes Metab Res Rev,2007,23(5):356-367.
[2] Ding F,Yu L,Wang M,et al.O-GlcNAcylation involvement in high glucose-induced cardiac hypertrophy via ERK1/2 and cyclin D2[J].Amino Acids,2013,45(2):339-349.
[3] Duan Y,Zhou B,Su H,et al.miR-150 regulates high glucose-induced cardiomyocyte hypertrophy by targeting the transcriptional co-activator p300[J].Exp Cell Res,2013,319(3):173-184.
[4] Takeda N,Manabe I,Uchino Y,et al.Cardiac fibroblasts are essential for the adaptive response of themurine heart to pressure overload[J].JClin Invest,2010,120(1):254-265.
[5] Kakkar R,Lee RT.Intramyocardial fibroblastmyocyte communication[J].Circ Res,2010,106(1):47-57.
[6] Aneja A,TangWH,Bansilal S,et al.Diabetic cardiomyopathy:insights into pathogenesis,diagnostic challenges,and therapeutic options[J].Am JMed,2008,121(9):748-757.
[7] Schultz Jel J,Witt SA,Glascock BJ,et al.TGF-β1 mediates the hypertrophic cardiomyocyte growth induced by angiotensinⅡ[J].JClin Invest,2002,109(6):787-796.
[8] Leask A.TGFβ,cardiac fibroblasts,and the fibrotic response[J].Cardiovasc Res,2007,74(2):207-212.
Effect of cardiac fibroblasts on cardiomyocyte hypertrophy induced by high glucose
ZHAO Long,LIU Ling-ling,LI Xiao-li,ZHOU Yan-fang,WANG Hao,ZHANG Ying-yu,KONG Biao,SHEN Dong-li,ZHANGGuo-hui
(Department of Cardiology,the Affiliated People′s Hospital of Jiangsu University,Zhenjiang Jiangsu 212002,China)
Objective:To investigate the effect of cardiac fibroblast on cardiomyocyte hypertrophy induced by high glucose.M ethods:Neonatal CFs and CMs isolated from 0-to 3-day-old Sprague-Dawley rats were cultured in vitro,then random ly divided into six groups:CM low glucose group(group A),CM high glucose group(group B),CM and CF co-culture high glucose group(group C),CM-CF co-culture+TGF-β1neutralizing antibody high glucose group(group D),CF low glucose group(group E),CF high glucose group(group F).After cultured different times(0,6,12,24,48,72),cellularmorphologies were observed under the inverted phase contrastmicroscope,the mRNA levels of cardiomyocyte hypertrophy markers ANP、β-MHC were determinated by RT-PCR,the expression of TGF-β1evaluated by ELISA.Results:Compared with group A,cell surface area of group B cultured for 48 h increased significantly(P<0.05),group C cultured for 24 h increased significantly(P<0.05)respectively.RT-PCR showed that compared with group A,the expression of ANP、β-MHCmRNA of group B and D cultured for 12 h increased significantly(P<0.05),cultured for 24 h increased atmost,group C cultured for 6 h increased significantly(P<0.05),cultured for 12 h increased atmost respectively.ELISA showed that compared with group A,the expression of TGF-β1of group B cultured for 12 h increased significantly(P<0.05),group C cultured for 6 h increased significantly(P<0.05)respectively;compared with group E,6 h later group F increased sig-nificantly(P<0.05)respectively.Conclusion:Cardiac fibroblastsmay via paracrine transforming growth factor-β1promote cardiomyocyte hypertrophy induced by high glucose.
high glucose;cardiac fibroblast;cardiomyocyte;transforming growth factor-β1;cardiomyocyte hypertrophy
R541.75
A
1671-7783(2014)03-0216-05
10.13312/j.issn.1671-7783.y 130274
赵龙(1985—),男,硕士研究生;张国辉(通讯作者),博士,主任医师,硕士生导师,E-mail:13338812776@189.cn
2014-03-10 [编辑] 何承志
