水稻对酸胁迫的高光谱响应研究
2014-08-03李新会张秀英江洪金佳鑫
李新会,张秀英,江洪,2,金佳鑫
(1.南京大学国际地球系统科学研究所,南京 210023;2.浙江农林大学亚热带森林培育国家重点实验室,浙江省森林生态系统碳循环与固碳减排重点实验室,杭州 311300)
1 引 言
20世纪中叶以来,酸雨已成为严重的全球性环境污染问题之一,主要是由于化石燃料燃烧所排放的SO2和 NOx等酸性气体所致[1,2]。随着中国经济的快速发展,中国的能源消耗不断增加,能源消费方式与结构也在快速发生变化,SO2排放总量在经历了90年代后期的下降之后又出现大幅反弹性增长,氮氧化物(NOx)排放量快速增长[3-4]。
当降水的酸度达到一定阈值,将破坏植物叶片的微结构,降低叶绿素含量和光合效率,叶面出现可见伤害症状,阻碍生长发育,甚至导致作物的减产等[5]。李德成等在酸雨对水稻的影响方面做了初步研究[5];成杰民等模拟了太湖地区酸雨对水稻的影响[6];彭彩霞等探索了模拟酸雨对水稻种子萌发以及幼苗生长的影响[7]。
随着高光谱遥感技术的发展,一些学者通过测定叶片的光谱反射率来反演植物在外界不同因子胁迫下的生长模型。卢霞等通过成像光谱仪测量植物的光谱曲线来反演植物在重金属胁迫下的生长模型[8];张东彦等使用成像光谱仪探索病虫害、养分对小麦生长的影响[9];程苗苗等人利用便携式光谱仪ASD研究了亚热带的典型树种幼苗对模拟酸雨的响应[10]。研究结果表明,高光谱技术可以较好地监测植被受酸胁迫的影响。然而,水稻对酸胁迫在光谱上的响应,还未见研究。
水稻是我国主要粮食作物,长江三角洲又是水稻主要产地。因此,利用高光谱技术研究酸雨对水稻的影响具有重要意义。本文通过ASD光谱仪测量水稻叶片的光谱曲线从而监测水稻在不同酸类型、不同酸浓度下的光谱响应,通过建立酸胁迫高光谱诊断模型,为大面积监测水稻酸胁迫提供技术支持。
2 实验方案
2.1 选择水稻进行受控实验
实验地点为浙江省临安市。根据降水中的平均离子组成及通常模拟酸雨实验中所惯常采用的配比,将模拟酸雨分为两组进行试验,第1组是硫酸型酸雨,第2组是硝酸型酸雨(∶=8∶1;∶=8∶1)。均用水稀释成pH值分别为2.5、4.0和5.6的3个酸雨梯度,分别代表强酸雨、较弱的酸雨、对照组。将大棚内水稻等分成与模拟酸雨梯度对应的3组,每组的占地面积约为20m2。实验工作于2010年4月下旬水稻生长稳定后展开,根据临安地区多年月均降水量,喷淋适量酸雨(与当地总的降水量基本持平),喷酸间隔为一周,期间适当补水。受试水稻为常见早稻品种杭959,于2010年3月末播种,四月初插秧,5月末进行ASD光谱测量,获得一次数据,取各受试水稻的中上部成熟功能叶进行测试,每一酸雨处理梯度下取样27片叶。
2.2 叶片反射率的测量
叶片光谱反射率的测定所用的仪器是美国ASD公司(Analytical Spectral Devices,Inc.)生产的FieldSpec FR型便携式地物光谱仪。FieldSpec FR的采样波长范围在350nm~2500nm之间,其光谱分辨率在350nm~1000nm和1000nm~2500nm间分别为3nm和10nm,其采样间隔分别为1.4nm和2nm。
光谱测试过程中,样品叶片被展平置于黑色背景的工作台上,利用FieldSpec ProFRTM的植物专用探头对准叶片,并确保样品充满仪器的视场角。用此方法,对该实验中162(27*2*3,每个梯度取27片叶子,2个酸类型、3个梯度)片叶子分别进行光谱测量,得到每片叶子的光谱曲线。为消除外界干扰以保证精度,对每个样品同时采集10条光谱曲线。每隔10分钟左右对仪器做一次优化并做参考板校正。
3 数据处理
3.1 数据预处理
在对样品叶片测量过程中有不同因素的干扰,比如噪音和随机性,可能导致一定的误差,因此首先剔除异常光谱线,然后对其他的光谱曲线取平均值,作为样品叶片的代表光谱曲线。
再把每一个梯度27个叶片的代表光谱曲线取平均值,作为一个梯度的代表光谱曲线,得到3个不同梯度的光谱曲线图。
3.2 方差分析
方差分析用于分析不同水平的控制变量是否对结果产生显著影响。其基本思想是通过分析研究中不同变量的变异对总变异的贡献大小,确定控制变量对研究结果影响力的大小[11]。
本研究分别对3个酸雨梯度处理下的样本光谱反射率差异显著性进行两两分析,以分析对酸雨处理较为敏感的波段范围及分布规律。本研究把方差分析的相伴概率在3个酸梯度中均小于显著性水平0.05的波段作为敏感波段。
3.3 主成分分析
主成分分析(PCA)是多元统计中一种重要的数据压缩处理技术[12],利用PCA变换可以在信息损失最小的前提下,用较少的分量代替原来的高维数据,从而解决高光谱波段过多、谱带重叠的分析难题[13],也可以部分排除由于数据质量等原因引起的噪声[14]。
通过利用高分辨率的光谱波段快速和大面积的实时动态无损探测植物对于外界因子胁迫的响应已越来越广泛的应用到研究中。然而,由于高光谱数据波段宽度窄、波段数量多,导致波段间相关性高、数据量大、冗余严重等缺陷,造成数据维数灾难,不利于特征波段的选取和新知识的发掘[15]。为了降低数据维数,更合理的解释3个酸雨梯度处理下的样本光谱反射率与模拟酸雨pH值之间的关系,从而更好的进行决策树分类,采用PCA变换对数据进行压缩。
3.4 决策树模型
决策树方法由于具有将不同的数据源融于一体、可以处理特征集与目标之间的非线性关系等优点,已被广泛应用于环境和遥感图像处理等领域[16-17]。基于决策树的分类方法是一种能够反映同类事物共同性质的特征知识和不同事物之间的差异型特征知识的典型分类方法[18]。C5.0算法是Quinlan在C4.5基础上发展起来的决策树生成算法[19]。C5.0采用信息增益比(率)作为分类评价函数来选择属性。本次运用C5.0算法探讨建立水稻叶片酸胁迫的高光谱诊断模型。
4 结果与分析
4.1 水稻叶片光谱曲线
酸胁迫会使得对其敏感的叶绿素含量、细胞结构和含水量等发生相应的变化,并对植物的膜透性、光合系统、呼吸作用、物质代谢、酶活性产生影响[20-21],光谱曲线可以反应叶片的生长情况,因此水稻对酸胁迫的反应可以通过光谱曲线表现出来。
由图1可以看出硝酸型酸雨对水稻的影响:在400nm~600nm的可见光波段,pH4.0的光谱曲线较其对照组更高;在750nm~1300nm的近红外波段的高反射区,不同酸胁迫程度的水稻光谱曲线差异明显,pH2.5和pH4.0的反射率均比对照组高,pH为4.0的酸浓度下水稻的反射率明显高于其他两组;1600nm~1830nm和2080nm~2350nm波段的光谱与含水量关系密切,在此波段水稻光谱也有差异,较其对照组pH5.6,pH4.0的反射率更高,而pH2.5的反射率更低。这可能是由于在酸胁迫的初级阶段,溶液里的N元素对水稻产生了施肥作用,使水稻叶片内叶绿素增加[22-23],在一定程度上促进了水稻的生长,使其反射率高于对照组;随着对水稻的酸胁迫加重,水稻的生长受到抑制:近红外波段pH2.5的光谱曲线低于pH4.0的光谱曲线,酸胁迫引起的细胞破坏导致了水稻内水分的变化,引起pH2.5的光谱曲线在1600nm~1830nm和2080nm~2350nm波段降低。
对原始光谱进行差异性分析,硝酸型酸雨差异性明显的波段主要集中在1000nm~1074nm,表明硝酸型酸雨对水稻的原始光谱影响主要在近红外区。同时,在400nm~700nm的可见光部分、680nm~1000nm的近红外波段和1600nm~1800nm波段,pH4.0和pH2.5、pH5.6的光谱差异性都小于0.05,存在明显差异,而pH2.5和pH5.6的光谱无显著性差异;在2010nm~2166nm波段,pH2.5 与 pH4.0、pH5.6 的光谱差异性均小于0.05,而pH4.0和pH5.6的光谱差异性不明显。这进一步验证了上述对光谱曲线的分析。
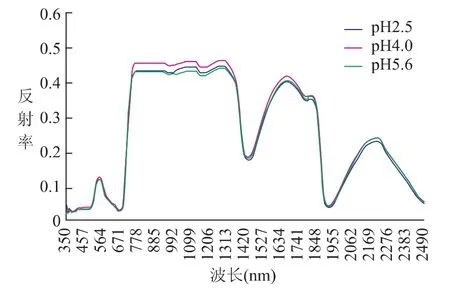
图1 水稻在硝酸型酸雨中的光谱反射率
由图2可以看出硫酸型酸雨对水稻的影响:在400nm~600nm的可见光波段,pH4.0的光谱曲线较其对照组略有降低,而pH2.5的光谱曲线与对照组持平且略有上升;在750nm~1300nm的近红外波段的高反射率区,pH4.0的反射率较其他两组,明显更低,而pH2.5的反射率与对照组持平中略有上升;1600nm~1830nm和2080nm~2350nm波段与植物的含水量有密切关系,这一波段不同酸雨梯度下的光谱也有差异,与对照组相比,pH4.0的光谱更高,而pH2.5的反射率更低。一般植物在遭受胁迫的情况下,叶绿素会呈现降低的趋势[24]。严重玲等对农作物绿豆和玉米的叶片研究也表明:在硫酸型模拟酸雨胁迫下,植物叶片活性降低,叶绿素含量减少[25];本实验中,由于水稻对硫酸型酸雨敏感,酸雨降低了水稻叶片的活性,在pH4.0时就表现为抑制作用,而随着酸胁迫加重,水稻对其有一定的适应性,反射率反而上升了。

图2 水稻在硫酸型酸雨中的光谱反射率
对原始光谱进行差异性分析,硫酸型酸雨两两之间均存在显著性差异的波段很少,没有规律;但在487nm~666nm的可见光部分、720nm~928nm的近红外部分和1386nm~1800nm波段,pH4.0和pH2.5、pH5.6的差异性都小于0.05,存在明显差异,而pH2.5和pH5.6无显著性差异。
4.2 主成分分析
通过以上分析,硝酸型酸雨的差异性主要集中在400nm~1074nm波段和1600nm~1800nm波段;硫酸型酸雨主要集中在480nm~930nm和1386nm~1800nm波段。由于酸胁迫引起的植物光谱的改变主要集中在可见光[26-27],再结合本次差异性分析的结果,本研究选取了几个具有物理意义的光谱区域内的光谱反射率进行主成分分析:蓝区(BR:350nm~400nm)、蓝边(BE:490nm~530nm)、绿区(GR:510nm~560nm)、黄边(YE:550nm~582nm)、红光吸收谷(RW:640nm~680nm)、红边(RE:670nm~737nm)、近红外区(NIR:700nm~900nm)。其中蓝区和蓝边是叶绿素的强吸收区;绿区是叶绿素的高反射区;黄边是黄光在550nm~582nm之间反射率一阶导数最大值的位置,反映植被的生长状况;红光和红光吸收谷是叶绿素的强吸收区,而红边与叶子内部的物理状态密切相关,指示植物内的叶绿素,全氮含量等;近红外波段则可以预测植物的细胞结构、水分、蛋白质等[28]。
经过对选取波段的主成分变换,硝酸型酸雨的光谱主成分因子及其累计贡献率如表1所示,数据降维效果显著,除蓝区主成分因子累计贡献率在83.7%以外,其余都达到了98%以上,原光谱区域敏感波段信息得到有效保留。

表1 硝酸酸雨光谱主成分因子及累计贡献率
硫酸型酸雨的光谱主成分因子及其累计贡献率如表2所示,除蓝区主成分因子累计贡献率在88.0%以外,其余都达到了98%以上。对于蓝区光谱而言,主成分因子数目较多,数据压缩率和累计贡献率相对较低,表明该变量内所含信息较为丰富且各信息项之间相关性较弱,利于有效分类。
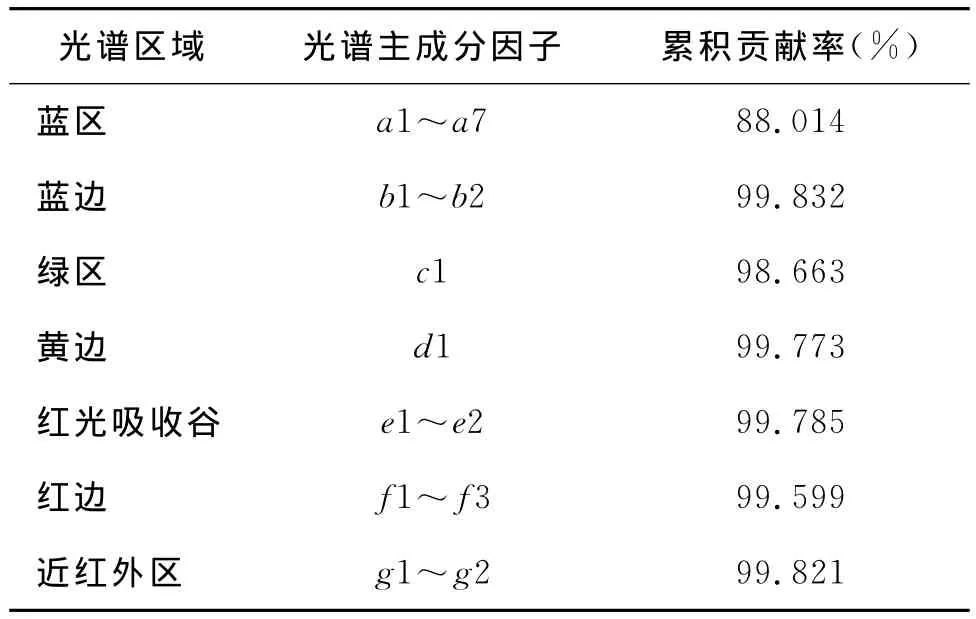
表2 硫酸酸雨光谱主成分因子及累计贡献率
4.3 基于决策树水稻叶片酸胁迫高光谱诊断模型
将硝酸型酸雨下得到的19个光谱反射率主成分因子作为决策树自变量,将酸雨处理梯度等级作为因变量,对81个(27*3,3个梯度)样本通过分类规则进行分析并分类。
分类结果如图3所示,利用光谱主成分因子对81个样本分类,准确率为96.3%,其根节点为a1(蓝区),表明蓝区对酸胁迫的响应最明显。参与分类的变量共有5个(分别为a1、a5、a6、a7、b),其主要表征波段为350nm~400nm(蓝区)和490nm~530nm(蓝边)。
将硫酸型酸雨下得到的18个光谱反射率主成分因子都作为决策树自变量,将酸雨处理梯度等级作为因变量,对81个样本通过分类规则进行分析并分类。
分类结果如图4所示,利用光谱主成分因子对81个(27*3,3个梯度)样本分类,准确率为98%,分类精度较高,其根节点为a6(蓝区),参与分类的变量共有5个(分别为a2、a3、a6、a7、b2),其主要表征波段也为350nm~400nm(蓝区)和490nm~530nm(蓝边)。
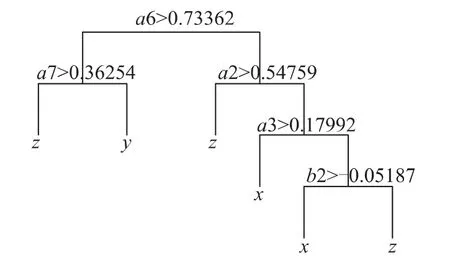
图4 硫酸型酸雨主成分因子对样本的分类图
酸胁迫导致叶绿素的变化,从而引起植物叶片对蓝紫光和红光反射率变化,引起光谱曲线的变化。研究表明,叶绿素a、叶绿素b的吸收主要在红区(670nm左右)和蓝区(450nm左右),在酸胁迫中,这些波段也明显影响决策树的分类精度[29-31]。蓝区和红区对植物所受的酸胁迫有较好的光学响应[32]。而在本次基于决策树的分类中,蓝紫光是主要表征波段,从而证明酸胁迫对水稻产生了影响,使水稻的光谱曲线发生了变化。
5 结束语
本研究以水稻作为研究对象,进行大棚酸雨受控实验,通过数据预处理、方差分析、主成分分析和决策树系统的技术手段,对比分析水稻对于不同酸成分、酸强度处理的高光谱反射率响应,得到如下结论:
(1)硝酸型酸雨和硫酸型酸雨都对水稻生长有一定程度的抑制作用,但是由于硝酸型酸雨含有水稻生长所必需的氮元素,使水稻在酸浓度较低的情况下,表现为促进其生长,但是随着酸浓度的增加,则表现为抑制,促进和抑制的酸浓度临界点,还需要进一步实验才能得到;而硫酸型酸雨在低浓度下就明显表现为抑制水稻生长,但是随着浓度的增高,抑制作用反而减弱,逐渐与对照组持平,这可能是水稻适应了硫酸型酸雨的结果。
(2)经过主成分变换,除蓝区光谱外,其他各光谱区域光谱主成分均具有较高的数据压缩率和累计贡献率;对于蓝区光谱而言,主成分因子数目较多,表明该变量内所含信息较为丰富且各信息项之间相关性较弱,利于有效分类。
(3)经过C5.0算法进行分类,以光谱主成分因子为自变量,对硝酸型酸雨和硫酸型酸雨处理梯度等级分类的准确率分别为96.3%和98%,分类精度很高。蓝区对分类结果影响最为显著,其次是蓝边,其他光谱区域对分类结果影响较小,表明蓝区内的光谱导数能较明显反映出水稻受到酸雨的影响。
[1]MENZ F C,SEIP H M.Acid rain in Europe and the United States:An update[J].Environmental Science and Policy,2004,7(4):253-265.
[2]宋晓东,江洪,余树全,等.模拟酸雨胁迫与植物叶片光谱反射率特征间的关系[J].光谱学与光谱分析,2010,30(1):165-169.
[3]汤洁,徐晓斌,巴金,等.1992-2006年中国降水酸度的变化趋势[J].科学通报,2010,55(8):705-712.
[4]ZHANG X Y,JIANG H.Analysis of acid rain patterns in northeastern China using a decision tree method[J].Atmospheric Environment,2012(46):590-596.
[5]李德成,徐彬彬,石晓日,等.模拟酸雨对水稻叶片反射光谱特性影响的初步研究[J].环境遥感,1996,11(4):241-247.
[6]成杰民,潘根兴,仓龙,等.模拟酸雨对太湖地区主要水稻土土壤pH及植物生长的影响[J].南京农业大学学报,2000,23(2):116-118.
[7]彭彩霞,彭长连,林桂珠,等.模拟酸雨对农作物种子萌发和幼苗生长的影响[J].热带亚热带植物学报,2003,11(4):400-404.
[8]卢霞,刘少峰,郑礼全.矿区植被重金属胁迫高光谱分辨率数据分析[J].测绘科学,2007,32(2):111-113.
[9]张东彦,张竞成,朱大洲,等.小麦叶片胁迫状态下的高光谱图像特征分析研究[J].光谱学与光谱分析,2011,31(4):1101-1105.
[10]程苗苗,江洪,陈健,等.不同演替阶段典型树种幼苗对酸胁迫响应的高光谱监测[J].生态学报,2009,29(11):5953-5962.
[11]余建英,何旭红.数据统计分析与SPSS应用[M].北京:人民邮电出版社,2003:141.
[12]李俊祥,达良俊,王玉洁,等.基于NOAA-AVHRR数据的中国东部地区植被遥感分类研究[J].植物生态学报,2005,29(3):436-443.
[13]何勇,李晓丽,邵咏妮.基于主成分分析和神经网络的近红外光谱苹果品种鉴别方法研究[J].光谱学与光谱分析,2006,26(5):850-853.
[14]TOWNSHEND J R G,JUSTICE C O,KALB V.Characterization and classification of South-American land cover types using satellite data[J].International Journal of Remote Sensing,1987(8):1189-1207.
[15]张秀英,冯学智,江洪.面向对象分类的特征空间优化[J].遥感学报,2009,13(4):664-669.
[16]ZHANG X Y,FENG X Z,JIANG H.Object-oriented method for urban vegetation mapping using IKONOS imagery[J].International Journal of Remote Sensing,2010,31(1):177-196.
[17]ZHANG X Y,LIN F F,JIANG Y G,et al.Assessing soil Cu content and anthropogenic influences using decision tree analysis[J].Environmental Pollution,2008(156):1260-1267.
[18]祁治.基于模糊集理论的关联规则研究[D].武汉:武汉科技大学,2005.
[19]张青.决策树分类算法的研究与改进[D].郑州:郑州大学,2002.
[20]高吉喜,曹洪法,舒俭民.酸雨对植物新陈代谢的影响[J].环境科学研究,1996,9(4):41-45.
[21]单运峰,冯宗炜.模拟酸雨对马尾松和杉木幼树的影响[J].环境科学学报,1988,8(3):307-315.
[22]刘菊秀.酸沉降对森林生态系统影响的研究现状及展望[J].生态学杂志,2003,22(5):113-117.
[23]谢晓赞,江洪,宋晓东,等.模拟酸雨不同水平下杜英和山核桃的高光谱特点[J].遥感信息,2010(1):32-38.
[24]RICHARDSON A D,DUIGAN S P,BERLYN G P.An evaluation of noninvasive methods to estimate foliar chlorophyll content[J].New Phytologist,2002(153):185-194.
[25]严重玲,钟章成,李睿智.酸雨对农作物叶片活力、叶绿素及叶汁pH 的影响[J].环保科技,1995,17(2):27-30.
[26]CARTER G A,KNAPP A K.Leaf optical properties in higher plant s:Linking spectral characteristics to stress and chlorophyll concentration[J].American Journal of Botany,2001,88(4):677-684.
[27]CARTER G A.Responses of leaf spectral reflectance to plant stress[J].American Journal of Botany,1993,80(3):239-243.
[28]浦瑞良,宫鹏.高光谱遥感及其应用[M].北京:高等教育出版社,2004:81.
[29]JIN J X,JIANG H,ZHANG X Y,et al.Using multivariate analysis to detect the hyperspectral response of Chinese fir to acid stress[J].International Journal of Remote Sensing,2013,34(11):3775-3786.
[30]BLACKBURN G A.Wavelet Decomposition of Hyper spectral Data:A Novel Approach to Quantifying Pigment Concentrations in Vegetation[J].International Journal of Remote Sensing,28(12):2831-2855.
[31]TILLING A K,O’LEARY G J,FERWERDA J G,et al.Remote sensing of nitrogen and water stress in wheat[J].Field Crops Research,2007(104):77-85.
[32]MUTANGA O,SKIDMORE A K.Red edge shift and biochemical content in grass canopies[J].ISPRS Journal of Photogrammetry and Remote Sensing,2007(62):34-42.
