血液制品用切向流超滤系统清洗消毒方法的有效性研究
2014-08-01冯仁平
张 良,王 炳,冯仁平,李 剑
(1.四川大学生物治疗国家重点实验室,四川成都 610041;2.成都蓉生药业有限责任公司,四川 成都 610041)
0 引 言
切向流(tangential flow filtration,TFF)超滤被广泛应用于血液制品生产过程中,洗脱乙醇,纯化蛋白和浓缩配制产品,是目前血液制品生产常用的一种分离提纯方法.超滤系统的超滤膜在处理蛋白料液后,由于分离物质及其他杂质会在膜表面或膜孔中逐渐积聚,不但会造成膜的污染和堵塞,也可能会滋生微生物,而污染后的膜通量会下降,清洗难度大,膜使用寿命缩短,严重影响超滤系统的工作效率[1].超滤系统的有效清洗不仅能有效控制微生物的污染,而且能延长超滤膜的使用寿命,保证产品质量.目前,血液制品生产使用的TFF 超滤系统中的超滤膜使用最多的是聚醚砜材质膜堆,而氢氧化钠(NaOH)与氯化钠(NaOH)是用于此类材质膜堆的常用清洗剂之一,同时,由于它们还能灭活大多数的病毒、细菌、酵母及真菌,也常被作为消毒剂使用[2].
通常,影响超滤系统清洗效果的主要因素有:清洗剂的浓度、清洗时间和清洗剂温度.超滤系统的清洗过程主要包括冲洗、清洗、除热原、消毒等.实际生产中的清洗方法主要分为使用前清洗流程和使用后清洗流程.使用前清洗流程主要是去除超滤系统内贮存的贮存液,保证清洗后的系统能投入生产使用;使用后清洗流程主要是去除超滤系统中的污染物,这些污染物包括超滤的料液的主要成分,人血白蛋白与其他杂蛋白,以及可能存在的微生物.使用前清洗及使用后清洗流程如图1 所示.本研究主要讨论常用清洗剂对超滤系统清洗的有效性.
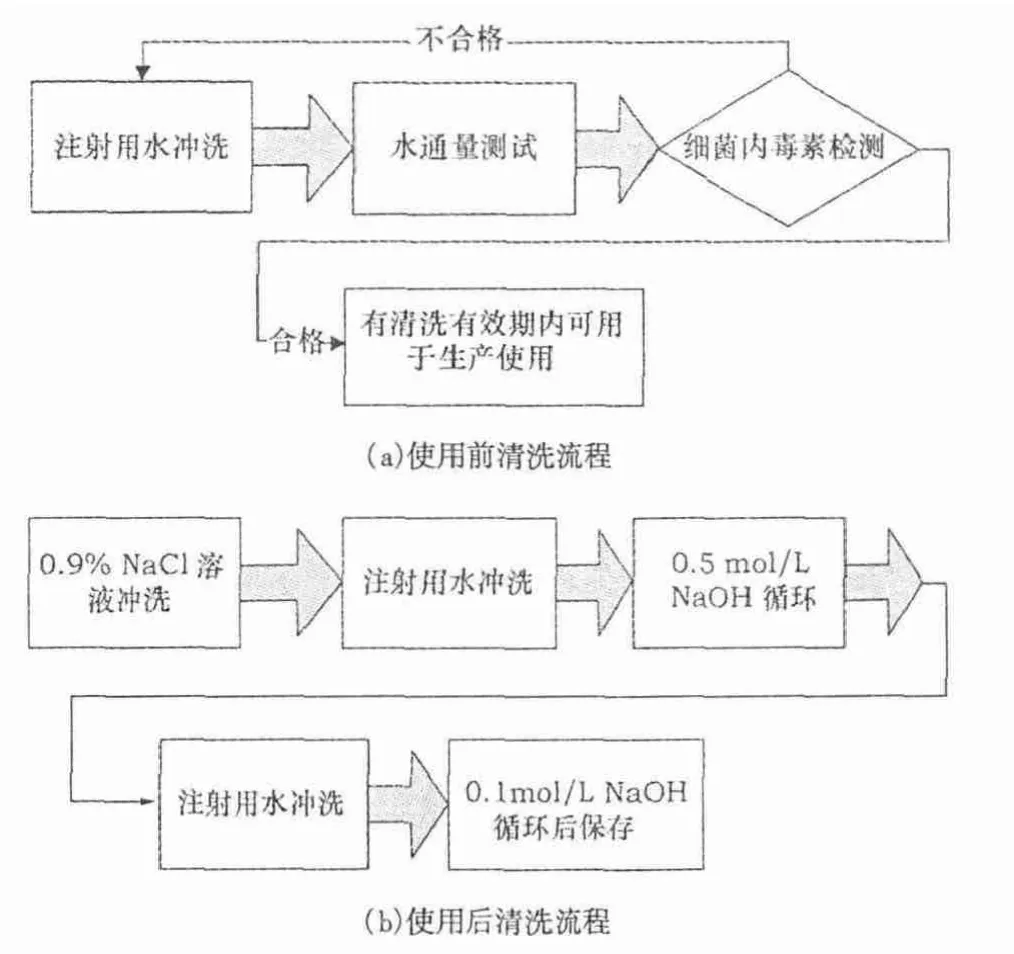
图1 超滤系统清洗流程示意图
1 材料与仪器
1.1 材 料
实验所用的材料包括:NaOH(分析纯),由湖南尔康制药股份有限公司生产;NaCl(分析纯),由成都市科龙化工试剂厂生产.
1.2 仪 器
实验所用的仪器包括:超滤器,美国密理博(MILLIPORE)公司,PBGC/P28010A25 材质,截留分子量10 KD,膜有效面积5 m2,进液压力≤0.4 MPa,出液压力≤0.2 MPa,滤过端压力为0 MPa,透膜压力(TMP)0.1 ~0.3 MPa,初始水通量(NWP)9.79 L/min·5 m2;Sievers 900 总有机碳分析仪,通用电气分析仪器公司;METTLER TOLEDO PH 仪、METTLER TOLEDO 电导仪,梅特勒—托利多国际股份有限公司;Millipore Integritest 4 自动完整性测试仪、MILLIPORE Microfil 微生物限度检查仪,美国密理博(MILLIPORE)公司.
2 检测与标准
2.1 检测项目
2.1.1 无菌检测.
用无菌取样瓶取样200 mL,按照《药典》中微生物限度检查法[3]中的薄膜过滤法检测微生物限度.
2.1.2 内毒素检测.
采用干烤膜制瓶取样10 mL,用鲎试剂法检测细菌内毒素.
2.1.3 总有机碳(Total organic carbon,TOC)检测.
用TOC 专用取样瓶取样20 mL,进行TOC 检测.
2.1.4 检测电导率.
使用理化取样瓶取样检测电导率.检测结果=送样检测值-背景值,新鲜注射用水的TOC 和电导率作为背景值.
2.1.5 系统水通量及膜包完整性测试.
取样完成后进行超滤系统水通量测试,超滤系统初始水通量(NWP)为9.79 L/min·5 m2,当膜堆使用了一次之后,所测出的水通量不应低于最初标准的60% ~80%,即使用后水通量测试最低应不低于5.87 L/min·5 m2.水通量测试完成后进行超滤系统超滤膜包的完整性测试.
2.2 检测标准
超滤系统清洗后,其细菌内毒素和微生物限度符合《药典》中注射用水标准[3].具体而言:细菌、霉菌和酵母菌总数应不高于10 CFU/100 mL;细菌内毒素检测应<0.25 EU/mL;根据《PIC/S-GMP 指南》第二部分(原料药基本要求)和PAD 第29 号技术报告《清洁验证草案》规定:计算得出的TOC 残留可接受标准<969 ppb;电导率≤1.3 μS/cm(25℃);水通量不低于初始水通量的60%.
3 方法与内容
实验中,模拟实际生产中超滤系统超滤人血白蛋白料液的过程.使用前与使用后清洗过程中超滤膜堆进/回/出压力控制为0.2 ±0.01/0.08 ±0.01/0 MPa.采用与实际生产相同的使用后清洗流程清洗,调整清洗参数,优化使用后清洗流程效果.使用后清洗流程完成后,存放168 h.采用与实际生产相同的使用前清洗流程,调整清洗液体积观察清洗效果.清洗流程完成后,使用注射用水循环超滤系统,循环5 min 后,在系统回流端取样检测微生物限度、细菌内毒素、TOC 和电导率,并检测超滤系统水通量和系统完整性.实验重复3 次,其中微生物限度、TOC 和水通量,均为3 次统计结果的平均值[4-5].
3.1 比较0.9% NaCl溶液和注射用水的清洗效果
1)超滤系统模拟实际生产超滤过程后,使用单位膜量60 L/m2(总量300 L,膜总面积5 m2,单位膜量60 L/m2),温度为20 ±2 ℃的0.9% NaCl 清洗超滤系统.在清洗液使用量分别为10、20、30、40、50 L/m2时取样,检测微生物限度、细菌内毒素、TOC 值和水通量.
2)超滤系统模拟实际生产超滤过程后,使用单位膜量60 L/m2,温度为20 ±2 ℃的注射用水清洗超滤器.在清洗液使用量分别为10、20、30、40、50 L/m2时取样,检测微生物限度、细菌内毒素、TOC 值和水通量.
3.2 比较不同体积的0.5 mol/L NaOH清洗消毒效果
继“3.1”项清洗后,先使用20 L/m2注射用水清洗,然后使用0.5 mol/L NaOH 溶液进行循环.温度为22±2 ℃,使用不同的循环体积,5、10、15、20、25 L,并在不同的循环时间点,15、30、45、60 min 时,取样,检测微生物限度、细菌内毒素、TOC 值和水通量.
3.3 0.1mol/L NaOH进行循环贮存及注射用水进行前清洗效果
使用10 L,温度为20±2 ℃的0.1 mol/L NaOH 溶液循环5 min,关闭系统阀门贮存168 h 后,按前清洗流程对超滤系统进行清洗.注射用水的清洗体积分布为100、125、150、175、200 L.清洗完成后取样,检测微生物限度,细菌内毒素、TOC 及电导率,并进行水通量测试和系统完整性测试.
4 结果与讨论
4.1 0.9% NaCl 溶液和注射用水清洗的有效性
按“3.1”项内容进行0.9% NaCl 溶液和注射用水的清洗效果的比较实验,其对TOC、水通量和微生物限度的影响如图2 ~7 所示.
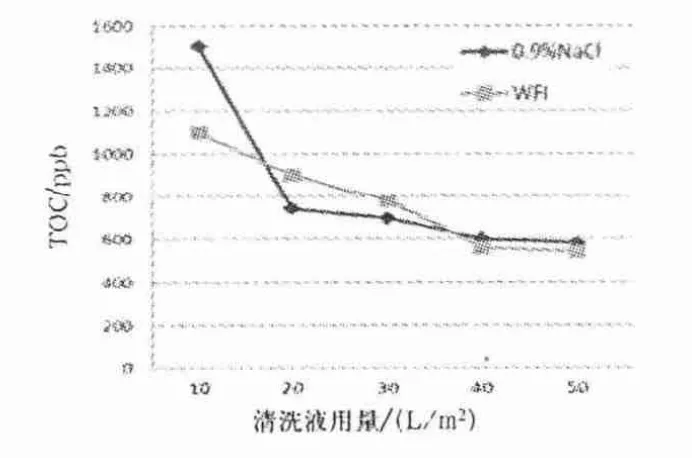
图2 0.9% NaCl 溶液和注射用水清洗后TOC 检测结果
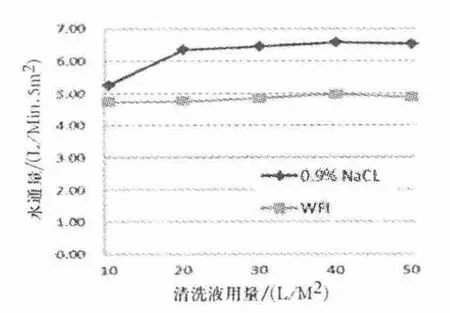
图3 0.9% NaCl 溶液和注射用水清洗后水通量检测结果
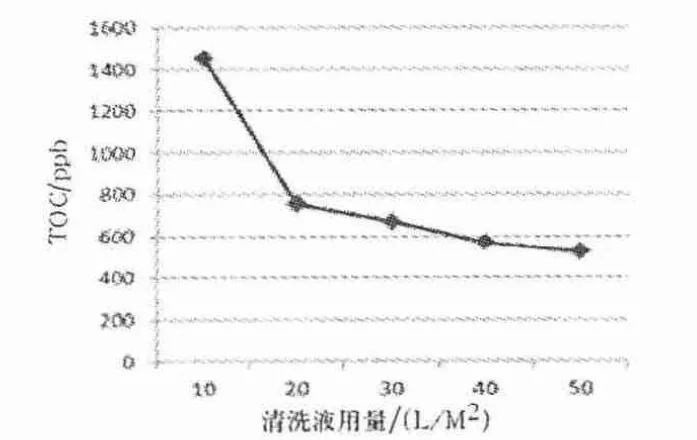
图4 0.9% NaCl 溶液加注射用水清洗后的TOC 检测结果
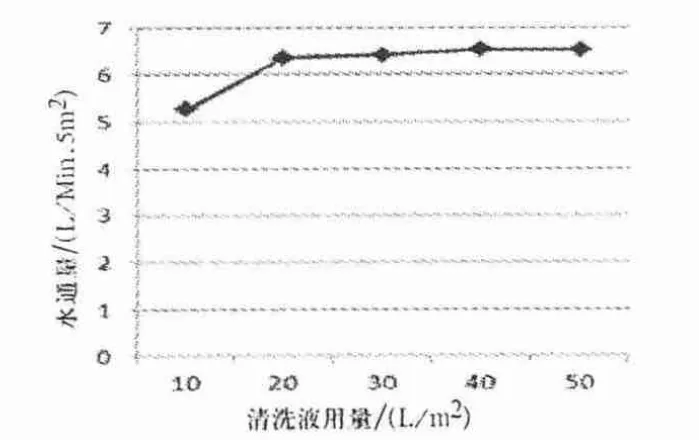
图5 0.9% NaCl 溶液加注射用水清洗后水通量检测结果
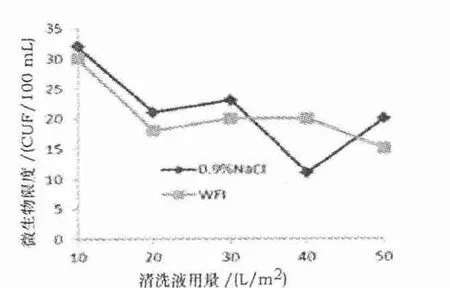
图6 0.9% NaCl 溶液和注射用水清洗后微生物限度检测结果

图7 0.9% NaCl 溶液加注射用水清洗后微生物限度检测结果
由图2、3 可知,0.9% NaCl 溶液清洗量到达20 L/m2时,TOC 值由10 L/m2时的1 500 ppb 降到741 ppb,TOC 变化最快,清洗量为40 L/m2时,TOC 值下降至560 ppb,达到了TOC 残留可接受标准,并与相同量注射用水清洗的TOC 重合,清洗量在40 L/m2以后趋于平稳.0.9% NaCl 溶液清洗量达到20 L/m2后,水通量恢复比较平稳,达到6.56 L/min·5 m2,恢复率为67.0%,注射用水溶液清洗量达到20 L/m2后,水通量恢复值为4.97 L/min·5 m2,恢复率为50.8%.0.9% NaCl 溶液清洗后水通量恢复好于相同量注射用水清洗后的水通量,采用0.9%NaCl 清洗较直接用注射用水清洗能更有效地改善水通量.0.9% NaCl 溶液和注射用水清洗使用量达到20 L/m2时TOC 和水通量改善最为明显,在总量达到40 L/m2时趋于平稳,从操作和使用成本考虑,采用先用20 L/m20.9% NaCl 溶液清洗后,再用20 L/m2以上注射用水清洗效果较好.
由图4、5 可知,0.9% NaCl 溶液结合注射用水清洗清洗量为40 L/m2时,TOC 为657 ppb,0.9%NaCl 溶液结合注射用水清洗后水通量与图2 的趋势相似,能有效地恢复超滤系统的水通量,达到6.52 L/min·5 m2,恢复率为66.4%.另外,实验取样检测的细菌内毒素(鲎试剂法检测均为阴性)检查均符合《药典》对注射用水细菌内毒素检测要求.
由图6、7 可知,超滤系统采用0.9% NaCl 溶液结合注射用水清洗后的微生物限度检测结果与单独采用0.9% NaCl 溶液或注射用水清洗后的微生物限度检测结果无明显变化.
4.2 不同体积的0.5 mol/L NaOH 清洗消毒的有效性
按“3.2”项内容进行不同体积的0.5 mol/L NaOH 清洗效果实验,其对TOC、微生物限度和水通量的影响如图8 ~10 所示.
由图8 可知,0.5 mol/L NaOH 溶液用量分别为10、15、20、25 L,循环清洗30 min 时,超滤系统的TOC分别为291、255、240、229 ppb.可见,改变清洗液的体积对超滤系统的TOC 影响不明显.循环60 ~90 min 时,TOC 值在230 ~250 ppb 之间,趋于平稳,均能够较好地控制在系统被允许的制品残留限度范围.
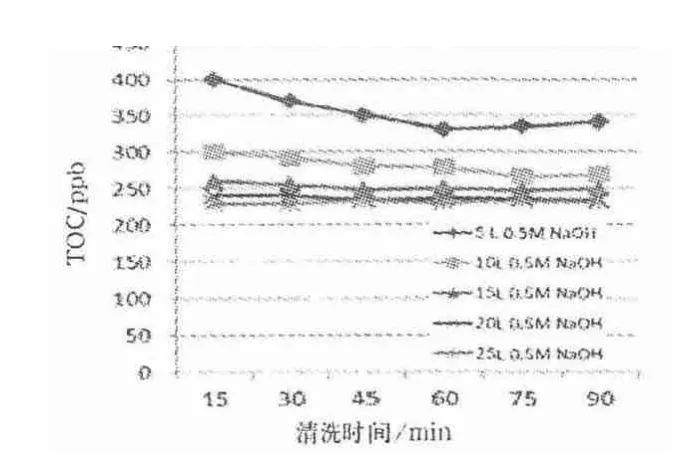
图8 0.5 mol/L NaOH 溶液和注射用水清洗后TOC 检测结果
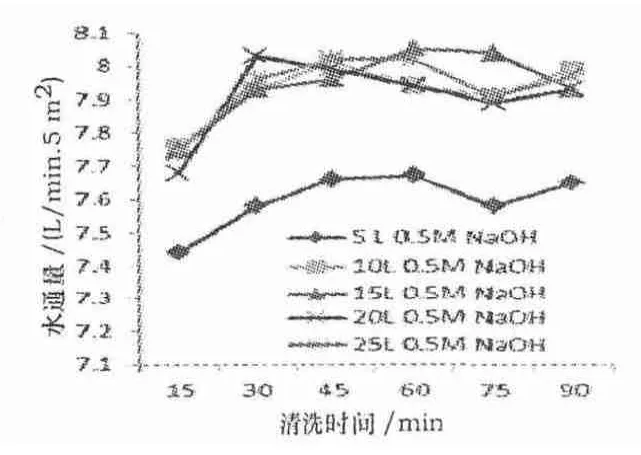
图9 0.5 mol/L NaOH 溶液和注射用水清洗后水通量检测结果
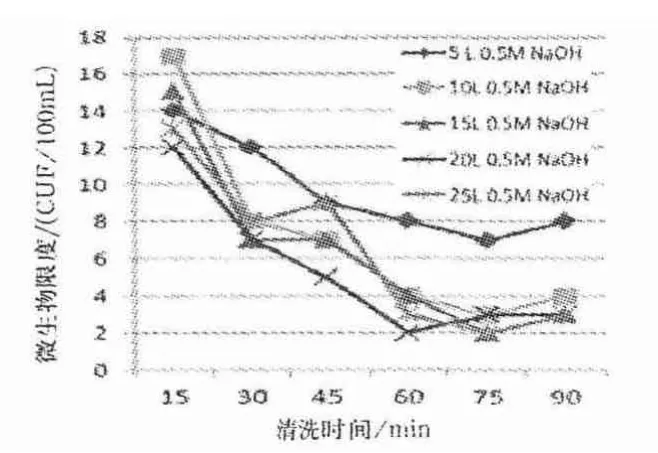
图10 0.5 mol/L NaOH 溶液和注射用水清洗后微生物限度检测结果
从图9 可知,0.5mol/L NaOH 溶液体积为5 L对超滤系统的水通量恢复率是最低的,其体积≥10 L 时,改变体积对超滤系统的水通量影响不明显,恢复率较为稳定.0.5 mol/L NaOH 溶液体积≥10 L 循环清洗15 min 以上时,水通量恢复率均能大于80%,符合超滤膜堆使用了一次之后,所测出的水通量不应低于最初标准60%的标准.综合上述实验结果,考虑使用10 L 以上(折合单位面积换算2 L/m2以上)的0.5 mol/L NaOH 溶液循环60 min 就能有效去除蛋白残留,并恢复超滤系统水通量的80%,同时也能有效降低超滤系统中微生物负荷,起到有效消毒的作用.同时,超滤系统超滤膜堆完整性测试均合格.此表明,聚醚砜材质对0.5 mol/L NaOH 溶液有很好的耐受性,可以使用0.5 mol/L NaOH 溶液对聚醚砜材质膜进行清洗.
从图10 可知,0.5mol/L NaOH 溶液清洗循环到30min 时,超滤系统的微生物限度下降的趋势较为明显,其5、10、15、20、25 L 的微生物限度检测结果分别为12、8、7、7、8 CUF/100 mL,除5 L 外其他体积的0.5 mol/L NaOH 溶液清洗能达到《药典》注射用水微生物限度的检测标准:不高于10 CFU/100 mL.当循环60 min 时,系统微生物限度趋于平稳,5 L 的检测结果为8 CUF/100 mL,而10、15、20、25 L的检测结果为2 ~4 CUF/100 mL.
4.3 0.1mol/L NaOH 进行循环贮存及注射用水清洗的有效性
按“3.3”项内容进行0.1 mol/L NaOH 循环贮存及注射用水前清洗实验,其对TOC、水通量和微生物限度的影响见图11 ~13 所示.
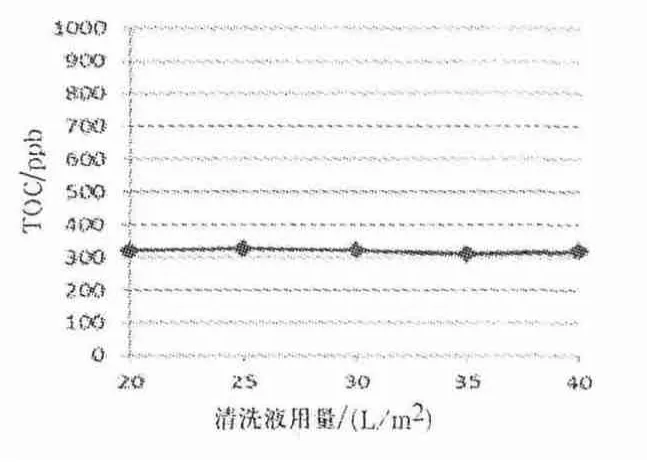
图11 0.1 mol/L NaOH 进行循环贮存后注射用水前清洗后TOC 检测结果
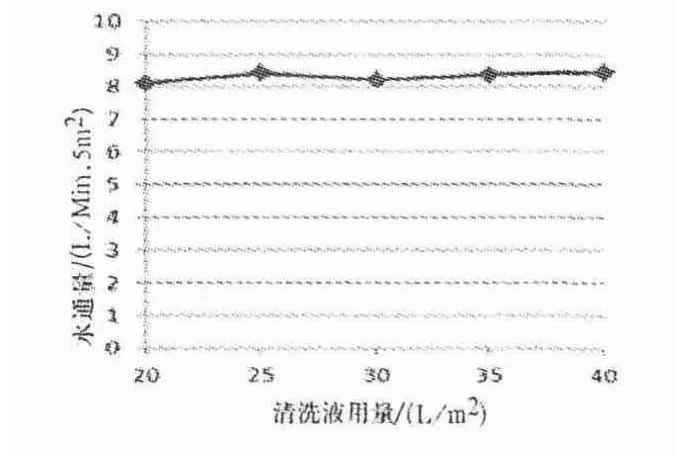
图12 0.1 mol/L NaOH 进行循环贮存后注射用水前清洗后水通量检测结果
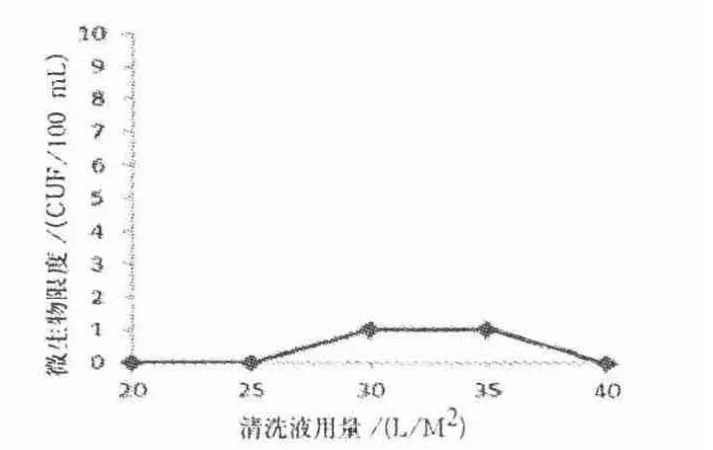
图13 0.1mol/L NaOH 进行循环贮存后注射用水前清洗后微生物限度检测结果
由图11、12 可知,0.1 mol/L NaOH 进行循环贮存后使用注射用水清洗体积达到20、25、30、40 L/m2时,超滤系统的TOC 检测结果分别为,320、326、321、310、318 ppb,TOC 趋于平稳,且均小于蛋白残留允许最大限度969 ppb 的标准.同时,超滤系统的水通量平均值为8.30 L/min·5 m2,恢复率在80%以上,趋于恒定.
由图13 可知,超滤系统的微生物限度检测结果均未出现大于1 CUF/100 mL 的微生物.此外,超滤系统的电导率检测值为0.5 ~0.8 μs/cm(25 ℃),符合《药典》对注射用水≤1.3 μs/cm(25 ℃)的要求.
5 结 论
实验结果表明:使用0.9% NaCl 溶液,结合0.5 mol/L 和0.1 mol/L NaOH 溶液对超滤系统进行清洗能有效控制超滤系统的微生物量,去除蛋白残留,并使系统的水通量恢复到初始水通量的80%;先用20 L/m20.9% NaCl 清洗,再用20 L/m2以上的注射用水清洗后,用2 L/m2量的0.5 mol/L NaOH 循环60 min 消毒,然后用注射用水冲洗,最后用0.1 mol/L NaOH 溶液对超滤系统进行贮存的清洗流程对聚醚砜材质的超滤膜的性能无影响,操作简单,经济有效,能长期用于聚醚砜材质的超滤膜的清洗.
[1]赵达玉,左勇.超滤膜的污染与清洗保养[J].四川省食品与发酵,2001,29(2):11-13.
[2]黎阳.浅谈药品生产设备清洁验证[J].中国药事,2008,22(8):654-656.
[3]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010.
[4]殷永红.注射用重组人Ⅱ型肿瘤坏死因子受体—抗体融合蛋白和注射用重组人白细胞介素——11 制剂生产设备清洁验证[D].上海:华东理工大学,2011.
[5]Millipore Corporation.Techniques for demonstrating cleaning effectiveness of ultrafiltration membranes[EB/OL].http://www.merckmillipore.com/INTL/en.[2013-01-01].
