水温和磷浓度对满江红氮磷吸收的影响
2014-07-19易厚燕吴爱平庞燕储昭升
易厚燕,吴爱平,庞燕,储昭升*
1.中国环境科学研究院湖泊生态环境创新基地,北京 100012
2.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 100012
3.湖南农业大学生物科学技术学院生态研究所,湖南 长沙 410128
富营养化是由于水体中氮磷营养物的富集,引起藻类及其他浮游生物异常增多,水体溶解氧浓度和透明度下降,鱼类及其他生物大量死亡,水质恶化的现象[1]。湖泊富营养化问题一直备受关注[2],我国湖泊水体富营养化日趋严重,已影响到湖泊水环境质量和功能,造成湖泊生态失衡,加速湖泊老化和消亡,由此带来严重的经济损失,影响当地社会经济的可持续发展。
水生植物可对受污染水体起到一定的净化作用[3-7]。近年来,利用水生植物对湖泊过剩营养物(主要是N 和P)进行吸收、富集、净化以改善湖泊水质已经成为研究热点之一,植物组织的氮磷浓度是评价植物获取营养能力的指数[8]。水生植物能极大地从水体环境中吸收氮磷和改变营养物的循环。研究人员在世界各地的各种生境对淡水水生植物的生物种类[9-10]、分布[11-12]以及营养含量[8,13]都进行了研究,主要包括水生植物生物量,营养物含量与水柱,沉积物中化学、物理指标的相关研究[14-16]。满江红(Azolla imbricata)是我国南方富营养化湖泊水体中常见的漂浮植物,它的应用很广泛,可以作为生物肥、动物饲料、生物过滤器、生物除草剂以及对洪水中重金属进行植物修复[17-18],可以去除造成水体富营养化的氮磷元素,还可以去除磺胺类化合物[19]。满江红是一种固氮植物,已被广泛用作亚洲各国稻谷作物的氮肥和绿肥[20]。满江红通常呈绿色,在低温、缺磷等胁迫下,由于花青素含量的增加而呈红色[17]。不论按照植物组织水平还是分子水平的敏感度,满江红都可确定为耐污种类,其生态敏感水平高于挺水植物,低于沉水植物[21]。国内外对满江红的研究主要集中于对污水中的重金属去除[18,22-23]。满江红对Cr、Cd、Cu、Mn、Zn 等重金属离子有强烈的吸附作用[24-25],对Se 元素有还原挥发作用[26],而用于去除水中氮磷的研究报道很少[27],对富营养化湖泊水中氮磷去除的研究更是鲜有报道。
云南洱海是我国重要的高原湖泊之一,目前处于富营养化初期,其湖滨区总磷浓度为0.030 ~0.039 mg/L[28]。满江红是洱海常见的漂浮植物,常年可见,一般都伴随在菰或菱等植物周围生长。观察发现,洱海满江红从3月温度回升后开始增多,7—8月开始下降,9月又开始增多,11月底达到最高峰,9月下旬—11月是其生长的高峰期。笔者通过研究满江红在不同水温和不同磷浓度条件下的生长状况,分析其在9月下旬—11月疯长的原因,评估满江红生长对氮磷的吸收效果,找出其对水体中氮磷去除的最佳条件,以期为湖滨区满江红的打捞管理提供基础。
1 材料与方法
试验前,沿洱海湖滨带随意选定3 个典型相似生境(湖汊、湖湾或废弃池塘)的满江红群落样点,于满江红群落的中心以及距满江红群落边缘200 m外无满江红生存的2 种生境下分别取水样测定各生境下的总磷浓度,评估洱海适合满江红生长的总磷浓度,同时比较2 种生境间总磷浓度的差异。
1.1 试验材料和设计
洱海属亚热带高原气候,年平均气温为16.2℃,全年日照时间为2 250 ~2 480 h,多年平均降水量为1 000 ~1 100 mm,太阳总辐射量583.64 ~625.97 kJ/cm2[29]。没有明显的严冬酷热,四季如春。试验时间为2011年11月中旬—12月初,日均温度为17.5 ℃,地点在大理市才村码头中国环境科学研究院科研基地。
在大理市才村码头附近洱海湖滨带水域,选取绿色满江红植株为试验材料。将打捞的植物材料先用自来水冲洗数次,再用蒸馏水冲洗3 ~4 次,用去离子水培养3 d 之后取出,用蒸馏水冲洗3 次,用无磷滤纸吸干表面的水分,备用。
取洱海湖中心的水经Whatman 膜(周长为47 mm)过滤,去除水中的藻类和一些杂质,测得水中总磷浓度为 0.015 mg/L,加入不同剂量的NaH2PO4·2H2O,将总磷浓度调至0.015、0.075 和0.150 mg/L 的培养液装入大桶中备用。将上述处理好的满江红准确称取(1.00 ±0.05)g,放入装有上述各浓度培养液600 mL 到1 L 烧杯中,每天更换烧杯中50%培养液,以维持培养液中供满江红生长所需的总磷浓度。分别设置5 个温度10、15、20、25、30 ℃,光源为荧光灯,光照强度为5 500 ~6 000 lx,光暗比为12 h∶12 h,pH 为6.5 ~7.5,每个处理做4 个平行,总计60 个处理组,试验持续15 d,即最大生物量增长到试验前的3 倍时结束。
1.2 测定指标和方法
满江红生物量测定采用鲜重法。经预培养的满江红用滤纸吸干称重,培养中每3 d 测一次生物量。满江红生物量的累积指标以相对生长率(RGR)表示:
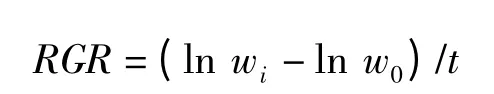
式中,w0为0 时期满江红的质量,g;wi为i 时期满江红的质量,g;t 为时间间隔,d[21]。
总磷浓度采用过硫酸钾消煮-钼锑抗分光光度法测定;总氮浓度采用过硫酸钾氧化-紫外分光光度法测定[30];pH 采用DELTA-320 pH 计水质测定仪直接测定;光照强度用LI-250A 光照计测定。
鲜样在105 ℃烘箱中杀青15 min,取出在(65 ±5)℃烘箱中烘干至恒重,记下先后的质量,计算出含水率。干样经粉碎过80 目筛(孔径为0.2 mm)测定植物组织中的总氮和总磷浓度,其中总氮浓度采用全自动定氮仪(UDK152)测定;总磷浓度采用H2SO4-H2O2消煮,再用钒钼黄法测定[31]。
根据满江红试验前后组织中总磷浓度的不同,计算出试验前后植物组织中总磷的增加量,同时计算出添加到水体培养液中的总磷浓度,计算出满江红对水体中磷的吸收率,其计算公式如下:
磷吸收率=植物组织中磷的增加量/水中磷浓度×100%
采用SPSS 13.0 分析软件对试验数据进行方差分析(ANOVA)和相关分析。
2 结果
2.1 有无满江红生境中磷浓度的差异
在各相似生境中,有满江红生长的生境总磷浓度为0.053 ~0.093 mg/L,无满江红生长的生境总磷浓度为0.096 ~0.175 mg/L,各采样点有满江红生长的生境其总磷浓度都低于无满江红生长的生境(表1,P <0.05)。
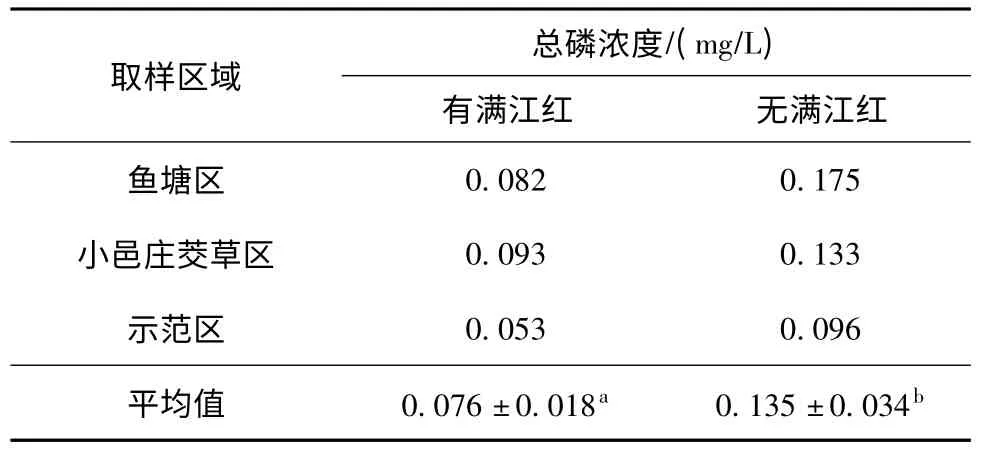
表1 满江红各典型生境中总磷浓度Table 1 The phosphorus concentration in water with typical habitats of A. imbricata
2.2 不同水温和磷浓度下满江红的生长状况
满江红在试验设定的温度范围内(10 ~30℃)均能生长,温度为10 ℃时生长最缓慢,其次是15 ℃,再次是30 ℃,满江红在20 和25 ℃生长相对较快,在此温度下的满江红生物量显著高于其他温度(图1,P <0.01),表明20 ~25 ℃是满江红生长的适宜温度。满江红生物量随着水中磷浓度的升高而增大,生长于磷浓度为0.075 和0.150 mg/L 水中的生物量没有显著差异(P >0.05),但都显著高于生长于0.015 mg/L 水中的生物量(图1,P <0.05)。

图1 满江红生物量随水温和水中磷浓度的变化Fig.1 Biomass of A. imbricata increasing with temperature and P concentration increase
水温和磷浓度均是影响满江红生长的重要因子,且二者对满江红的生物量交互影响也显著(表2,P <0.01)。5 个温度处理组(10、15、20、25 和30℃)中,满江红的生物量随着水中磷浓度升高而增加,同时满江红生物量在磷浓度处理组间差异显著(图1,表2,P <0.01)。
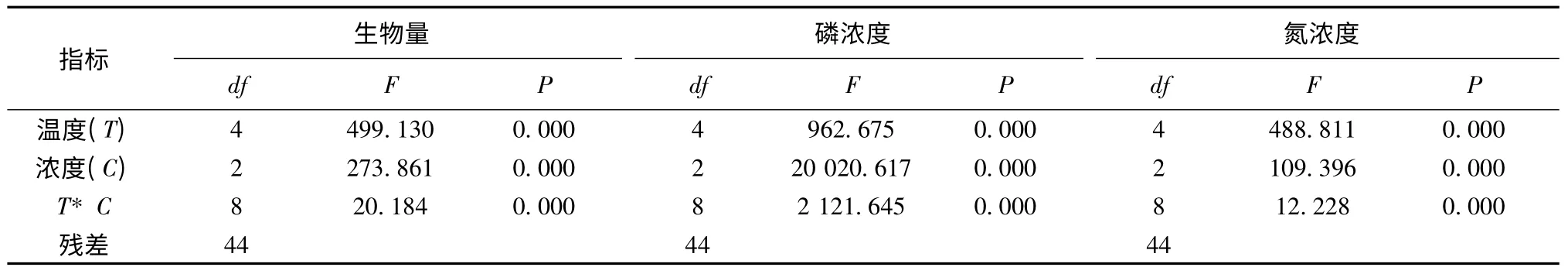
表2 水温和磷浓度对满江红生物量、植物组织中氮磷浓度的影响统计分析Table 2 Effects of biomass,nitrogen and phosphorus content of A.imbricata at different temperature and phosphorus concentration
试验结束后(15 d),发现满江红的相对生长率在不同磷浓度条件下都随水温的升高呈先升高后下降趋势,在20 和25 ℃达到最大,满江红的相对生长率随水中磷浓度的升高而升高,满江红的相对生长率在磷浓度为0.075 和0.150 mg/L 时比磷浓度为0.015 mg/L 要高(图2,P <0.01)。
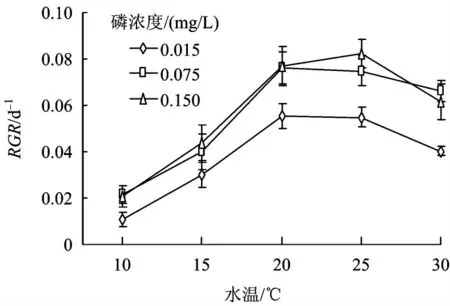
图2 不同水温下满江红的相对生长率Fig.2 The relative growth rate of A. imbricata in five temperature treatments
2.3 温度和水中磷浓度对满江红植物体内氮磷浓度的影响
培养前(对照)满江红植物组织中氮和磷浓度分别为20.1 和1.31 mg/kg。温度为10 ~25 ℃,生长在磷浓度为0.075 ~0.150 mg/L 下植物组织中的磷浓度随着温度的升高而增加,30 ℃时有下降趋势,在磷浓度为0.015 mg/L 下则相反,各温度下植物组织的磷浓度没有显著差异(P >0.05),各温度处理组中植物组织的磷浓度都随着水中磷浓度的升高而增加,水中磷浓度对植物组织中磷浓度影响显著(图3,P <0.05)。
植物组织中的氮浓度随着温度的升高而增加,30 ℃呈下降趋势,各温度下植物组织中的氮浓度表现出显著差异(P <0.05);植物组织中氮浓度在水中磷浓度为0.075 mg/L 时最大,与0.150 mg/L 没有显著差异(P >0.05),显著高于0.015 mg/L(P <0.05);水温和水中磷浓度对植物组织中氮和磷浓度交互影响显著(图3,表2,P <0.01)。
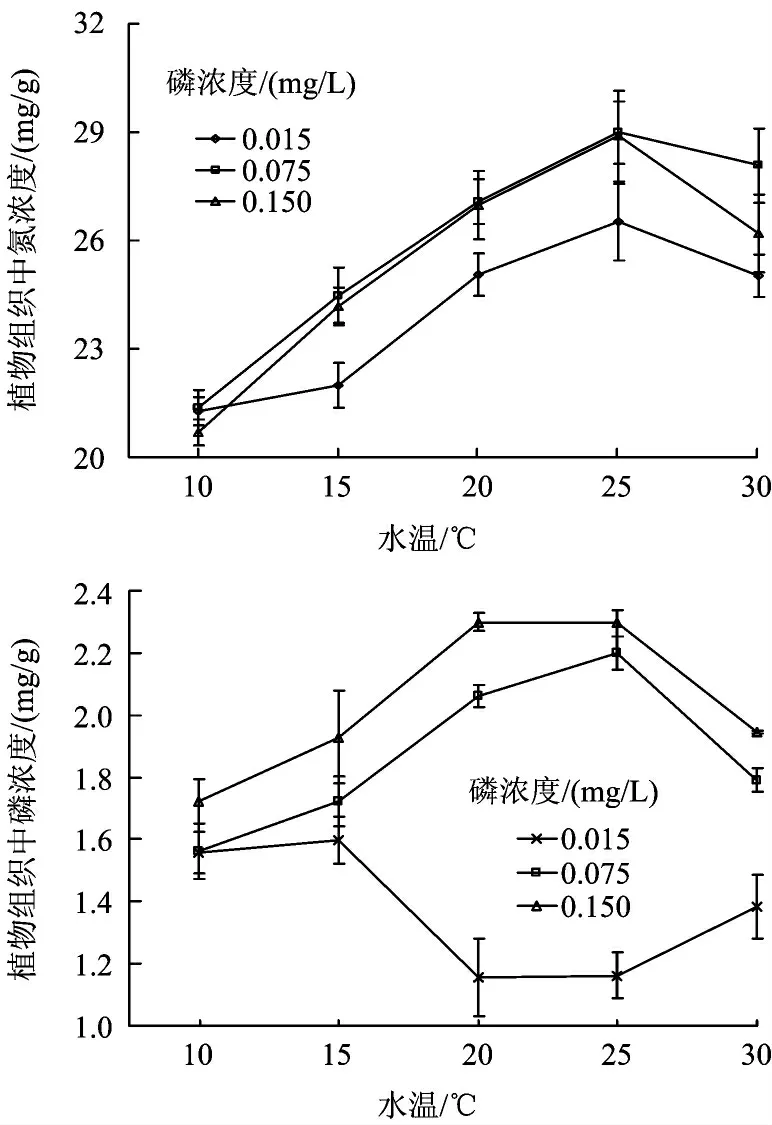
图3 满江红植物组织中氮磷浓度随水中磷浓度的变化Fig.3 Tissue N and P concentrations of A. imbricata with temperature and P concentration increase
2.4 植物组织增加的氮磷浓度及对磷的吸收率
各处理组中的氮磷总量= 各处理组质量(干重)×植物组织氮磷浓度。植物组织氮磷总量随温度的升高先增加,到30 ℃时下降;在磷浓度为0.075 和0.150 mg/L 处理中植物组织磷浓度升高的幅度要大于磷浓度为0.015 mg/L 的处理(图4)。
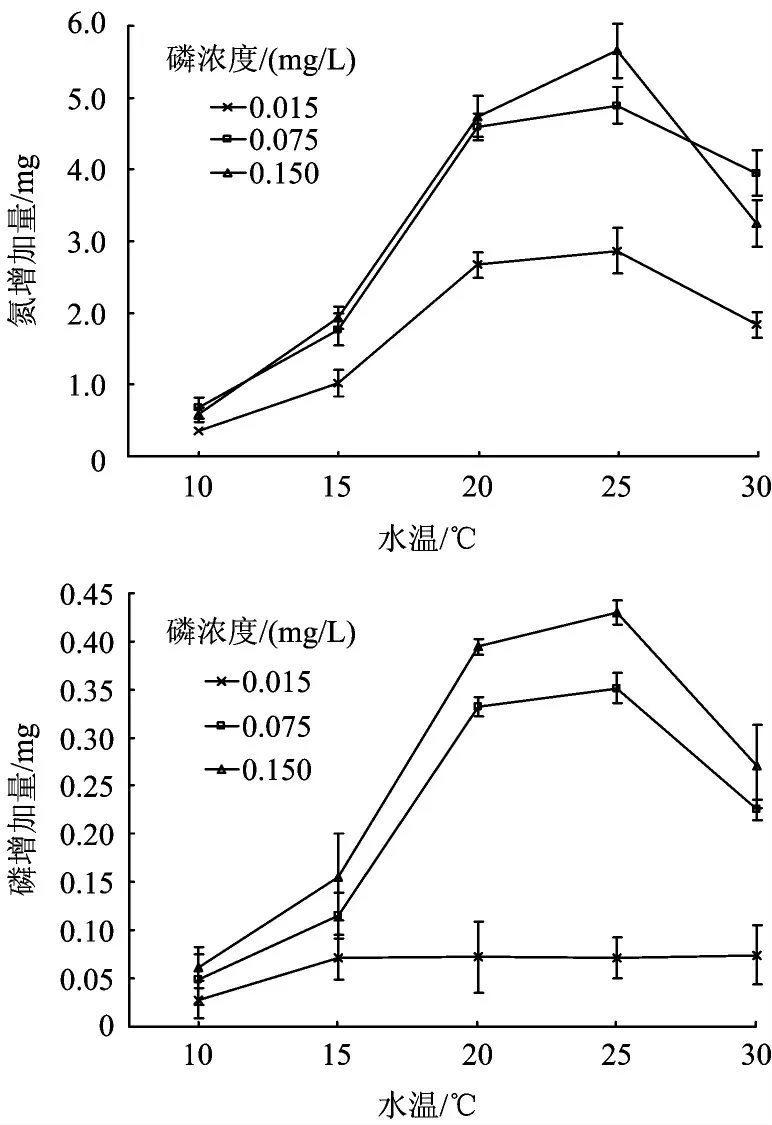
图4 各处理中满江红中氮磷增加量Fig.4 The increasing nitrogen and phosphorus amount of A. imbricata in each treatment
在水中磷浓度为0.015 ~0.150 mg/L 的3 个处理中,满江红对水中磷的吸收率随浓度的增大而下降,在磷浓度为0.015 mg/L 条件下除了10 ℃,其他温度下的吸收率均达到99.5%以上;在磷浓度为0.075 mg/L 条件下,20 和25 ℃时,满江红对水中磷的吸收率分别达到92.27%和97.63%,而在磷浓度高达0.150 mg/L 条件下满江红对水中磷的吸收率最高不到60%(图5)。

图5 满江红植物组织对水中磷的吸收率Fig.5 Absorption rate of phosphorus in water by A. imbricata
3 讨论
相关研究表明,低温和高温都不利于满江红的生长,在低于5 ℃和高于40 ℃时满江红会停止生长;一般情况下,8 ~12 ℃满江红开始生长,其生长的最适温度为20 ~25 ℃[32]。另外,低温下满江红体内的花青素会增多,使其叶片呈现红褐色[17],与观察到满江红植物红色比例在10 ℃时最高的现象一致。文中结果表明,满江红植物生物量、相对生长率都先随温度的升高而增加,到30 ℃时二者均有下降,这主要是因为高温或低温会引起植物光系统的光活性降低,光合作用过程降低,光合产物积累减少,从而减少植物生物量,降低相对生长率[33]。
随着培养液中磷浓度的升高,植物生物量、相对生长率、组织中氮磷浓度以及各处理组植物组织中增加的氮磷总量都呈增加趋势,但是植物对磷的吸收率是下降的,说明水中磷浓度为0.015 mg/L 还不能完全满足满江红的生长和繁殖。水中磷浓度为0.075 ~0.150 mg/L 适合满江红的生长,且能完全满足满江红的生长需求,该浓度范围与野外采样时测定的满江红各生境的磷浓度相符,表明洱海湖滨带水域的磷浓度非常适合满江红的生长,可能是满江红近年在洱海快速扩散的一个重要原因。
洱海野外调查以及室内试验都表明,满江红是一种能大量吸收水中氮磷等营养盐的漂浮植物。首先,满江红体内组织相对高的氮磷浓度,使其在同等生物量的情况下能去除更多的氮和磷[34];其次,满江红是蕨类植物,生活史周期短,无性繁殖能力强,相对其他高等水生植物,满江红生长速率更快,短时间内能积聚更大的生物量;再次,洱海年平均气温为15.7 ℃,最高气温为34 ℃,最低气温为-2.3 ℃,一年中大部分时间都适合满江红的生长,更有利于满江红对水体中氮和磷的吸收。洱海水位每年7月开始上涨,10月底达到最大,随着水位的上涨,洱海湖滨淹没区增大,形成大片污染较重的滞水区[28],非常适宜满江红的生长。而此时,湖滨区其他水生植物已基本停止生长,部分水生植物开始枯萎、衰败并被微生物降解,尽管秋冬季并不是满江红的最适生长季节,由于其相对短的生活史周期,满江红仍然能保持较快的生长和繁殖速率,至11月湖滨滞水区往往形成一层很厚的覆盖层,有可能加速沉水植物缺氧死亡,形成二次污染。另外,在3—4月温度开始回升后,满江红又开始增加,影响了沉水植物的出苗生长。因此,为不影响湖滨区沉水植物的生长和消除二次污染,建议每年在11月及3—4月对满江红进行打捞管理。
4 结论
水温和水体中磷的浓度是影响满江红生长的重要因子,两因子对满江红的生长存在交互作用。水体中磷浓度为0.075 mg/L、温度为25 ℃时,满江红生物量和植物组织中的氮磷浓度达到最高水平,对水中磷吸收效果最好。建议洱海每年11月及3—4月对满江红进行打捞管理,以免造成二次污染和影响湖滨区沉水相物的生长,同时打捞出的满江红可作为优良绿肥。
[1]刘培桐,薛纪渝,王华东.环境学概论[M].北京:高等教育出版社,1995.
[2]HARPER D. Eutrophication of freshwater zooplankton:principles,problems and restoration[M].London:Chapaman and Hall,1992:120-127.
[3]OLGUIN E J. Pyhycoremediation:key issues for coereffective nutrient processes[J].Biotechnol Adv,2003(2):81-91.
[4]SHIOMI N,KITOH S. Use of Azolla as a decontanminant in sewage treat [M]//Azolla utilisation. Los Banos,Laguna,Philippines:International Rice Research Institute,1987:169-176.
[5]KORNER S,VERMAAT J E. The relative importance of Lemna gibba L.,bacteria and algae for the nitrogen and phosphorus removal in duckweed-covered domestic waster[J]. Water Res,1998,32:3651-3661.
[6]KORNER S,LYATUU G B,VERMAATT J E. The influence of Lemna gibba L. on the degradation of organic material in duckweed-covered domestic wastewater[J]. Water Res,1998,32:3092-3098.
[7]TRIPATHI B D,SHUKLA S C.Biological treatment of wastewater by selected aquatic plants[J].Environ Pollut,1991,69:69-78.
[8]GERTOFF G C,KROMBHOLZ P H.Tissue analysis as a measure of nutrient availability for the growth of aquatic plants[J].Limnol,1966,20:1153-1158.
[9]FINAYLON C M,FRREL T P,GRIFFIHS D J. Studies of the hydrobiology of a tropical lake in north-western Queensland:Ⅲ.growth,chemical composition and potential for harvesting of aquatic vegetion[J].Marine and Freshwater Research,1984,35:525-536.
[10]WARD J C,TALBOT J M,STEWART I D.Aboveground biomass and productivity of submerged macrophytes in Lake Alexandrina,New Zealand[J].New Zealand Journal of Marine and Freshwater Research,1987,21:215-221.
[11]SHELDON R B,BOYLEN C W.An underwater survey method for estimating submerged macrophyte population density and biomass[J].Aquatic Botany,1977(4):65-72.
[12]NICHOLSON S A. Changes in submersed macrophytes in Chautauqua Lake,1937-1975[J]. Freshwater Biology,1981,11:523-530.
[13]RICKETT H W.A quantitative study of the large aquatic plants of lake Mendota[J]. Transactions of the Wisconcin Academic Science and Arts Letters,1992,20:501-527.
[14]STAKE E.Higher vegetation and phosphorus in a small stream in central Sweden [J]. Aquatic Sciences:Research Across Boundaries,1968,30:353-373.
[15]HUTCHINSON C E. A treatise in limnology[M]. Wiley:University of Michigan,1975.
[16]BARKO J W,SMART R M. Comparative influence of light and temperature on the growth and metabolism of selected submersed freshwater macrophytes[J]. Ecology Monography,1981 (5):219-235.
[17]WAGNBR G M.Azolla:a review of its biology and urifizarion[J].Botanical Review,1997,63:1-26.
[18]BENNICELLI R,OSTROWSKI J.The ability of Azolla caroliniana to remove heavy metals[Hg(Ⅱ),Cr(Ⅲ),Cr(Ⅵ)]from municipal waste water[J].Chemosphere,2004,55:141-146.
[19]FOMI C,CASCONE A,COZZOLINO S,et al. Drugs uptake and degradation by aquatic plants as a bioremediation technique[J].Minerval Biotechnology,2001,13:151-152.
[20]LUMPKIN A,PLUCKNETT D L. Azolla:botany,physiology and use as green manure[J].Economic Botany,1980,34:111-153.
[21]陈坚.满江红在不同培养条件下的生产性能及其与营养成分变化的关系[J].植物营养与肥料学报,2003(9):467-472.
[22]BENAROYA R,TZINVTELOR E,ZAMSKI E.Lead accumulation in the aquatic fern Azolla filiculoides[J]. Plant Physiology Biochemistry,2004,42(7/8):639-645.
[23]FORNI C,CHEN J,TANCIONI L,et al. Evaluation of the fern Azolla for growth nitrogen and phosphorus removal from waste water[J].Water Res,2001,35:1592-1598.
[24]SELA M J,TELOR E. The accumulation and the effect of heavy metals on the water fem Azolla filiculoides[J]. New Phytologist,1989,112:7-12.
[25]GAUR J,NORAHO N. Adsorption and uptake of cadmium by Azolla pinnata:kinetics of inhibition by cations[J]. Biomedical Environmental Science,1995,8:149-157.
[26]PILONS E A,DE SOUZA M P,HONG G.Selenium volatilization and accumulation by twenty aquatic plant species[J]. J Environ Qual,1999,28:1011-1018.
[27]刘一,樊廷录,唐小明.水生饲草满江红的研究及评价[J].甘肃农业科技,2000(5):42-44.
[28]尹延震,储昭升,赵明,等. 洱海湖滨带水质的时空变化规律[J].中国环境科学,2011,31(7):1192-1196.
[29]杨钟鹤. 滇西高原湖泊洱海的pH 研究[J]. 云南环境科学,1997,16(2):22-25
[30]魏复盛.水和废水监测分析方法[M].4 版.北京:中国环境科学出版社,20002.
[31]鲍士旦.土壤农化分析[M].3 版. 北京:中国农业技术出版社,2005:264-266.
[32]胡家文.满江红的生物学特征及其渔业利用[J].现代渔业信息,2005(11):3-5.
[33]陈立明.满江红和蕨状满江红的耐热性及耐寒性与固氮的光系[J].水生生物报,1989,13(1):43-49.
[34]吴爱平. 长江中下游浅水湖泊大型水生植物氮磷含量研究[D].武汉:中国科学院水生生物研究所,2005. ▷
