聚吡咯掺杂苯磺酸钠葡萄糖生物传感器*
2014-07-18闫长领郭玉娟张春朵王公轲
闫长领, 郭玉娟, 张春朵, 王公轲, 刘 璟
(河南师范大学 化学化工学院,河南 新乡 453007)
聚吡咯掺杂苯磺酸钠葡萄糖生物传感器*
闫长领, 郭玉娟, 张春朵, 王公轲, 刘 璟
(河南师范大学 化学化工学院,河南 新乡 453007)
采用电化学聚合技术,用掺杂苯磺酸钠的聚吡咯(PPy)导电薄膜修饰铅笔芯电极,在修饰电极表面吸附葡萄糖氧化酶制备了葡萄糖生物传感器。研究了苯磺酸钠掺杂对PPy薄膜形貌、葡萄糖传感器性能的影响。实验结果表明:掺杂苯磺酸钠能够改变PPy形貌、极大提高其导电性。优化条件下该生物传感器抗干扰能力强、稳定性好,响应电流和葡萄糖浓度在0~0.7 mmol/L范围内有良好的线性相关度(R=0.997 6),灵敏度为26.10 μA/mmol/L,平均响应时间约为6.5 s,检测下限为47.2 μmol/L。
电化学聚合; 聚吡咯; 苯磺酸钠; 葡萄糖生物传感器
0 引 言
在食品工业、临床诊断和生物技术等众多领域,快速高效检测葡萄具有重要意义[1]。聚吡咯(PPy)作为一种导电材料具有良好的环境稳定性、高导电性、一定的渗透性和合成方便等优点而广泛应用于传感、电池、光电等方面,尤其在葡萄糖生物传感器方面得到广泛应用[2~4]。研究表明,利用电化学聚合时通过掺杂芳香类阴离子能够提高PPy薄膜的导电性、热稳定性,增强PPy薄膜在电极上的附着力,改变薄膜的微观结构和形貌,提高薄膜的通透性和对酶的固定能力[5~7]。
本文通过掺杂苯磺酸阴离子,研究了PPy葡萄糖生物传感器的检测性能。实验表明:掺杂苯磺酸阴离子可显著提高传感器的灵敏度、使用寿命,响应速度快,在低浓度具有良好线性和强的抗干扰能力。
1 实验部分
1.1 主要仪器与试剂
采用CH1660型电化学工作站(北京华科普天科技责任有限公司)JSM—6390LV型扫描电子显微镜(日本电子公司)。
吡咯(阿拉丁化学试剂公司),苯磺酸钠(阿拉丁化学试剂公司),葡萄糖(天津科密欧化学试剂有限公司),葡萄糖氧化酶(100—250 kU/g,北京奇松生物科技有限公司),磷酸二氢钠(北京化工厂),磷酸氢二钠(北京化工厂)等均为分析纯试剂,吡咯使用前减压蒸馏,其它试剂直接使用。葡萄糖氧化酶溶液由5 mg牛血清蛋白(BSA)和2.5 mg的葡萄糖氧化酶(GOD)溶于100 μL的磷酸盐缓冲液(PBS,0.1 mol /L,pH=7.00)中配制而成,实验用水均为二次水。
1.2 铅笔芯电极的预处理
将2B铅笔芯(直径2 mm)套上绝缘橡胶套,依次用2 mol /L硫酸、6 mol /L盐酸和4 mol /L硝酸浸泡5 min后用水洗净,留出5 mm,用金相砂纸打磨抛光后再用水洗净,使用前在0.1 mol/L硫酸溶液中激活。
1.3 葡萄糖生物传感器的制备
利用电化学工作站,以铅笔芯 (PCE)为工作电极,铂电极为辅助电极,饱和甘汞电极为参比电极组成三电极体系,在50 mL含0.1 mol/L PPy和不同比例的苯磺酸钠(BSNa)溶液中,在恒电位0.7 V,恒温25 ℃条件下,电化学聚合90 min。聚合完成后取出工作电极,用二次水洗净、干燥,电极表面形貌用扫描电子显微镜进行表征。
对文献[4,8,9]报道的方法进行改进,将葡萄糖酶固定在掺杂的PPy薄膜表面。每次取10 μL酶溶液均匀地涂覆在电极的PPy/BSNa薄膜表面,晾干后再涂第二层,依次涂覆40 μL酶溶液。然后将电极在5 %的戊二醛溶液中交联1 min,取出用水浸泡洗净,室温真空干燥过夜,然后保存在4 ℃的PBS溶液中。该生物传感器标记为:PCE-PPy/BSNa-GOD。
1.4 传感器性能的检测
以PCE-PPy/BSNa-GOD为工作电极, 饱和甘汞电极为参比电极,铂电极为辅助电极组成三电极体系。测试底液为50 mL 空气饱和的PBS溶液。在室温(20 ℃)、恒电位(0.5 V)条件下测量电流响应, 待背景电流稳定后用微量进样器每次加入250 μL不同浓度的葡萄糖标准溶液(放置24 h),使溶液中葡萄糖溶液浓度从0~1.5 mmol/L变化,测量加入葡萄糖溶液前后电流变化[10,11]。
2 结果与讨论
2.1 掺杂对PPy薄膜形貌的影响
图1为掺杂BSNa的PPy(PPy/BSNa)薄膜代表性样品的扫描电镜照片。可以看出:PPy薄膜均呈由小微粒组成的菜花状结构,掺杂量的增加薄膜表面形貌变化菜团状微粒稍有增大。与未掺杂相比,PPy/BSNa薄膜较平滑、致密,组成菜花状结构的微粒更小。这是因为在聚合过程中,掺杂后磺酸根基团使薄膜表面具有一定的亲水性,对聚合物微粒的聚集有一定的阻碍作用[12]。

图1 溶液中吡咯单体与BSNa为不同摩尔比时得到的PPy薄膜扫描电镜图Fig 1 SEM images of PPy films prepared from an aqueous solutions containing different molar ratio of pyrrole to BSNa
2.2 掺杂对传感器性能的影响
图2是掺杂量不同的条件下制备的PCE-PPy/BSNa-GOD生物传感器对葡萄糖的电流响应曲线图。可以看出,掺杂的生物传感器对葡萄溶液的响应电流远远大于未掺杂传感器。当电解液中吡咯单体与BSNa的摩尔比为1∶0.6时,传感器的导电性最强,基础响应电流大约提高15倍;传感器对葡萄糖溶液的响应电流也最大,在线性范围内灵敏度高。这一方面是由于掺杂BSNa改变了PPy薄膜的表面形貌,使薄膜有效表面积增大,葡萄糖与酶作用的活性位点增多。另一方面,平面型的芳香性苯磺酸根阴离子掺杂有利于PPy链规整排列,使得链间π电子波函数和重叠加强,电荷传输更容易,增强了的薄膜的导电性[13,14]。然而,掺杂量过多掺杂离子会降低PPy链的长度、影响链间作用破坏链的规整性,从而导致导电能力的降低。
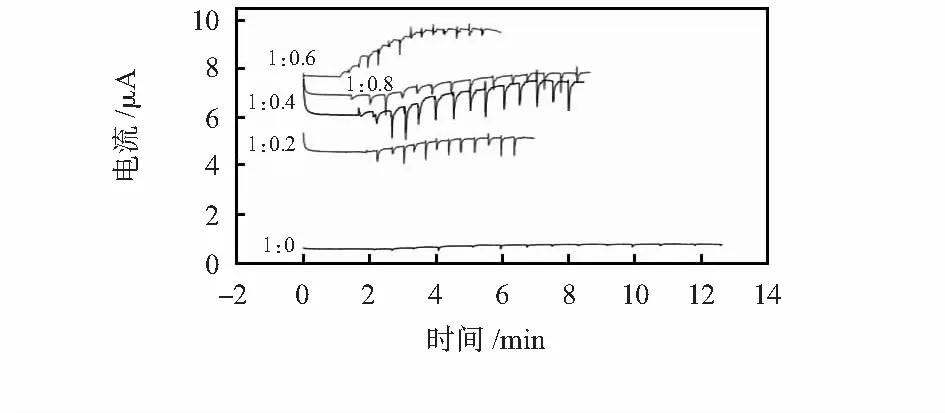
图2 改变溶液中吡咯与BSNa摩尔比时得到的PCE-PPy/BSNa-GOD生物传感器对葡萄糖的电量响应Fig 2 Amperometric response of PCE-PPy/BSNa-GOD sensors to glucose(PPy film is prepared from an aqueous solutions containing different molar ratio of pyrrole to BSNa)
对图2(d)的响应电流数据进行处理可以得到生物传感器对葡萄糖的相关性能参数(表1),其中响应时间为在线性范围内每次注入葡萄糖溶液至响应电流达到最大值90 %时所用时间的平均值。 可以看出:优化条件下,该传感器具有灵敏度高、线性相关度高、电流响应时间短等优良性能。

表1 优化条件下PCE-PPy/BSNa-GOD传感器对葡萄糖溶液的性能参数Tab 1 Performance parameters of PCE-PPy/ BSNa-GOD sensor to glucose under optimal conditions
2.3 传感器的抗干扰性和稳定性
实验考察了常见干扰物抗坏血酸(AA)、尿酸(UA)、L—半胱氨酸(L-cys)对传感器响应电流的影响。图3是以空气饱和的PBS溶液为底液,依次加入葡萄糖溶液和干扰组分溶液的电流响应情况[1,15,16]。可以看出:加入干扰物电流未发生任何变化,当再次加入葡萄糖溶液时又出现明显的响应电流,说明传感器对常见的干扰物具有良好的抗干扰能力。
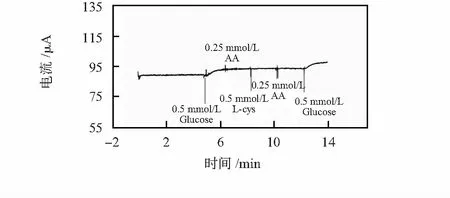
图3 传感器的抗干扰测试曲线Fig 3 Anti-interference detection curve of sensor
在含有0.5 mmol/L葡萄糖的PBS缓冲溶液中,检测传感器的稳定性。最初连续5天,每天测试一次,然后每隔5天一次,其间将传感器于4 ℃的PBS溶液中保存。结果(图4)表明:该生物传感器具有良好的稳定性,30天内对葡萄糖的响应电流稳定,保持了大约92 %的响应电流。
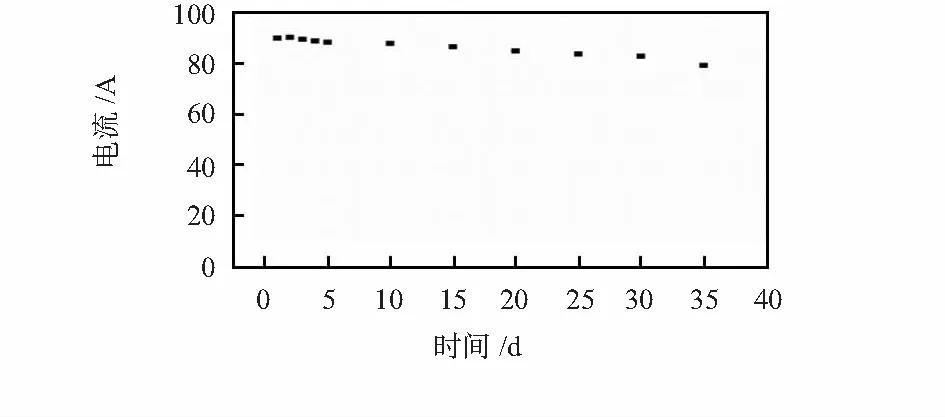
图4 优化条件下PCE-BSNa/PPy-GOD传感器的使用寿命Fig 4 Working lifetime of PCE-BSNa/PPy-GOD biosensor under optimal conditions
3 结 论
采用电化学方法,通过改变溶液中吡咯与BSNa的摩尔比制备了掺杂PPy薄膜葡萄糖生物传感器。掺杂量对对PPy形貌和导电性能有很大影响。当溶液中吡咯与BSNa的浓度比为1∶0.6时,制备出的传感器性具有良好的性能,在低浓度溶液范围内线性较好,响应快、灵敏度高,使用寿命可长,对抗坏血酸、尿酸和半胱氨酸等常见干扰成分具有较强的抗干扰能力。
[1] Li Mian,Bo Xiangjie,Mu Zhongcheng,et al.Electrode position of nickel oxide and platinum nanoparticles on electrochemically reduced graphene oxide film as a nonenzymatic glucose sensor[J].Sensors and Actuators B,2014,192:261-268.
[2] Chandrasekaran J,Nithyaprakash D,Punithaveni B,et al.Study of optical, dielectric and optoelectronic properties of dodecylbenzene sulfonic acid doped polypyrrole[J].Optik,2013,124:2057-2061.
[3] Korcan Korba,Levent Pelit,Füsun Okçu Pelit,et al.Preparation and characterization of sodium dodecyl sulfate doped polypyrrole solid phase micro extraction fiber and its application to endocrine disruptor pesticide analysis[J].Journal of Chromatography B,2013,929:90-96.
[4] Vahideh Safarnavadeh,Karim Zare,Ali Reza Fakhari.Capability of parasulfonato calixarene, as an anion dopant,and organic solvents in enhancing the sensitivity and loading of glucose oxidase(GOx)on polypyrrole film in a biosensor:A comparative stu-dy[J].Biosensors and Bioelectronics,2013,49:159-163.
[5] Ramanavicius A,Ryskevic N,Kausaite-Minkstimiene A,et al.Fluorescence study of glucose oxidase self-encapsulated within polypyrrole[J].Sensors and Actuators B,2012,171-172:753-759.
[6] Shi Kaiyuan,Zhitomirsky Igor.Influence of current collector on capacitive behavior and cycling stability of Tiron doped polypyrrole electrodes[J].Journal of Power Sources,2013,240:42-49.
[7] Chen S,Zhitomirsky I.Polypyrrole electrodes doped with sulfani-lic acid azochromotrop for electrochemical supercapacitors[J].Journal of Power Sources,2013,243:865-871.
[8] Fiorito Pablo A,Brett Christopher M A,Córdoba de Torresi Susana I.Polypyrrole/copper hexacyanoferrate hybrid as redox mediator for glucose biosensors[J].Talanta,2006,69:403-408.
[9] 田承云,曹大均,章宗攘.基于聚吡咯的平面型葡萄糖传感器的研究[J].分析化学,1998,26(7):854-857.
[10] Olea David,Viratelle Odile,Faure Chrystel.Polypyrrole-glucose oxidase biosensor:Effect of enzyme encapsulation in multilamellar vesicles on film growth and morphology[J].Biosens Bioelectron,2008,23:788-794.
[11] Wang Joseph,Musameh Mustafa. Carbon-nanotubes doped polypyrrole glucose biosensor[J].Anal Chim Acta,2005,539:209-213.
[12] Lang Xuemei,Wan Qunyi,Feng chunhua,et al.The role of anthraquinone sulfonate dopants in promoting performance of polypyrrole composites as pseudo-capacitive electrode materials[J].Synthetic Metals,2010,160:1800-1804.
[13] Arantes C,Rocco A M,Rocco M L M.Spectroscopic investigation and characterization of polypyrrole film doped with[MeN4]2[Ni(dmit)2]complex salt[J].Journal of Molecular Structure,2010,969:220-228.
[14] Ebrahim Sh M,Abd-El Latif M M,Gad A M,et al.Cyclic voltammetry and impedance studies of electrodeposited polypyrrole na-noparticles doped with 2-acrylamido-2-methyl-1-propanesulfonic acid sodium salt[J].Thin Solid Films,2010,518:4100-4105.
[15] Cheng Chen,Yan Jiang,Kan Jinqing.A noninterference polypyrrole glucose biosensor[J].Biosens Bioelectron,2006,22:639-643.
[16] 冯琳洁,吴芳华,徐继明,等.基于聚吡咯纳米阵列的葡萄糖传感器研究[J].化学传感器,2007,27(3):23-28.
Benzene sulfonic acid sodium doped polypyrrole glucose biosensor*
YAN Chang-ling, GUO Yu-juan, ZHANG Chun-duo, WANG Gong-ke,LIU Jing
(School of Chemistry and Chemical Engineering,Henan Normal University,Xinxiang 453007,China)
A benzene sulfonic acid sodium doped polypyrrole(PPy)glucose biosensor is fabricated through electrochemical polymerization on pencil-core electrode.The influence of dopant ion on the morphology and performance of the biosensor is investigated.The morphologic change and the enhancement of conductivity have been found for the doped PPy film.The optimized results indicate that the biosensor exhibited excellent linear response to glucose at linear range 0~ 0.7 mmol/L(R=0.997 6),a low detection limit of 47.2 μmol/L(3SD/slope),average response time(is about 6.5 s)and sensitivity is 26.10 μA/mmol/L,also,the biosensor has good stability and anti-interference ability.
electrochemical polymerization; polypyrrole(PPy); benzene sulfonic acid sodium; glucose biosensor
10.13873/J.1000—9787(2014)12—0082—03
2014—04—15
国家自然科学基金资助项目(21173071,21071047)
O 657.1
B
1000—9787(2014)12—0082—03
闫长领(1965-),男,河南濮阳人,副教授,主要研究方向为电化学和溶液化学。