糖尿病患者外周血内皮祖细胞的相关影响因素研究
2014-07-13吴鸿涛杨毅宁
王 芳, 王 宁, 吴鸿涛, 杨毅宁, 张 雪
(1新疆医科大学, 乌鲁木齐 830011; 2新疆伊犁州奎屯医院内分泌科, 新疆 奎屯 833200;新疆医科大学第一附属医院3干部内一科, 4冠心病一科, 5临床研究院, 乌鲁木齐 830054)
2型糖尿病是一种全身代谢性疾病,糖尿病血管病变具有多支、弥漫的特点,其伴有严重的血管内皮修复能力减低及侧支循环不足现象。糖尿病血管病变与高血糖、高血压、血脂异常、胰岛素抵抗等所引起的血管内皮细胞功能异常密切相关,内皮细胞功能异常是启动动脉粥样硬化形成的重要因素。内皮祖细胞(EPCs)是一类能增殖并分化为血管内皮细胞,但尚未表达成熟血管内皮细胞表型,也未形成血管的前体细胞[1-2]。内皮祖细胞不仅参与人胚胎血管生成,同时也参与出生后血管新生和内皮损伤后的修复过程[3-5]。本研究旨在探讨2型糖尿病患者与非糖尿病患者的外周血内皮祖细胞数量与丙二醛(MDA)、游离脂肪酸(FFA)及细胞间黏附分子-1(CAM-1)的相关性,以了解影响糖尿病患者内皮祖细胞数量的因素,为今后2型糖尿病的治疗提供理论依据。
1 对象与方法
1.1研究对象选择2013年5-8月新疆医科大学第一附属医院干部病房住院的2型糖尿病患者48例(糖尿病组),其中男性25例,女性23例,平均年龄(64.14±11.73)岁。糖尿病诊断标准符合1999年WHO诊断标准,并排除1型糖尿病、严重肝和肾功能不全、严重的感染性疾病、肿瘤、近期服用糖皮质激素及/或性激素、严重的其他系统疾病。同期选择48例健康者为对照组,女性21例,男性27例,平均年龄(62.45±7.28)岁。两组年龄、性别差异无统计学意义。
1.2标本采集及检测于清晨8点采集受试者空腹状态下肘静脉血,分别送检测定空腹血浆葡萄糖(GLU)、糖化血红蛋白(HBA1C)、血常规、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、FFA、MDA和CAM-1;另留取2mL静脉血,采用流式细胞检测法测定外周血内皮祖细胞数量。流式细胞检测:使用美国BECKMAN COULTER 公司流式细胞仪对细胞表面CD133、VEGFR-2和CD34进行检测,采用PE标记CD133(德国美天旎公司)、Cy5.5标记 VEGFR2(Biolegend公司)、FITC标记CD34(Biolegend公司)。FFA采用比色法,用分光光度计检测,试剂盒购自南京建成生物工程公司。MDA采用硫代巴比妥酸比色法(TBA)测定。试剂盒购自南京建成生物工程公司,测量仪器使用酶标仪。CAM-1采用酶联免疫吸附法(ELISA)测定,试剂购自上海华壹生物科技公司。各操作过程严格按照说明书进行,各生化标本检测均由新疆医科大学第一附属医院检验科完成。

2 结果
2.1两组各项检测指标水平比较两组受试者TG、LDL-C、白细胞、舒张压、MDA、CD133差异均无统计学意义(P>0.05);糖尿病组HDL-C、VEGFR-2、CD34均低于正常组,差异有统计学意义(P<0.05);糖尿病组体质指数、收缩压、CAM-1、FFA均高于对照组,差异有统计学意义(P<0.05),见表1。
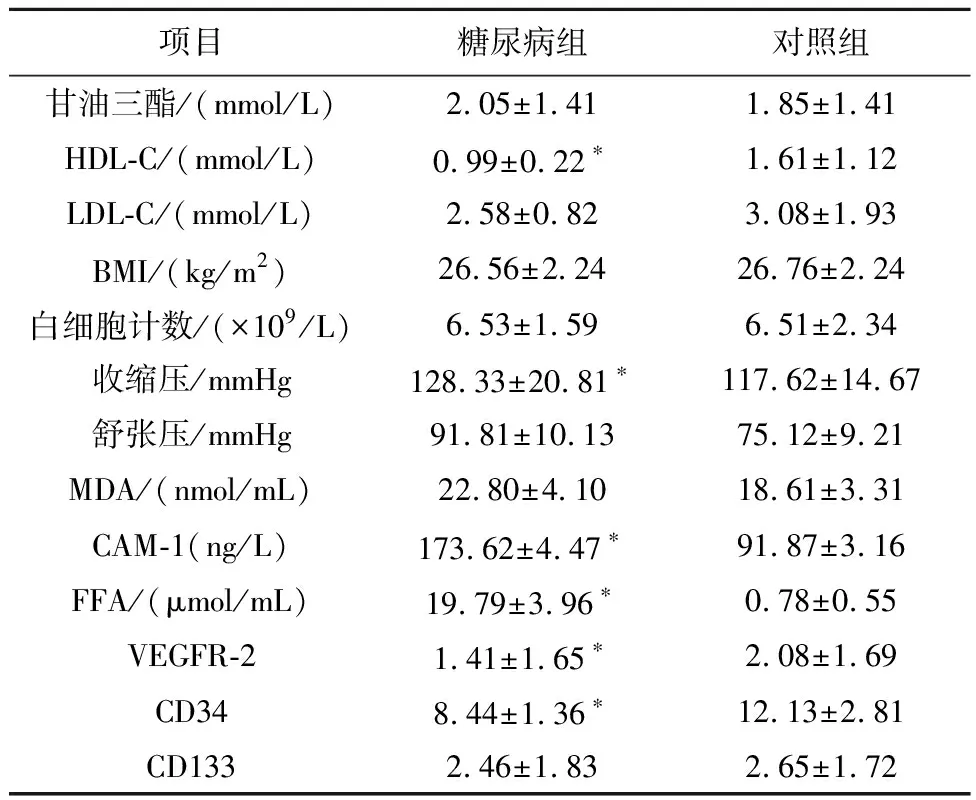
表1 糖尿病组与对照组各项检测指标比较
注: 与对照组比较,*P<0.05。
2.2糖尿病患者EPCs数量与FFA、MDA、CAM-1的相关性48例糖尿病患者FFA与CD34及VEGFR-2数量呈负相关(r=-0.552,P=0.001;r=-0.342,P=0.022),MDA及CAM-1无相关性,见表2。
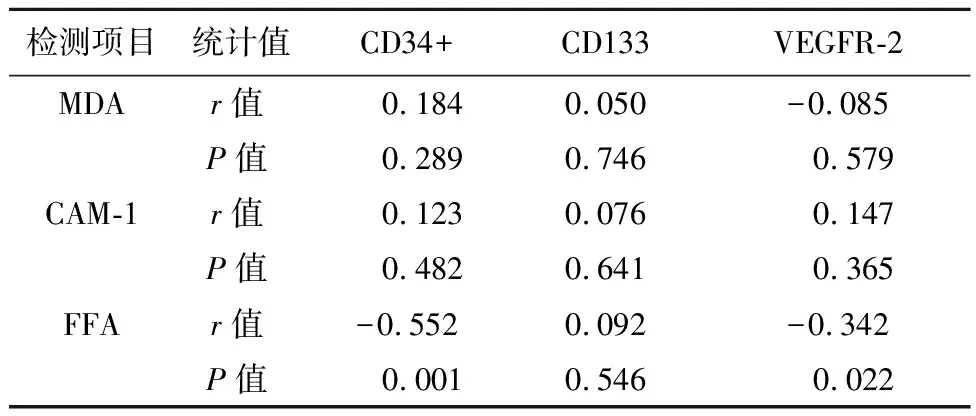
表2 糖尿病患者MDA、CAM-1、FFA与CD34、CD133、VEGFR-2相关性分析
3 讨论
糖尿病患者的高血糖、高胰岛素以及氧化应激等因素均可引起患者EPCs功能和结构改变,进而引起患者血管病变。糖尿病患者外周血EPCs表达CD34、VEGFR-2和CD133在细胞不同时期表面标记物表达不同。早期EPCs表达CD133、CD34、VEGFR-2;晚期EPCs表面的CD133消失,CD34表达下调,VEGFR-2表达上调,提示EPCs向成熟内皮细胞分化。Tepper等[6]研究发现,2型糖尿病患者不仅EPCs数量下降,而且其增殖、黏附、移行等功能均明显受损。本研究结果显示,糖尿病患者VEGFR-2和CD34细胞数量明显低于对照组,而CD133细胞数量减少并不明显,提示糖尿病对于EPCs不同分化阶段的影响可能不同,糖尿病可能主要影响了EPCs向成熟内皮细胞分化的过程,导致晚期EPCs数量明显减少。
内皮功能障碍的重要标记物之一的CAMs-1与肥胖、代谢综合征等密切相关[7-8]。CAM-1通过调节粒细胞的黏附、移行而在动脉病变形成早期发挥作用。有研究显示,CAM-1作为内皮功能的重要指标,在内皮损伤时表达明显增加,是预测心血管病死亡最为显著而独立的标记物之一[9]。本研究结果显示,糖尿病患者血清CAM-1显著高于对照组,差异有统计学意义。本研究的相关性分析并没有发现CAM-1与糖尿病患者EPCs数量下降有相关性。
Sahiel等[10]研究显示,游离脂肪酸与胰岛素抵抗密切相关。游离脂肪酸可通过抑制肝脏及肌肉组织中的胰岛素信号通路而加重胰岛素抵抗;反过来,胰岛素抵抗也可以引起肝脏脂质代谢紊乱,使游离脂肪酸合成增加,此外胰岛素抵抗还可使脂肪组织中脂肪分解酶活性增强,释放大量游离脂肪酸。游离脂肪酸又作为原料进入肝脏合成极低密度脂蛋白胆固醇及甘油三酯。本研究结果显示,糖尿病患者FFA水平明显高于正常对照组,并且相关性分析结果显示,糖尿病患者FFA水平与VEGFR-2及CD34细胞数量呈负相关。Artwohl等[11]研究显示,FFA在动脉粥样硬化形成及急性冠脉综合征中发挥重要作用。FFA浓度的增加与内皮细胞的加速凋亡有关,这种加速凋亡在糖尿病的重要靶组织尤为明显[12-14]。FFA不仅引起糖尿病视网膜等靶组织血管内皮细胞凋亡,也引起EPCs的凋亡,从而导致修复不良,加重血管疾病进程。但并未发现其对不同内皮祖细胞亚型的不同影响。本研究显示糖尿病患者FFA浓度与晚期EPCs数量呈负相关关系,与早期内皮祖细胞未见明确相关性。本研究显示糖尿病组与对照组外周血MDA浓度差异无统计学意义,考虑对照组只是非糖尿病者,而MDA受血糖以外许多因素影响,这些因素未能完全排除,可能影响了结果的分析。因此,本研究结果需要进行多中心、大标本试验来进一步验证。
参考文献:
[1] Asallara T, Murohara T, Sullivan A, et al. Isolation of putative endothelial cells forangiogenesis[J]. Seience,1997,275(5302):964-967.
[2] Peiehev M, Naiyer AJ, Pereiraetal J, et al. Expression of VEGFR-2 and AC133 by circulating human CD34(+)cells identifies a population of functional endothelialprecrsors[J].Blood,2000,95(3):952-958.
[3] Kocher AA,Schuster MD,Szabolcs MJ,et al. Neovascularization of is-chemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduce remodeling and improves cardiac function[J]. Nat Med,2011,7(4):430-436.
[4] Murayama T ,Tepper OM,Silver M,et al. Determination of bone marrow-derivedendothelial progenitor cell significance in angiogenic growth factor-induced neovascularization in vivo[J].Exp Hematol,2012,30(8):967-972.
[5] Suzuki T,Nishida M, Futami S,et al. Neoendothelialization after peripheral blood stem cell transplantation in humans:a case report of a Tokaimura nuclear accident victim[J].Cardiovasc Res,2009,58(2):487-492.
[6] Tepper OM, Galiano DR, Capla JM, et al. Human endothelial progenitor cells from type II diabeties exhibit impaired proliferation, adhesion, and incorporation into vascular structures[J]. Circulation,2002,106:2781-2786.
[7] Madrigano J, Baccarelli A, Wright RO, et al. Air pollution, obesity, genes and cellular adhesion molecules[J].Occup Environ Med,2010,67:312-317.
[8] Miller MA, Cappuccio FP. Cellular adhesion molecules and their relationship with measures of obesity and metabolic syndrome in a multiethnic population[J]. Obesity,2006,30(8):1176-1182.
[9] Rohde LE, Lee RT, Rivero J,et al.Circulating cell adhesion molecules are correlated with ultrasound-based assessment of carotid atherosclerosis[J].Arterioscler Thromb Vasc Biol,1998,18:1765-1770.
[10] Sahiel AR,Kahn CR.Insulin signaling and the regulation of glucose and lipid metabolism [J]. Nature,2011,414:799-806.
[11] Artwohl M, Lindenmair A, Sexl V,et al. Different mechanisms of saturated versus polyunsaturated FFA-induced apoptosis in human endothelial cells[J]. Lipid Res,2008,9:2627-2641.
[12] Pilz, S, Scharnagl H, Tiran B, et al. Free fatty acids are independently associated with all-cause and cardiovascular mortality in subjects with coronary artery disease[J]. J Clin Endocrinol Metab,2006,91:2542-2547.
[13] Staiger, K, Staiger H, Weigert C, et al.Saturated, but not unsaturated, fatty acids induce apoptosis of human coronary artery endothelial cells via nuclear factor-kB activation[J]. Diabetes,2006,55:3121-3126.
[14] Klumpp,Krieglstein J. Unsaturated fatty acids isolated from human lipoproteins activate protein phosphatase type 2Cb eta and induce apoptosis in endothelial cells[J]. Atherosclerosis,2005,180:245-254.
