新疆维吾尔族宫颈癌组织中HPV-DNA表达及存在状态的研究
2014-07-13高冬梅张媛媛古扎丽努尔阿不力孜
高冬梅, 龙 梅, 张 璐, 张媛媛, 古扎丽努尔·阿不力孜
(新疆医科大学1附属肿瘤医院妇科, 乌鲁木齐 830011; 2第一附属医院妇科·生殖中心, 乌鲁木齐 830054)
宫颈癌是女性最常见的恶性肿瘤之一,我国每年新发病例约10万例,局部地区的发病率和死亡率有增长趋势,其死亡率在女性恶性肿瘤中居第2位,且呈现患病年轻化趋势[1]。子宫颈癌一直是新疆地区发病率居首位的妇女恶性肿瘤,尤其维吾尔族妇女子宫颈癌比例明显高于其他民族,且发病年龄早,平均年龄为45.04岁,宫颈癌是维吾尔族妇女死亡的主要原因之一[2]。有关研究显示,宫颈癌在新疆入院治疗的恶性肿瘤患者所占的比例达20%,而维吾尔族妇女所占的比例达75%以上,其中早期患者比例甚少,治疗效果良好,但是中、晚期患者居多,治疗效果差[3]。目前国内外研究已证实高危型人乳头疾瘤病毒(HR-HPV)感染是宫颈癌的主要危险因素,尤其是高危型HR-HPV的持续感染,HPV16型感染占多数[4-6]。许多研究已证实维吾尔族妇女子宫颈癌的发生与HPV16型感染有关,维吾尔族妇女宫颈癌的高危型HPV检出率达90%[7]。Vinokurova等[8]研究认为:与HPV31、33型比较,HPV16、18、45型更常见以整合状态存在,HPV整合是宫颈癌的一个特点。其与癌前病变到侵袭性癌的进展密切相关,其中致癌性最强的的是HPV16、18型[9],然而对于HPV-DNA整合状态与宫颈细胞的恶性转化仍是目前争议的问题。为进一步探讨新疆维吾尔族宫颈癌患者HPV-DNA在宫颈癌组织中的表达及存在状态,本研究选择30例经HC2法检测的高危型HPV阳性的宫颈癌手术切除标本,采用巢式PCR法检测HPV16-DNA的表达,采用多重Taqman探针荧光定量PCR检测HPV16-DNA在组织中的生存状态,现报道如下。
1 材料与方法
1.1材料收集新疆医科大学附属肿瘤医院妇科2012年6月-2013年6月收治的宫颈癌患者经HC2法检测的高危型HPV阳性的宫颈癌手术切除标本30例,离体的新鲜组织标本于术后30 min内放入液氮中-80℃保存备用,所有标本均经病理结果证实,且宫颈癌癌细胞数>80%。取组织前患者均未接受放化疗治疗,收集标本前均征得患者同意。
1.2仪器与主要试剂ABI 7500型荧光定量PCR仪 (Applied Biosystems),组织基因组DNA提取系统(北京天根),Taq DNA Polymerase(Thermo Scientific),dNTP Mix(Thermo Scientific),DL2000 DNA Marker(Takara),梯度PCR仪(Bio-Rad, USA ,MyCycler Thermal Cycler),水平电泳仪(DYCP-31DN及DYY-6C型),核酸蛋白定量仪(北京凯奥k5500)凝胶成像系统(BioDoc-IT Imaging System,UVP,USA),pCR-XL-TOPO-HPV16质粒,TaqMan®Universal PCRMaster Mix(ABI),TaKaRa MiniBEST Plasmid Purification Kit(Takara),HindⅢ(NEB),Thermo Scientific GeneJET Gel Extraction Kit(Thermo)。
1.3DNA提取按DNA提取试剂盒操作提取DNA,核酸蛋白定量仪检测DNA浓度,A260/A280 1.6~2.0为合格,用于后续实验,1%琼脂糖凝胶电泳分析,其正确条带应为150 bp。
1.4HPV16-DNA检出分析将提取的样本DNA,利用巢式PCR检测组织中HPV16-DNA的表达。使用引物GP-E6-3F和GP-E6-5R进行第1轮PCR。反应体系总体积为25 μL:10×Taq Buffer 2.5 μL、25 mM Mg2+2 μL、10 mM dNTP 0.5 μL、5 U/μL的Taq DNA Polymerase 0.15 μL、Primer F(10 mM)(GP-E6-3F)0.5 μL、Primer R(10 mM)(GP-E6-5R) 0.5 μL、模板0.5 μL、ddH2O218.35 μL。PCR的反应条件为:95℃ 5 min,63℃ 30 s,35次循环,72℃ 5 min,反应结束后4℃保存。将上述PCR产物进行1∶100稀释后,进一步使用引物HPV16Fz和HPV16Rz进行第2轮PCR,反应体系总体积为25 μL,反应条件同前,1%琼脂糖凝胶电泳分析,HPV16-DNA正确条带为457 bp。实验所用引物由上海欧易生物工程有限公司合成,其具体序列见表1。

表1 引物序列
1.5HPV16-DNA在宫颈癌组织中的存在状态分析
1.5.1 标准品质粒的制备、提取、纯化 按试剂盒说明进行质粒的制备、提取、纯化。pCR-XL-TOPO-HPV16质粒由新疆大学生命科学与技术学院新疆生物资源基因工程国家重点实验室馈赠。
1.5.2 多重Taqman探针荧光定量PCR反应 将回收的标准品质粒稀释1 000倍后,按1:10倍比稀释,10-1~10-7倍稀释,每个稀释梯度重复2次检测,PCR反应体系总体积50 μL,包括:aqMan Universal PCR Master Mix (2×) 25 μL,HPV16 E2-Forward primer (10 μM) 1 μL,HPV16 E2-Reverse primer (10 μM) 1 μL,HPV16 E2 TaqMan probe(10 μM) 1 μL,HPV16 E6-Forward primer (10 μM) 1 μL,HPV16 E6-Reverse primer (10 μM) 1 μL,PV16 E6 TaqMan probe (10 μM) 1 μL,DNA template 2 μL,RNase-free water 补至50 μL,PCR反应条件为50℃2 min, 95℃ 10 min,95℃ 15 s,60℃ 1 min,40个循环,每个样品设置3个复孔,以E2/E6比值表示HPV16-DNA的存在状态。
1.6统计学分析所有统计学分析均使用SPSS 17.0软件完成。HC2与巢式PCR 2种检测方法对HPV-DNA阳性率的比较采用Kappa检验;比较宫颈癌组织中HPV16-DNA与各类临床病理参数间的关系采用pearson χ2检验或Fisher精确概率法进行统计学检验,以P<0.05为差异有统计学意义。
2 结果
2.1HPV16-DNA在宫颈癌组织中的表达在HC2检测HR-HPV阳性的30例宫颈癌组织中利用巢式PCR检测HPV16-DNA的检出率为96.7%(29/30),说明新疆维吾族宫颈癌患者中HPV感染主要是HPV16亚型感染,见图1。采用巢式PCR与HC2方法检测HPV-DNA的检测结果相一致,符合率为90%,经Kappa检验,P<0.05,见表2。
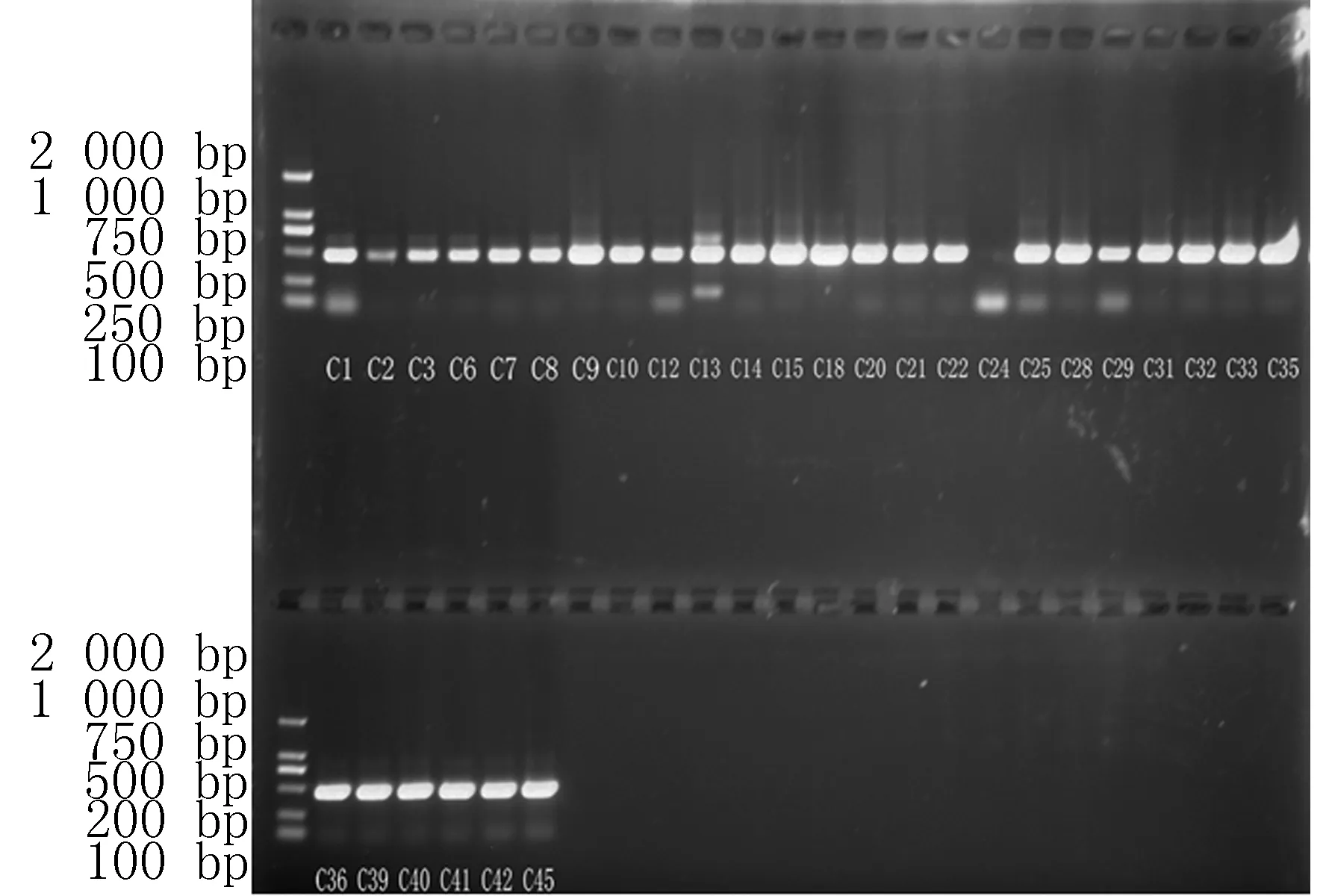
M:DL 2000 marker ,C1~C45为筛选DNA合格的30例宫颈癌组织标本
图1巢式PCR检测宫颈癌组织中的HPV16-DNA电泳图
2.2HPV16-DNA表达与宫颈癌患者临床参数的关系HPV16-DNA的表达水平与宫颈癌患者的年龄、有无淋巴结转移无关(P>0.05), 但其在病理分级高的患者中表达高于病理分级低的患者(P<0.05),在临床分期高的患者中表达高于低分期患者(P<0.05),见表3。
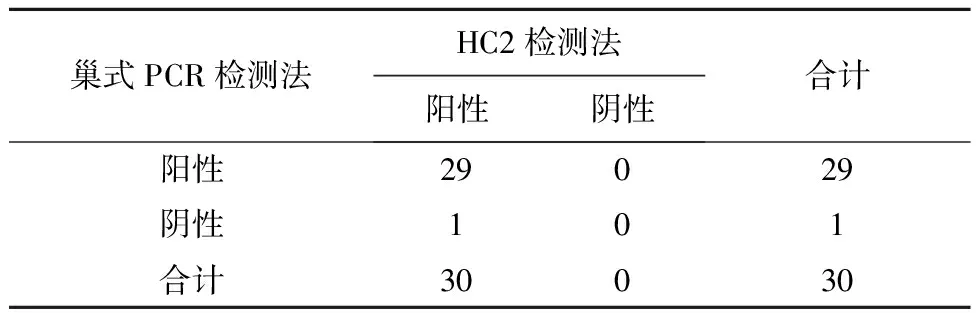
表2 30例宫颈鳞癌HC2与巢式PCR检测结果比较/例
注: Kappa=0.901,P<0.05。
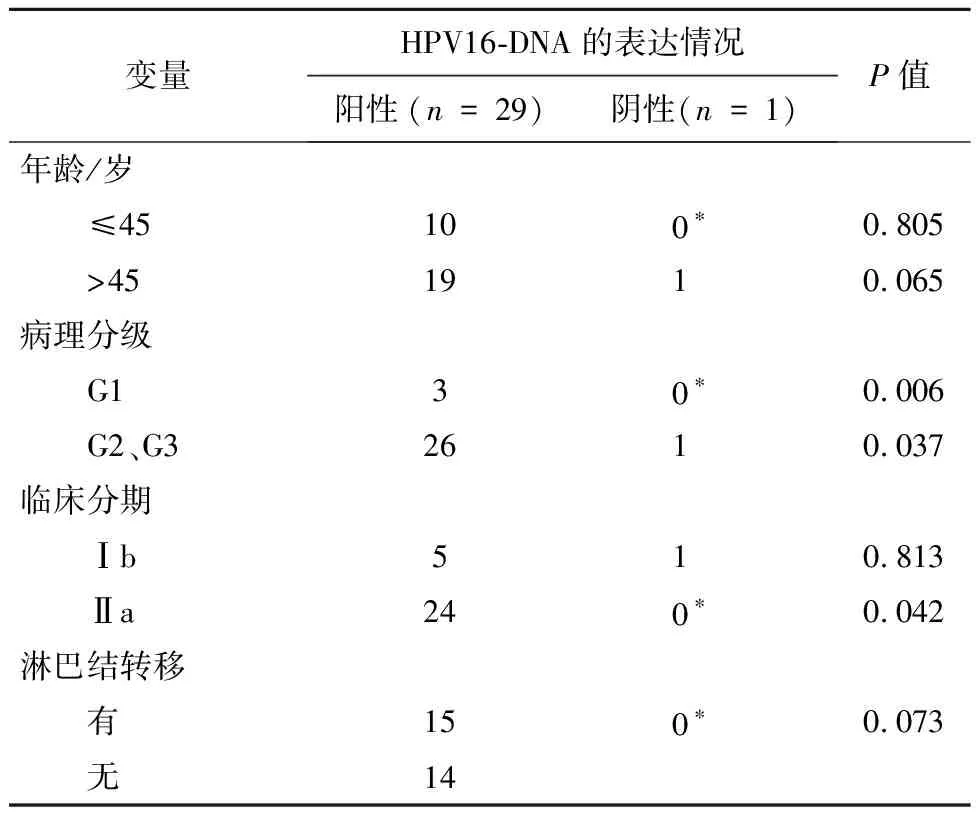
表3 HPV16-DNA的表达与宫颈癌临床参数的关系/例
注:*理论频数<1, Fisher精确概率法计算的结果。
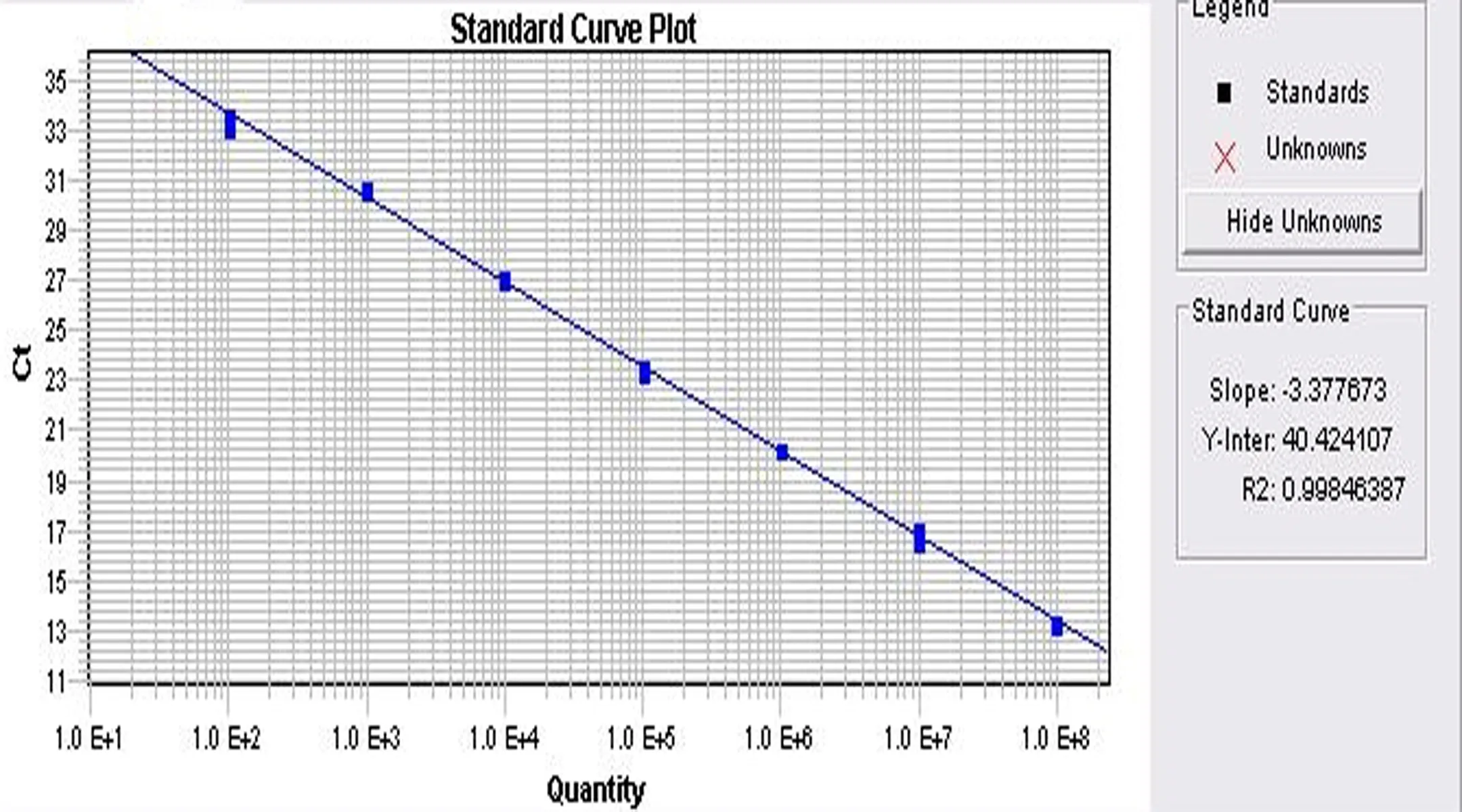
2.3HPV16-DNA在宫颈癌组织中的存在状态分析根据HPV16 E2、E6标准曲线(图2、3),E2、E6的扩增效率分别为97.73%、95.07%,确定其95%的可信区间(0.807 9~1.287 5),故确定HPV16的E2/E6界值为0.81,即E2/E6=0为HPV16整合态;E2/E6≥0.81为HPV16游离态;0 宫颈癌的发生发展是多因素作用的结果,除与病毒的载量、型别、变异等有关以外, 与宿主自身的免疫状态、个体基因的HPV易感性和环境的协同因素也是非常必要的,并且有研究认为HPV的致癌作用与HPV-DNA的整合有关,整合型的HPV可以比较容易地逃逸免疫系统的自我清除的机制,因而可能造成HPV持续感染,改变宿主基因组,使得一些抑癌基因功能丧失,最终导致宫颈细胞的恶性转化[10-11]。 图2 多重taqman探针荧光定量PCR HPV16 E2基因曲线 图3 多重taqman探针荧光定量PCR HPV16 E6基因曲线 本研究通过采用HC2及巢式PCR对30例宫颈癌组织样本进行检测,2种检测方法的检测结果差异无统计学意义(P>0.05)。古扎丽努尔·阿不力孜等[7]对新疆维吾尔族宫颈癌患者中HPV16亚型的分布研究结果显示新疆维吾尔族宫颈癌HPV总阳性率为83.14%,其中HPV16占91.75%,本研究结果显示HPV16-DNA维吾尔族患者宫颈癌组织中的检出率为96.7%(29/30),与文献报道结果一致,且HPV16-DNA的表达水平与宫颈癌的分化程度及临床期别有统计学差异,这也进一步证实HPV16在新疆维吾尔宫颈癌中起了重要作用。多项研究显示宫颈癌中HPV-DNA整合是宫颈癌的一个特点,与病变的进展密切相关[12-13],但是HPV16在汉族宫颈癌人群与维吾尔族患者人群中存在状态是否一致,目前在新疆维吾尔族宫颈癌组织中的存在状态报道很少。郑莹等[14]的研究显示,总整合率为88.9%,其中HPV16 整合态占70.4%,混合态占18.5%,游离态占11.1%。本研究结果显示HPV16总的整合率为89.6%,与其无明显差异,但是不同的是在新疆维吾尔族宫颈癌患者中HPV16 主要以混合态存在(55.2%),单纯整合态仅占34.2%,游离态占10.3%,提示新疆维吾尔族宫颈癌患者与汉族患者HPV16在组织中的存在状态可能存在一定的差异,这对今后新疆宫颈癌的防治工作可能提供一个治疗的方向。因为本研究的样本含量较少,还有待进一步扩大样本含量,以确定两者之间的差异。 参考文献: [1] 李霓, 郑荣寿, 张思维, 等. 2003~2007 年中国宫颈癌发病与死亡分析[J]. 中国肿瘤, 2012, 21(11):801-804. [2] 姜淑清,土送爱,周俊兰,等.南疆策勒县妇女病现状调查与分析[J].中国妇幼保健,2006,21(4):524-526. [3] 夏米西努尔· 阿不力米提,古扎丽努尔·阿不都许库尔,古扎丽努尔·阿不力孜,等.维吾尔族妇女对宫颈癌及HPV感染的认知程度的调查[J].新疆医科大学学报,2009,32(5):522-525. [4] Bhatla N,Dar L,Patro AR,et al.Human papillomavirus type distribution in cervical cancer in Delhi,India[J].Int J Gynecol Pathol,2006,25(4):398-402. [5] Bauer HM, Ault K. Human papillomavirus:current prevalence and future protection[J]. Sex Transm Dis,2006,33(8):509-511. [6] Bratti MC,Rodriguez AC,Schiffman M,et al.Description of a seven-year prospective study of human papillomavirus infection and cervical neoplasia among 10000 women in Guanacaste,Costa Rica[J].Rev Panam Salud Publica,2004,15(2):75-89. [7] 古扎丽努尔·阿不力孜,帕提曼·米吉提,李庭芳,等.HPV各亚型在新疆各地区维吾尔族宫颈癌患者中的分布研究[J].新疆医科大学学报,2009,32(5):513-517. [8] Vinokurova S, Wentzensen N, Kraus I, et al. Type dependent integration frequency of human papillomavirus genomes in cervical lesions[J]. Cancer Res,2008,68:307-313. [9] Khan MJ, Castle PE, Lorincz AT, et al. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice[J]. JNCI, 2005,97:1072-1079. [10] Peter M, Stransky N, Couturier J, et al. Frequent genomic structural alterations at HPV insertion sites in cervical carcinoma[J]. J Pathol,2010,221:320-330. [11] Martina SM, Corina DC, Katrin Beer-Grondke K, et al. Loss of gene function as a consequence of human papillomavirus DNA integration[J]. Int J Cancer,2012,131(5):E593-E602. [12] 李科珍,金 鑫,方 勇,等. HPV16 整合状态与宫颈癌发生的相关性研究[J].中国妇幼保健,2011,26(27):4241-4244. [13] Shuklas,Bharti AC, Mahatas, et al. Application of a multi-plexPCR to cervical cells collected by a paper smear for the simultane-ous detection of all mucosal human papillomaviruses (HPVs) and typing of high-risk HPV types 16 and 18[J]. J Med Microbiol,2010,59:1303. [14] 郑莹,彭芝兰,楼江燕,等.多重实时PCR对宫颈癌组织及Siha细胞株HPV16病毒整合状态的检测[J].癌症,2006,25(3):373-377.3 讨论