中药川贝对哮喘模型小鼠血管生成的影响※
2014-07-12李厚忠张羽飞
李厚忠 张羽飞
中药川贝对哮喘模型小鼠血管生成的影响※
李厚忠1张羽飞2
目的 确定中药川贝对哮喘模型小鼠血管生成的作用及机制。方法建立哮喘模型小鼠并且将小鼠随机分为三组,即模型组(OVA致敏的小鼠)、中药川贝组(中药川贝治疗的小鼠)和PBS组(正常对照组的小鼠),中药川贝组小鼠分别给予中药川贝(9.0g/kg)。对模型小鼠的气道炎症、血管生成、血管内皮生长因子(VEGF)和缺氧诱导因子-1α(HIF-1α)进行研究。结果与哮喘模型组小鼠相比,中药川贝组可以改善过敏性气道炎症,并显著减少血管百分比,也降低VEGF和HIF-1α的表达。血管百分比与VEGF和HIF-1α表达呈正相关,同时VEGF和HIF-1α表达呈正相关。结论结果表明,中药川贝具有重要的抑制哮喘模型小鼠血管生成作用。中药川贝通过抑制VEGF和HIF-1α表达实现抗血管生成活性。
血管生成;哮喘;中药川贝;血管内皮生长因子;缺氧诱导因子-1α
哮喘患者肺组织常伴有新生血管的生成,哮喘患者活组织检查发现,不论血管的数量还是粗细均有所增加,这些改变可引起气道阻塞和(或)气道高反应性,从而加重哮喘[1]。目前治疗哮喘的一般方法是应用糖皮质激素、白三烯受体拮抗药物等[2],由于不良反应严重,患者很难接受,那么寻找安全有效的中药就显得更加重要。中药川贝治疗哮喘安全可靠,可作为首选。
以往有研究表明,血管内皮细胞生长因子(VEGF)在血管生成过程中起核心作用[3]。近年研究发现,VEGF调节血管生成是通过缺氧诱导因子-1α(HIF- 1α)实现的[4],HIF-1α可以调节基因表达响应氧气浓度的变化。在本研究中建立哮喘小鼠模型,通过检测气道炎症、血管百分比以及血管生成与VEGF和HIF-1α的关系,主要评价中药川贝治疗哮喘的分子机制。
1 材料与方法
1.1 试药中药川贝粉的制备:选取整齐、粉性足者。由于川贝忌水洗,为去除药材表面的灰尘,可采用洁净的纱布擦拭药材表面。净选后的川贝通过灭菌消毒窗消毒15min后直接转至粉碎车间,用Fz-400型粉碎机组加工成100目细粉,收得细粉装入洁净的容器中,封口。全部加工完后的细粉用洁净的塑料袋分装成1kg/袋备用。
1.2 实验动物雌性BALB/C小鼠30只,6~8周龄,由哈尔滨医科大学动物实验中心提供,实验动物合格证号为P00102008。
1.3 模型建立健康清洁级 BALB/C小鼠腹腔内注射10%卵蛋白+10%氢氧化铝混合液1m l作为首次致敏,第15天将小鼠依次置于超声雾化器中,用1%卵蛋白生理盐水喷雾激发小鼠哮喘发作,隔日一次,一次 20m in,共激发 28d。以小鼠出现口唇发绀、腹肌痉挛、呼吸加快、点头呼吸或站立不稳等现象表示成功激发。将成功制备的哮喘模型小鼠(20只)随机分为两组(每组10只)。分别为模型组和中药川贝组,另设PBS组(10只以生理盐水代替卵蛋白进行腹腔注射及雾化吸入给药)。分组后每天灌胃给药,模型组和PBS组给予等量生理盐水,中药川贝组给予川贝粉9.0g/kg,每天1次,连续28d。最后1次给药2h后,三组小鼠应用1%巴比妥钠麻醉,取出肺组织保存,待用于组织学检测。
1.4 组织学分析肺组织采用 4%多聚甲醛固定、石蜡包埋、切片、苏木精和伊红染色、数字显微镜扫描。根据组织学评分系统对支气管周围炎症进行评分:①支气管周围无炎细胞;②可见少量炎细胞;③大量炎细胞,但未完全浸润支气管;④1层炎细胞完全浸润支气管;⑤2层炎细胞完全浸润支气管;⑥3层或更多炎细胞完全浸润支气管。使用所有肺组织的支气管除以有炎症的支气管计算平均支气管炎症指数。
1.5 免疫组化法检测VEGF和HIF-1α表达及计算血管百分比肺组织石蜡切片、脱蜡、脱水、浸泡于3% H2O2中15min灭活内源性过氧化物酶。置于煮沸柠檬酸钠中修复抗原,暴露抗原表位并且用3%小牛血清蛋白阻断。切片与血管性血友病因子(vWF)初级抗体孵育。VEGF和HIF-1α分别于4℃过夜,随后与二氨基联苯胺孵育。用均匀结合在内皮细胞表面的 vWF抗体标记血管,所有的后续步骤均在ZSGB-BIO Autostainer进行。随机选定一个 HPF(200×)视野,像场的总面积除以vWF阳性面积即得血管百分比,免疫组化染色支气管上皮细胞用于计算VEGF和HIF-1α表达。
1.6 Western blotting检测VEGF和HIF-1α表达在蛋白酶抑制剂的存在下肺组织匀浆,以获得肺蛋白提取物,用于Western blotting分析,使用bca-100蛋白定量分析试剂盒确定浓度。每组蛋白质等量(30µg)固定SDS聚丙烯酰胺凝胶,然后转移至硝酸纤维素膜,膜在三异丙基乙磺酰缓冲盐水吐温20(25mM Tris pH 7.5,150mM NaCl和0.1% Tween 20)中用5%的脱脂奶粉封闭1h,与原发性抗VEGF抗体或抗-HIF-1抗体4℃过夜孵育,然后与二抗杂交(Dako,1:2000),增强化学发光显示特异性结合,以 β-Actin为内参,X射线扫描,计算机辅助双向光密度计分析光密度,计算VEGF和HIF- 1α表达的相对比例。
1.7 统计分析计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析和 Mann Whitney检验相关数据的分布。VEGF和HIF-1α表达与血管百分比的相关性采用Spearman检验评价。P<0.05为具有统计学意义。
2 结果
2.1 中药川贝改善过敏性气道炎症组织学分析显示,模型组呈典型哮喘病理特征(图1A)。许多炎细胞浸润支气管周围,支气管上皮增厚,与PBS组比较炎症指标明显增强,差异具有统计学意义(P<0.01)。给予中药川贝干预后,气道炎症明显改善,炎细胞减少,支气管上皮增厚范围缩小(图1B),与模型组比较,差异具有统计学意义(P<0.01),见表1。
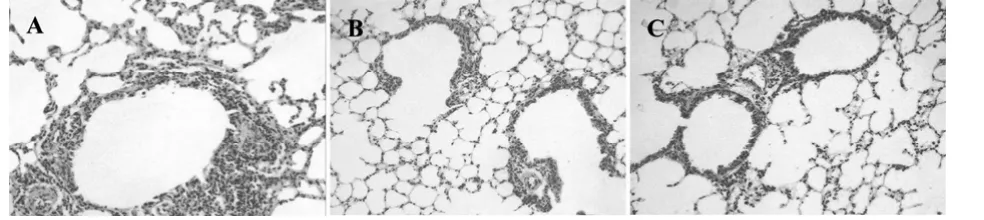
图1 小鼠肺组织组织病理学切片(200×)
表1 三组哮喘模型小鼠血管生成影响的指标情况比较[(±s),n=10]
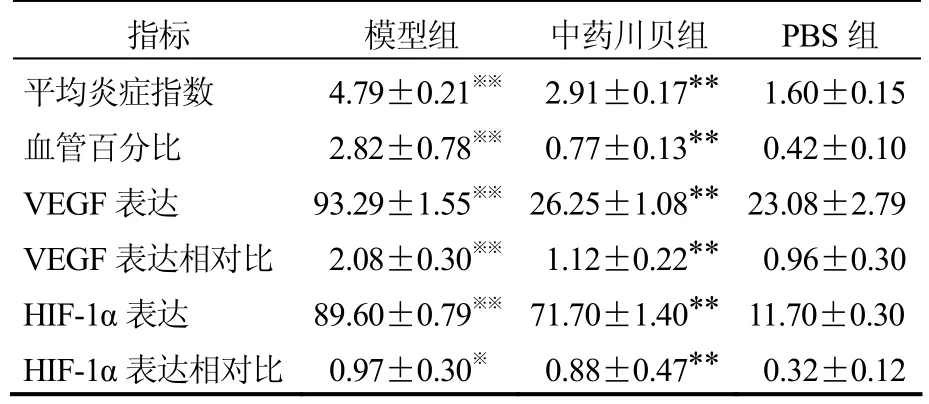
表1 三组哮喘模型小鼠血管生成影响的指标情况比较[(±s),n=10]
注:模型组与PBS组比较**P<0.01;中药川贝组与模型组比较※※P<0.01,※P<0.05
指标 模型组 中药川贝组 PBS组平均炎症指数 4.79±0.21※※ 2.91±0.17** 1.60±0.15血管百分比 2.82±0.78※※ 0.77±0.13** 0.42±0.10 VEGF表达 93.29±1.55※※26.25±1.08** 23.08±2.79 VEGF表达相对比 2.08±0.30※※ 1.12±0.22** 0.96±0.30 HIF-1α表达 89.60±0.79※※71.70±1.40** 11.70±0.30 HIF-1α表达相对比 0.97±0.30※ 0.88±0.47** 0.32±0.12
2.2 中药川贝降低血管生成OVA致敏后,血管生成(图2)。模型组血管百分比明显升高,与PBS组比较,差异具有统计学意义(P<0.01)。给予中药川贝干预后,血管百分比明显降低,与模型组比较,差异具有统计学意义(P<0.01),见表1。
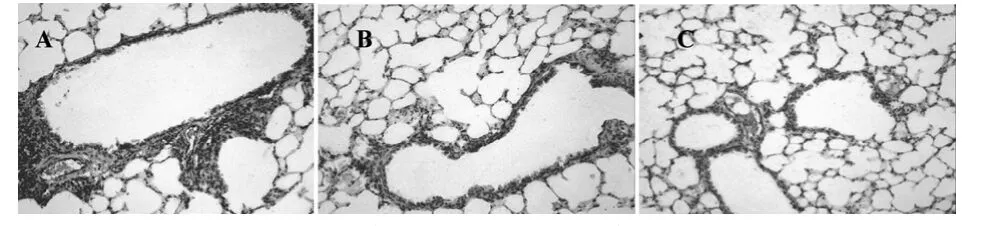
图2 小鼠肺组织vWF阳性血管面积(200×)
2.3 中药川贝降低VEGF表达模型组支气管上皮细胞,肺泡上皮细胞和内皮细胞VEGF表达明显升高,中药川贝干预后,VEGF表达接近PBS组(图3,表1)。Western blotting结果显示,在模型组VEGF表达明显升高,与PBS组比较,差异具有统计学意义(P<0.01);中药川贝干预后,VEGF表达降低,与PBS组比较,差异无统计学意义(P>0.05),见图4和表1。
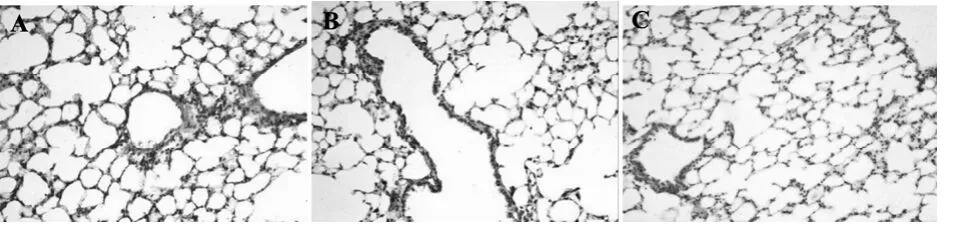
图3 小鼠肺组织VEGF表达(200×)
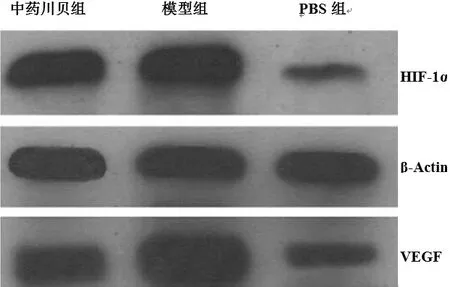
图4 Western blotting结果
2.4 中药川贝降低HIF-1α表达为进一步阐明中药川贝抗血管生成机制,本实验还检测了肺组织HIF-1α表达水平。PBS组仅可见少量HIF-1α阳性细胞,而在模型组肺泡上皮细胞核HIF-1α高表达(图4~5)。Western blotting检测HIF-1α相对比,结果显示模型组HIF-1α表达上调,与PBS组比较,差异具有统计学意义(P<0.01);中药川贝组HIF-1α表达下调,与模型组比较,差异具有统计学意义(P<0.05,表1)。
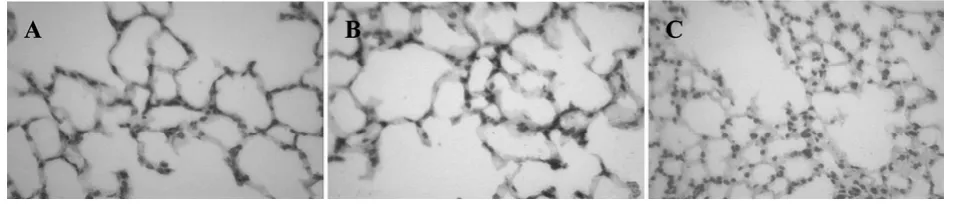
图5 小鼠肺组织HIF-1α表达(400×)
2.5 血管百分比与VEGF和HIF-1α表达相关性 Western blotting结果显示(图4),血管百分比与VEGF(r = 0.693,P<0.01)和HIF-1α(r = 0.785,P<0.01)表达程正相关,因此VEGF和HIF-1α表达呈正相关(r = 0.641,P<0.05)。
3 讨论
为阐明中药川贝抗血管形成机制,本研究检测了平均炎细胞指数和血管百分比。哮喘模型小鼠肺组织可见大量炎细胞浸润支气管周围,同时支气管上皮细胞损伤,炎症是哮喘加重的一个重要因素[5]。炎症效应细胞(肥大细胞、嗜碱性粒细胞、巨噬细胞等)是血管形成的主要诱因,这与哮喘患者血管生成增多相一致[6-8],哮喘模型小鼠血管百分比明显增加。本研究发现,中药川贝不仅可以改善气道炎症,而且还可以减少血管生成,结果证实中药川贝具有抗血管生成作用。
本研究证实了VEGF和HIF-1α表达的关系。近年研究表明,VEGF的激活受HIF-1α调控,哮喘发作时HIF-1α表达增加,从而使VEGF表达上调,最终引起血管生成增加,这与文献结果相一致。
在哮喘模型小鼠还发现支气管上皮细胞,肺泡内皮细胞和血管内皮细胞VEGF表达增加,此结果明确了VEGF表达和血管百分比之间的关系。众所周知,在血管生成过程中,VEGF起核心作用[9]。中药川贝降低降低VEGF表达,抑制内皮细胞增殖和血管生成,最终降低血管百分比,VEGF表达降低可能是中药川贝抗血管生成的机制之一。
终上所述,中药川贝可以减轻气道炎症,降低VEGF和HIF-1α表达,从而抑制哮喘模型小鼠肺组织血管生成,本研究支持中药川贝支持治疗人类哮喘的良好作用。
[1] Detoraki A,Granata F,Staibano S,et al.Angiogenesis and lymphangiogenesis in bronchial asthma[J].Allergy, 2010,65:946-958.
[2] Radwan ZM,Yamamah GA,Shaaban HH,et al.Effect of different monotherapies on serum nitric oxide and pulmonary functions in children with mild persistent asthma[J].Arch Med Sci,2010,6: 919-925.
[3] Baluk P,Lee CG,Link H,et al.Regulated angiogenesis and vascular regression in mice overexpressing vascular endothelial grow th factor in airways[J].Am J Pathol,2004,165:1071-1085.
[4] Lee SY,Kwon S,Kim KH,et al.Expression of vascular endothelial grow th factor and hypoxia-inducible factor in the airway of asthmatic patients[J].Ann A llergy Asthma Immunol,2006,97:94-99.
[5] Fukushima C,Matsuse H,Fukahori S,et al.Aspergillus fumigatus synergis tically enhances mite-induced allergic airway inflamemation[J]. Med Sci Monit,2010,16:197-202.
[6] Hoshino M,Aoike N,Takahashi M,et al.Increased immuneoreactivity of stromal cell-derived factor-1 and angiogenesis in asthma[J].Eur Respir J,2003,21:804-809.
[7] Salvato G.Quantitative and morphological analysis of the vascular bed in bronchial biopsy specimens from asthmatic and nonasthmatic subjects[J].Thorax,2001,56:902-906.
[8] Tanaka H,Yamada G,Saikai T,et al.Increased airway vascularity in new ly diagnosed asthma using a high-magnification bronchovideoscope[J].Am J Respir Crit Care Med,2003,168:1495-1499.
[9] Yuksel H,Kose C,Yilmaz O,et al.Increased expression of tissue vascular endothelial grow th factor and foetal liver kinase-1 receptor in seasonal allergic rhinitis and relevance to asthma component[J]. Clin Exp A llergy,2007,37:1183-1188.
The Effects of Bulbus Fritillariae Cirrhosae on Angiogenesis in a M urine Asthma model
Li Houzhong Zhang Yufei
Ob jec tive The aim of this study is to determ ine the effects and mechanism s of Bulbus Fritillariae Cirrhosae on angiogenesis in a murine asthma mode l.MethodsA m ouse m odel o f asthm a was estab lished and the m ice were random ly divided into three groups,nam ely the m odel group (OVA sensitized m ice),Chinese m edicine group (TCM Chuanbei Chuanbei treated m ice) and group PBS (norm al control group m ice),Chinese m edicine fritillary bu lb group m ice were given traditiona l Chinese m edicine Fritillary (9.0g/kg). Airway inflamm ation, blood vessel formation,vascular endothelial grow th factor on model m ice (VEGF) and hypoxia inducible factor -1α (HIF-1α) stud.Resu ltsAdm inistration o f Bu lbus Fritillariae Cirrhosae am eliorated allergic airway inflamm ation and significantly reduced the percentage vascu larity com pared w ith those in the asthm atic mode l m ice.It a lso reduced the expression of HIF-1α,as we ll as that o f VEGF.Percentage vascularity had positive corre lation w ith both HIF-1α and VEGF expression.Furtherm ore,there is positive re lationship between HIF-1α and VEGF exp ression.Conc lusionThe results demonstrate that Bulbus Fritillariae Cirrhosae has an im portant inhibitoryeffect on angiogenesis in asthma. Inhaled adm inistration o f Bulbus Fritillariae Cirrhosae achieved anti-angiogenic activity through inhibition of HIF-1α and VEGF expression.
Angiogenesis;Bu lbus Fritillariae Cirrhosae;Asthm a;VEGF;HIF-1α
R285.5
A
1673-5846(2014)05-0193-03
1牡丹江医学院药学院,黑龙江牡丹江 157011
2牡丹江医学院医药研究中心,黑龙江牡丹江 157011
牡丹江医学院科学技术研究项目(编号:2010-34)
李厚忠(1979-),黑龙江省哈尔滨市呼兰区人,硕士,主要从事药理学和毒理学研究。
张羽飞(1981-),硕士,主要从事男性生殖研究工作。E-mail:yufeizhang@foxmail.com。
