猪细小病毒SYBR GreenⅠ实时荧光定量PCR方法检测不同接毒条件对病毒增殖效果的影响
2014-07-10刘崇灵刘晓波胡呈才吴海超李润成
刘崇灵,刘晓波,胡呈才,吴海超,李润成
(湖南农业大学动物医学院,湖南长沙410128)
猪细小病毒病,是由猪细小病毒(PPV)引起的一种猪的繁殖障碍病。以怀孕母猪发生产出死胎、畸形胎、木乃伊胎、流产及病弱仔猪为特征,故又称猪繁殖障碍症,此外还引起皮炎和肠炎。病毒于1967年Cartwright和Huck等人首先在不育、流产和死产胎儿中分离到并证实其病原作用[1],其后欧洲、美洲、亚洲、非洲及大洋洲很多国家均有本病的报道,现已遍布全世界。到目前为止,我国在上海、黑龙江、吉林、四川、北京、江苏、湖北、浙江、广西、河北等地也均已分离到猪细小病毒[2~3]。由于猪细小病毒对外界环境的抵抗力很强,可在被污染的猪舍内生存数月之久,所以容易造成长期连续感染,难以清除,为养猪业带来了巨大的损失。
猪细小病毒只能在来源于猪的细胞(包括原代猪肾、猪睾丸细胞核传代系PK-15)和人的某些传代细胞中培养增殖[4]。且如今SYBRGreenⅠ荧光定量PCR方法已成为动物病原检测的重要方法。本研究旨在从不同接毒方式、细胞接种量、病毒感作时间以及接种浓度等方面进行分析比较,并用SYBRGreenⅠ荧光定量PCR方法对病毒滴度进行测定,以期探讨培养病变明显的高滴度PPV病毒,为疫苗生产及大量制备抗原物质提供实验数据。
1 材料
1.1 病毒及细胞
PPV病毒为本实验室鉴定并保存的PPV病毒NADL-2株细胞培养物;ST细胞为本实验室保存。
1.2 主要试剂
DMEM(HighGlucose)培养基以及0.25%Trypsin-EDTA均为为HyClone公司产品,新生犊牛血清为Gibco公司产品,细胞培养板及培养瓶为Corning公司产品,SYBRRPremixExTaqTM荧光定量试剂盒为大连宝生物公司产品,配制双抗用青霉素钠(80万单位)为哈药集团制药总厂产品,配制双抗用硫酸链霉素(100万单位)为瑞阳制药有限公司产品。
2 方法
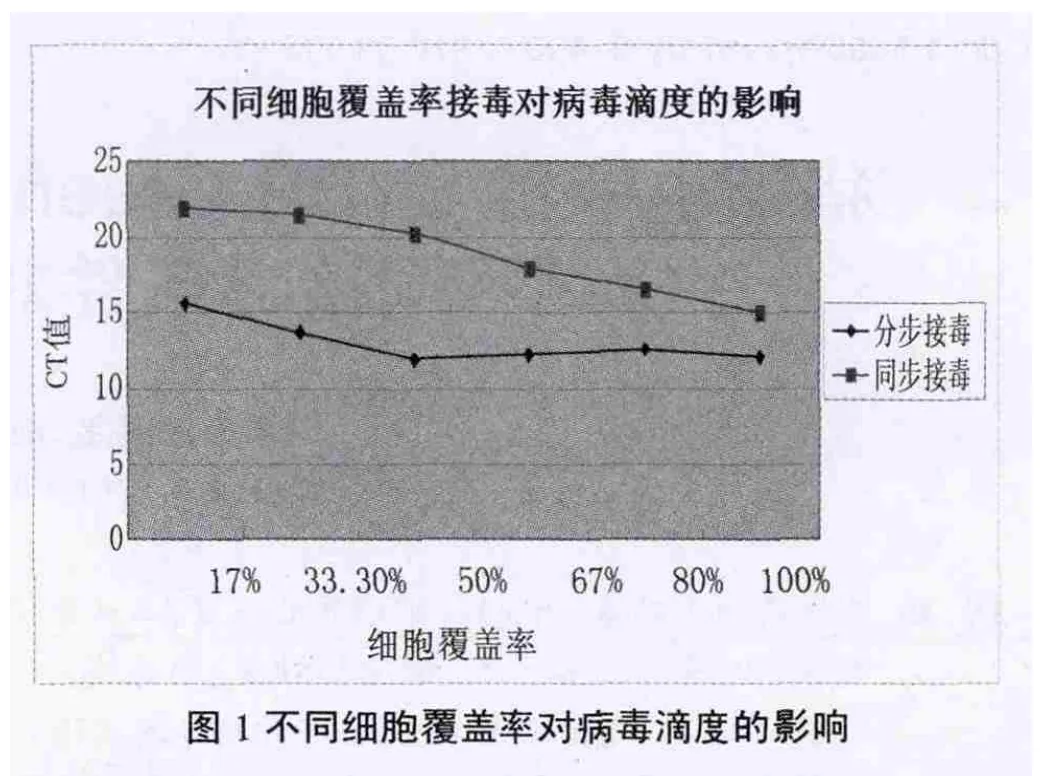
2.1 不同细胞覆盖率对病毒滴度的影响
取一瓶长成单层的ST细胞消化传代并按不同比例稀释至两块六孔板,使得六孔板底铺上覆盖率分别为100%、80%、67%、50%、33.3%、17%的细胞,分别用于同步接毒以及分步接毒。用于同步接毒的细胞板在细胞铺板后同时加入已稀释的病毒,置于37℃恒温细胞培养箱(含5%CO2)感作1h后加入2%血清维持细胞生长;用于分步接毒的细胞板待细胞贴壁后加入已稀释的病毒,置于37℃恒温细胞培养箱(含5%CO2)感作1h,弃去病毒液,补足含2%新生牛血清的DMEM培养基维持细胞生长,培养72h收毒。
2.2 不同接种浓度对病毒滴度的影响
将长成单层的ST细胞消化传代后按相同比例均匀加入六孔板各孔,用不含新生牛血清的DMEM培养基稀释PPV病毒,稀释倍数分别为101、102、103、104,105,将各稀释病毒分别接种各孔细胞,并设平行对照孔以及不加病毒液的对照孔,于37℃感作1h后,弃病毒液,补足含2%新生牛血清的DMEM培养基维持细胞生长,培养72h收毒。
2.3 含不同浓度血清的维持液对病毒滴度的影响
待确定好最适细胞密度及病毒接种浓度后,将长成单层的ST细胞以最适细胞密度消化传代至细胞培养板各孔,用不含血清的培养基稀释病毒,将病毒稀释至最适接种浓度后接种细胞,于37℃感作1h后,弃病毒液,分别补足不含血清、含1%血清、含2%血清的维持液,培养72h收毒。
2.4 不同感作时间对病毒滴度的影响
待确定好最适细胞密度及病毒接种浓度后,将长成单层的ST细胞以最适细胞密度消化传代至细胞培养板各孔,用不含血清的培养基稀释病毒,病毒分别感作30min、1h、2h后,弃病毒液,补足最适血清浓度维持液,培养72h收毒。
2.5 SYBR Green Ⅰ实时荧光定量PCR 鉴定
将上述各实验组在接毒72h后收获病毒细胞培养物,并反复冻融三次,按照大连宝生物公司SYBRGreenⅠ荧光定量PCR试剂盒进行荧光定量PCR,测定各实验组的相对CT值,根据其CT值高低筛选各优化条件。PPV荧光定量检测引物为本实验室设计并合成,引物序列为(5’-3’):上游引 物(PPVfp2)- AACTGAACACGCAAAAGAC TACG-;下游引物(PPVrp1)-TCTCGGCGATC TTCTTACCTCTG。
3 结果与分析
3.1 不同细胞覆盖率对病毒滴度的影响结果
经荧光定量PCR测得相对CT值结果比较,结果显示分步接毒培养的病毒所测CT值均较同步接毒低,表明分步接毒病毒滴度高于同步接毒(见图1);而从细胞覆盖率来看,同步接毒时在细胞覆盖率为100%时接毒,病毒滴度较高,分步接毒时细胞覆盖率在50%以上CT值相差不大,在覆盖率为50%或100%时病毒滴度相对较高(见表1)。
3.2 不同接种浓度对病毒滴度的影响
经荧光定量PCR测得相对CT值,结果显示病毒以103倍稀释接毒测得CT值最低,表明PPV病毒以103倍稀释接毒病毒滴度最高(见表2)。
3.3 含不同浓度血清的维持液对病毒滴度的影响
经荧光定量PCR测得相对CT值,结果显示含2%血清的维持液所测CT值最低,表明维持液中含2%血清时病毒滴度最高(见表3)。
3.4 病毒不同感作时间对病毒滴度的影响




经荧光定量PCR测得相对CT值,结果显示病毒感作2h的实验组所测CT值最低,表明病毒感作2h时病毒滴度最高(见表4)。
4 讨论
培养高滴度的PPV病毒对于大规模生产疫苗抗原来说,应该是在保证疫苗质量的前提下的重要问题,所以筛选最优接毒工艺对于高滴度病毒的培养来说尤为重要,不仅能有利于大规模生产,也节约了成本。目前抗原的检测方式有很多,而荧光定量PCR方法是目前较为准确以及快速的检测病原的方式,其优势在于不仅能定性还能定量,是确定培养高滴度病毒接毒条件的较为准确及快速的检测方法,本实验通过CT值的高低进行相对定量,以筛选出能培养高滴度病毒的接毒工艺。
很多学者也对猪细小病毒的培养以及增殖特性进行了研究[5~6],研究发现猪细小病毒能在多种细胞上繁殖并产生明显病变,且有实验表明PPV在ST细胞增殖不仅病变时间早且毒价高于PK-15细胞一个滴度左右[7]。猪细小病毒虽能自行复制,但能否增殖还取决于细胞的生理状态,它最适于在具有旺盛增殖能力并处在有丝分裂过程中的细胞内增殖[4],因此PPV的接种要求细胞传代时同步接毒,最迟不晚于2/3时接种[8],但也有研究报道PPV在不同细胞系上的增殖情况,表明PK-15细胞生长速度快于ST细胞,所以PK-15细胞依然采用同步接毒而ST细胞采用细胞长成单层时分步接毒[9]。所以本实验采用ST细胞对PPV病毒进行增殖,且实验结果表明分步接毒滴度高于同步接毒,而病毒滴度在分步接毒时细胞覆盖率大于50%时趋于一致,在同步接毒时细胞覆盖率在100%时即单层覆盖时滴度最高,也表明由于ST细胞生长较缓慢,PPV可以在细胞长至单层时接种ST细胞。
本实验通过对不同接毒方式、不同细胞覆盖率、不同接种浓度、病毒感作时间、维持液血清浓度等方面进行了分析及筛选,确定了将PPV以103倍稀释分步接毒单层ST细胞,于37℃感作2h,弃病毒液后加入含2%新生牛血清的维持液的一套较好的培养高滴度病毒的接毒工艺,为大规模生产疫苗抗原提供实验数据基础。
[1]Cartwright S F, Huck R A. Virus isolation is associated with herd infertility, abortion and stillbirth in pigs[J].Vet Rec, 1967, 81:196-197.
[2]李英霞,李长宏,朱琪等.黑龙江省猪细小病毒感染的流行病学调查[J].中国兽医杂志,2001,37(1):22.
[3]杨待建, 金升藻. 湖北省猪细小病毒病流行的调查[J].中国预防兽医学报, 1999, 21(5): 386-389.
[4]殷震,刘景华.动物病毒学[M]第2 版,北京:科学出版社,1997:1145-1151.
[5]白同臣,曲海波,吴金,等.影响猪肾细胞生长及猪细小病毒增殖的因素浅探[J].中国兽医杂志,2008,44(5):69-70.
[6]张磊, 程磊, 丁静静, 等. 猪细小病毒在F81 细胞和PK15 细胞增殖的研究[J]. 畜牧与兽医, 2012, 44(003):59-61.
[7]庄金秋. 猪细小病毒在不同组织细胞上增殖特性的研究[J]. 现代畜牧兽医, 2005 (7): 47-48.
[8]殷华平, 郭万柱, 徐志文, 等. 猪细小病毒( PP V ) S C1 株的分离鉴定[J].黑龙江畜牧兽医,2006,(7):63-65.
[9]倪娇, 赵建增, 刘长辉, 等. 猪细小病毒在PK15 细胞中增殖规律的研究[J].中国兽药杂志,2009,43(1):21-24.
