茄子的非可食部分糖苷生物碱的分布
2014-07-08刘艳芳
刘艳芳
(阜阳职业技术学院生化工程学院,安徽阜阳236031)
茄子的非可食部分糖苷生物碱的分布
刘艳芳
(阜阳职业技术学院生化工程学院,安徽阜阳236031)
采用高效液相色谱法对茄子的根、茎、叶、蒂中糖苷生物碱的种类和含量进行了分析,结果表明,茄子的这4个非可食部分均含有α-茄碱、α-卡茄碱、α-澳洲茄碱3种糖苷生物碱,且各部位中各种糖苷生物碱的含量差异有统计学意义(P<0.05),其中α-茄碱的含量分布情况为:蒂>叶>根>茎,α-卡茄碱的含量分布情况为:根>茎>叶>蒂,α-澳洲茄碱含量分布情况为:根>茎>蒂>叶,糖苷生物碱总含量分布情况为:蒂>根>叶>茎。此研究可为茄子的非可食部分的综合开发及利用奠定基础。
茄子;高效液相色谱;糖苷生物碱
0 引言
茄(Solanum melongena L.)常称茄子,吴越人沿用宋代的叫法称为落苏,广东人称为矮瓜,是茄科茄属一年生草本植物[1],热带为多年生。其结出的果实可食用,颜色多为紫色或紫黑色,也有淡绿色或白色品种,形状有圆形、椭圆、梨形等,是一种典型的蔬菜,因其颜色鲜艳,价格低廉,取材容易[2],深受人们喜爱,在我国广泛栽培。《滇南本草》记载,茄子能散血、消肿、宽肠;《本草纲目》介绍,将带蒂的茄子焙干,研成细末,用酒调服治疗肠风下血;民间亦有用茄子秧熬水,可治疗冻疮的偏方;现代医学认为,茄子具有清热止血,消肿止痛、降血脂、降血压、防治胃癌、抗衰老等多种功效。可见茄子全身是宝,具有一定的药用价值及生理功效。研究发现:茄子体内含有糖苷生物碱[3],这类化合物是植物体内的一类次生代谢产物,具有多种生理功效[4]。我国是茄子种植面积最广的国家,而实际生活中,除果实部位得到有效利用外,茄子秧等非可食部分往往作为废品处理,造成极大浪费。目前对糖苷生物碱的研究多见于茄科植物番茄、马铃薯、龙葵等,而茄子中糖苷生物碱的研究报道较少,尤其是茄子的非可食部分的糖苷生物碱的研究未见报道。本文着重对茄子的非可食部分的糖苷生物碱含量分布进行比较,为合理开发、利用茄资源,提高茄的工业附加值提供科学依据。
1 材料与方法
1.1实验材料
干燥的茄根、茄茎、茄叶、茄蒂待测样品。2012年08月取样于安徽阜阳颍州区民强蔬菜生产经营合作社,品种为苏崎一号,将收集到的非可食部分的样品在60℃烘干,用高速粉碎机粉碎,过50目筛(孔径0.28 mm),装入PVC/PE复合膜,贮于干燥器内备用[5]。
α-茄碱、α-卡茄碱、α-澳洲茄碱标准品购于美国Sigma公司。
乙腈、甲醇为色谱纯,其余试剂均为分析纯。
1.2 实验设备
日立L-2000高效液相色谱仪,日立公司;BLH8-SN02高速粉碎机,北京西化仪;HD3100超声清洗器,德国Bandelin;RE5203旋转蒸发仪,上海比朗;酸度计,上海精科。
1.3 实验方法
1.3.1茄根、茎、叶、蒂样品溶液的制备取茄根、茎、叶、蒂干燥样品各10 g,分别用300 m L的80%甲醇溶解,40℃超声提取40min,抽滤,滤液浓缩成浸膏;用少量2%HCl溶液溶解浸膏,加入1%HCl调节pH至2~3,过滤后用15m L氯仿萃取2次,弃去有机层;水相用0.5%的NaOH调节pH至11,100m L氯仿分3次萃取,合并萃取液,在旋转蒸发仪上蒸干;用10mL甲醇溶液溶解瓶壁残留物,40℃超声洗脱40m in备用[6-8]。
1.3.2样品中生物碱的沉淀反应准备20支试管,每5支为一组,4组分别加入茄根、茄茎、茄叶、茄蒂4种样品溶液,每支1m L,再在每组的5支试管中分别滴加碘-碘化钾试剂、碘化铋钾试剂、硅钨酸试剂、甲醛-浓硫酸试剂、三氯化锑试剂各一滴,仔细观察各试管现象。
1.3.3方法学考察
(1)色谱条件[9-10]
色谱柱:C18柱(5μm,200 nm×4.6mm);柱温25℃;进样量20μL;流速:0.8m L/m in;检测波长:280 nm;流动相:A为乙腈,B为pH=7.40 Tris-HCl缓冲液,梯度洗脱,40m in内,从21%A到25%A。
(2)α-茄碱、α-卡茄碱、α-澳洲茄碱标准曲线的制备
分别称取α-茄碱、α-卡茄碱、α-澳洲茄碱标准品适量,用甲醇溶解,制成每1mL含α-茄碱3 mg、α-卡茄碱1 mg、α-澳洲茄碱1 mg的混合标准品母液。分别吸取标准品母液50、100、200、400、800、1 600μL于10m L的容量瓶中,用甲醇定容至刻度。色谱条件下,各移取20μL注入液相色谱仪进行测定。以标准品浓度为横坐标,峰高为纵坐标,绘制标准曲线,计算回归方程。
(3)精密度试验
取混合标准品母液1m L定容至10m L的容量瓶中,制成稀释液,连续进样5次进行高效液相色谱法测定,每次取稀释液20μL,记录峰高。
(4)稳定性试验
取混合标准品母液1m L定容至10m L的容量瓶中,制成稀释液,分别取稀释液20μL,于0、3、6、12、24、48 h进行高效液相色谱测定,记录峰高。
(5)重复性试验
取茄根干燥样品5份,分别按上述样品溶液的制备方法制备,取制备液20μL,进行高效液相色谱测定,记录峰高。本试验以干燥的茄根做重复性实验,茄茎、叶、蒂亦可用做重复性实验,方法雷同。
(6)加标回收试验
准确称量0.5 g茄根干燥样品,定量加入每1mL含α-茄碱3mg、α-卡茄碱1mg、α-澳洲茄碱1 mg的混合标准品母液,按照1.3.1中样品处理方法制备待测溶液,用高效液相色谱仪进行测定,重复做5次,计算回收率。
1.3.4样品含量的测定准确吸取茄根、茎、叶、蒂样品溶液适当稀释后,吸取20μL进高效液相色谱仪测定。
1.3.5数理统计分析实验数据采用EXCEL进行预处理后,经SPSS 21.0统计软件进行显著性分析。
2 结果与分析
2.1 样品中生物碱的沉淀反应[11-12]
经碘-碘化钾、碘化铋钾、硅钨酸、甲醛-浓硫酸、三氯化锑5种试剂鉴定,茄根、茎、叶、蒂样品溶液遇碘-碘化钾试剂产生棕红色浑浊、遇碘化铋钾试剂产生较多的橘红色沉淀、遇硅钨酸试剂产生灰白色无定型沉淀,可说明茄子的非可食部分含有生物碱类物质;遇甲醛-浓硫酸试剂呈现紫红色、遇三氯化锑试剂呈现淡黄色荧光,可说明茄子的非可食部分生物碱主要为甾体糖苷生物碱。
2.2 方法学考察[13-15]
2.2.1标准曲线线性关系以进样浓度(μg/m L)为横坐标,峰高为纵坐标,绘制标准曲线,得出回归方程分别为Y茄碱=131 405.197 1X+ 6 554.1667(r=0.999 5);Y卡茄碱=110 157.258 1X+ 1 006.250 0(r=0.999 2);Y澳洲茄碱=55 423.387 1X+ 293.750 0(r=0.999 6)。表明α-茄碱、α-卡茄碱、α-澳洲茄碱浓度分别在:15~480μg/m L、5~160μg/mL、5~160μg/mL范围内线性关系良好。
2.2.2精密度试验混合标准品母液稀释液连续进样5次,进行高效液相色谱法测定,记录峰高。结果表明α-茄碱、α-卡茄碱、α-澳洲茄碱3种糖苷生物碱峰高的RSD值分别为1.06%、0.92%、1.31%,仪器的精密度较高。
2.2.3稳定性试验取混合标准品稀释液各20μL,分别于0、3、6、12、24、48 h进行高效液相色谱测定,记录峰高。计算出α-茄碱、α-卡茄碱、α-澳洲茄碱3种糖苷生物碱峰高的RSD值分别为0.35%、0.84%、1.06%,表明α-茄碱、α-卡茄碱、α-澳洲茄碱溶液在48 h内稳定性良好。2.2.4重复性试验对制备的5份茄根供试品溶液进行高效液相色谱测定,记录峰高。计算得茄根中α-茄碱、α-卡茄碱、α-澳洲茄碱含量的RSD值分别为0.96%、1.32%、1.20%,表明该方法的重复性良好。2.2.5加标回收试验[16-17]加标提取回收率结果见表1。由表1可见,α-茄碱、α-卡茄碱、α-澳洲茄碱加标平均回收率分别为96.41%、98.40%、94.08%,相对标准偏差分别为1.44%、2.60%、2.67%,说明本试验采用的提取方法切实可行,可获得较高的提取率。

表1 加标回收试验结果(n=5)Tab.1 Resu lts of standard recovery test(n=5)
2.3 茄子的非可食部分样品溶液及标准品色谱图
图1为α-茄碱、α-卡茄碱、α-澳洲茄碱标准品色谱图,图2为茄根、茎、叶、蒂待测样品溶液的色谱图。由图1可见,α-茄碱、α-卡茄碱、α-澳洲茄碱出峰时间分别为:8.31、9.65、12.69 min,均能和其他组分的基线完全分离。由图2可见,茄根、茎、叶、蒂4种待测样品溶液中均含有α-茄碱、α-卡茄碱、α-澳洲茄碱3种糖苷生物碱组分,具体含量见表2。
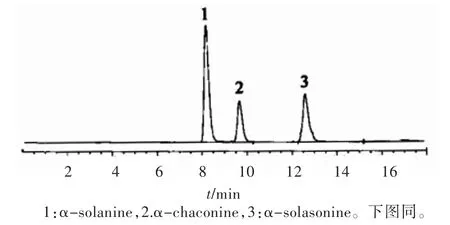
图1 α-茄碱、α-卡茄碱、α-澳洲茄碱标准品液相色谱图(1—α-茄碱、2—α-卡茄碱,3—α-澳洲茄碱)Fig.1 HPLC ch rom atogram s of reference substance of α-solanine,α-chaconine andα-solasonine
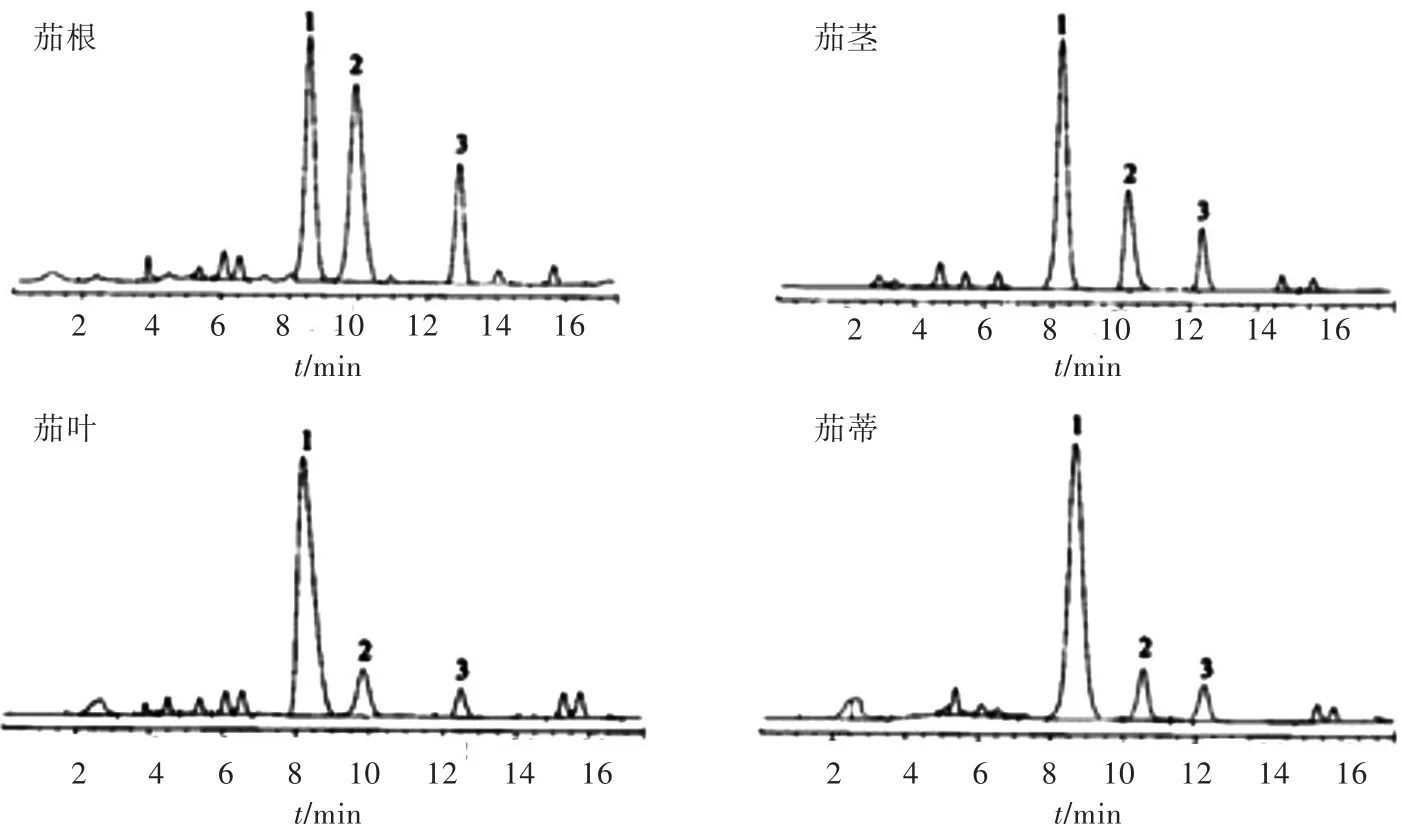
图2 茄根、茎、叶、蒂待测样品溶液液相色谱图Fig.2 HPLC ch rom atogram s of sam p le solu tion of solanum m elongena root,stem,leaves,ped icle
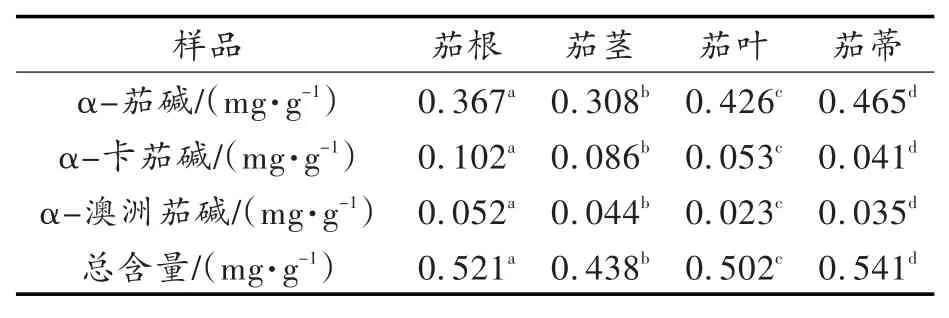
表2 茄子的非可食部分干燥品中α-茄碱、α-卡茄碱、α-澳洲茄碱含量表(n=3)Tab.2 Contentsofα-solanine,α-chaconine and α-solasonine in d ried inedib le parts of solanum m elongena(n=3)
从表2可见茄根、茎、叶、蒂干燥品中均含有α-茄碱、α-卡茄碱、α-澳洲茄碱3种糖苷生物碱,其中α-茄碱的含量分布情况为:蒂>叶>根>茎,α-卡茄碱的含量分布情况为:根>茎>叶>蒂,α-澳洲茄碱含量分布情况为:根>茎>蒂>叶,糖苷生物碱总含量情况为:蒂>根>叶>茎。
3 结论
本试验通过采用高效液相色谱法对茄子的根、茎、叶、蒂的分析表明,这4个非可食部分均同时含有α-茄碱、α-卡茄碱、α-澳洲茄碱3种糖苷生物碱,组成成分相似,且各部位各种糖苷生物碱的含量差异显著(P<0.05),α-茄碱在茄蒂中含量最高,α-卡茄碱及α-澳洲茄碱在茄根中含量最高。茄子的4个非可食部分糖苷生物碱总量分布顺序为:茄蒂>茄根>茄叶>茄茎。这些结果的获得为系统研究茄子的生理活性及药用价值提供科学依据,也为茄子的非可食部分的变废为宝、合理综合开发及利用奠定基础。
[1]董丽花,闫超.茄子皮色素的最佳提取工艺和稳定性研究[J].中国调味品,2008,33(12):80-83.
[2]王川.茄子紫色素的提取工艺及稳定性研究[J].食品科学,2007,28(1):118-120.
[3]李志文,周宝利,刘翔,等.茄科植物体内糖苷生物碱的生理生态活性研究进展[J].上海农业学报,2011,27(3):129-134.
[4]陈静,王志敏,汤青林,等.茄子的药用价值及机理研究进展[J].长江蔬菜,2011(8):1-3.
[5]马英姿,胡忠红,杨波华,等.蚬壳花椒营养器官解剖结构及其生物碱分布[J].湖南农业大学学报:自然科学版,2009,35(3):242-244.
[6]刘林凤,高宝益,高淑红,等.高效液相色谱法测定龙葵中澳洲茄碱与澳洲茄边碱含量的研究[J].世界中西医结合杂志,2013,8(2):144-146.
[7]曹艳萍,薛成虎,李霄,等.正交试验优选马铃薯糖苷生物碱提取工艺[J].榆林学院学报,2011,21(6):6-8。
[8]周永刚,刘畅,毛飞,等.荷叶化学成分的HPLC-TOF/ MS分析[J].药学实践杂志,2011,29(5):342-346.
[9]季彦林,王旺田,王蒂,等.不同光质对马铃薯块茎糖苷生物碱积累的诱导效应[J].江苏农业学报,2010,26(1):40-45.
[10]周宝利,李志文,丁昱文,等.茄子(Solanum melonge⁃na L.)根系糖苷生物碱对5种蔬菜作物的化感效应及相关分析[J].生态环境学报,2009,18(1):310-316.
[11]何康,王进喜,杜江,等.高速逆流色谱法分离鉴定苗药三两银中的甾体生物碱[J].中国实验方剂学杂志,2013,19(11):137-139.
[12]吴卫中,田晶,屠鹏飞,等.太白米的甾体生物碱类成分研究[J].中草药,2000,31(3):167-169.
[13]刘建华,杨海军,张宁,等.RP-HPLC同时测定中药苦黄注射剂中4种生物碱的含量[J].云南中医中药杂志,2011,32(11):76-77.
[14]罗猛,付玉杰,祖元刚,等.反相高效液相色谱法快速测定长春花中4种生物碱[J].分析化学,2005,33(1):87-89.
[15]玄玉实.高效制备色谱法分离制备菱角壳中生物碱的研究[D].长春:东北师范大学,2005.
[16]王道武,庞雪,赵全成,等.黄连生物碱的反相高效液相-电喷雾离子阱串联质谱的研究[J].分子科学学报,2011,27(3):189-193.
[17]朱云霞,侯卫,李明,等.福建三尖杉中生物碱的高效液相分离与鉴定[J].复旦学报:自然科学版,2004,43(6):1124-1128.
Distribution of G lycosidic A lkaloid in Non-eating Section of Solanum M elongena
LIU Yan-fang
(Schoolof Biochemical Engineering,Fuyang Vocationaland Technical College,Fuyang 236031,Anhui,China)
Adopts high performance liquid chromatography to analyse the kinds and content of glycosidic alkaloid in root,stem,leaves,pedicle in eggplant,the results show that the 4 non-eating section of eggplantall contain 3 glycosidic alkaloid which areα-solanine,α-chaconine andα-sola⁃sonine,the contentof each glycosidic alkaloid in each place is statistical significance(P<0.05),the content distribution ofα-solanine is pedicle>leaves>root>stem,α-chaconine is root>stem>leaves>pedicle,α-solasonine is root>stem>pedicle>leaves,the total content of glycosidic alkaloid is pedi⁃cle>root>leaves>stem.The research lays a foundation for overall development and utilization of non-eating partofeggplant.
eggplant;high performance liquid chromatography;glycoalkaloid
R284.1
A
1673-0143(2014)01-0059-05
(责任编辑:叶冰)
2013-11-01
校级科研项目(2011JKYXM06);安徽自然科学基金项目(KJ2013Z051)
刘艳芳(1980—),女,讲师,硕士,研究方向:食品科学及天然产物化学。
