莫氏兰根总黄酮提取工艺优选及体外抗氧化活性研究
2014-07-07董力玮翟富荣纪明慧陈光英孙崇格黄筱娟王友志
董力玮,翟富荣,纪明慧*,陈光英,孙崇格,黄筱娟,王友志
(1.海南师范大学省部共建热带药用植物化学教育部重点实验室,海南海口571158;2.三亚柏盈热带兰花产业有限公司,海南三亚572000)
莫氏兰根总黄酮提取工艺优选及体外抗氧化活性研究
董力玮1,翟富荣1,纪明慧1*,陈光英1,孙崇格2,黄筱娟1,王友志1
(1.海南师范大学省部共建热带药用植物化学教育部重点实验室,海南海口571158;2.三亚柏盈热带兰花产业有限公司,海南三亚572000)
研究莫氏兰根中总黄酮的提取工艺及提取物抗氧化活性.以总黄酮得率为评价指标,以正交实验优选总黄酮提取的最佳工艺;考察莫氏兰根微波提取物的抗氧化活性.实验结果表明,莫氏兰根中总黄酮最佳提取工艺为:φ(EtOH)=75%、m(莫氏兰根)∶V(EtOH)=1∶50、温度60℃、时间40 min、微波功率700 W,总黄酮得率可达1.99%.其提取物对DPPH自由基和羟基自由基的抑制浓度(IC50)分别为58.2 μg/mL和181.4 μg/mL.
莫氏兰根;总黄酮;抗氧化
莫氏兰(Mokara)是1969年由新加坡人用万代兰、鸟舌兰、蜘蛛兰三个属杂交出来的新型兰花[1-4],是一类长势强健,具有茂盛的气生根,产量高,花枝长,花色艳丽,很适合做切花的兰科植物.在鲜花生产过程中,为了增加花的产量和品质,花农需要对多余的气生根进行定期修剪,从而产生大量的废弃根.由于缺乏对其根的开发利用,大量修剪下来的根作为废弃物丢掉了,造成资源的浪费.研究废弃的莫氏兰根开发利用,解决了莫氏兰产品深加工问题,变废为宝,为延伸海南兰花产业链,提高产品附加值提供了新的思路和途经.莫氏兰是杂交的新型兰花品种,对其组成和功效的研究还少见文献报导.文章采用微波辅助提取法、超声波辅助提取法和加热回流提取法对莫氏兰根总黄酮进行提取,用正交实验考察莫氏兰根总黄酮的最佳提取工艺,并对其提取物进行抗氧化活性研究,为热带莫氏兰的进一步开发和利用提供科学依据.
1 实验部分
1.1 仪器、药品与材料
仪器:TP-214型电子天平(丹佛仪器北京有限公司);TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);RE-52A型旋转蒸发器(上海亚荣生化仪器厂);XO-5200DTS型超声波清洗仪(南京先欧仪器制造有限公司).MAS-I型微波萃取仪(上海新仪微波化学科技有限公司).
药品:芦丁标准品(中国药品生物制品检定所),二苯代苦味肼基自由基(DPPH·,美国Sigma-Aldrich公司生产),无水乙醇、过氧化氢、七水合硫酸亚铁、邻二氮菲、三羟甲基氨基甲烷、抗坏血酸(Vc)等化学试剂均为分析纯.
材料:莫氏兰根,采撷于三亚柏盈热带兰花产业有限公司,自然晾干,粉碎备用.
1.2 实验方法
1.2.1 标准曲线的绘制
用体积分数为60%的乙醇配制浓度为0.2 mg/ mL的芦丁标准品贮备液.从中分别精密量取0.0(空白样)、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 mL标准液置于25 mL容量瓶中,参照文献[5-7]方法,加入1.0 mL 5%NaNO2溶液,摇匀,放置10min,再加入1.0 mL 10%Al(NO3)3溶液,摇匀,放置10min,然后再加10.0 mL 4%NaOH溶液,用60%乙醇定容至刻度,混合均匀,静置15min.得芦丁标准溶液0.008、0.016、0.024、0.032、0.040、0.048、0.056、0.064、0.072、0.08 mg/mL,以试剂空白为参比,进行全波长扫描,溶液在波长510 nm处有最大吸收,因此选择510 nm为测定波长进行实验,以芦丁质量浓度为横坐标,溶液吸光度为纵坐标绘制芦丁质量浓度-吸光度标准曲线,得回归方程.
1.2.2 供试样品溶液的制备
精密称取莫氏兰根干粉1.0 g,加入30 mL的体积分数为85%的乙醇,在水浴温度为40℃,超声功率为144W的条件下,超声回流提取30 min,提取液过滤,取滤液转移至50 mL容量瓶中,加85%的乙醇稀释至刻度,备用.
1 2.3 稳定性试验
移取6份4.0 mL的供试样品贮备液于25 mL容量瓶中,按照1.2.1节的测定方法测定0,2,4,6,8,24 h样品中在波长510 nm处吸光度.
1.2.4 精密度试验
取4.0 mL供试品溶液,按照1.2.1节的测定方法连续测定6次,记录溶液在510 nm处的吸光度.
1.2.5 重现性试验
准备同一批莫氏兰根样品6份,按1.2.1节供试品溶液制备方法提取、测定,记录510 nm处测得的吸光度.
1.2.6 回收率测定
精密吸取7.0 mL已知浓度的样品6份,分别精密加入0.2 mg/mL的芦丁标准品1.0、1.0、2.0、2.0、3.0、3.0 mL于10 mL容量瓶中,以60%乙醇定容至刻度,按1.2.1节方法测定溶液中总黄酮的含量,计算平均回收率和RSD值.
1.2.7 总黄酮测定及得率的计算
将各实验提取液用相应浓度的乙醇定容至50 mL容量瓶中,从中移取5.0 mL提取液于25 mL容量瓶中,其余步骤见1.2.1节,以试剂空白为参比,在510 nm处测吸光度A1;参照文献[5-7]的方法测定相应提取液在510 nm处吸光度A2.其中(A1-A2)为莫氏根中总黄酮参加一系列反应后溶液的吸光度值,由芦丁标准曲线可以计算出提取液中总黄酮质量浓度.由下列公式可算总黄酮的提取得率(%):
总黄酮得率=(提取液中总黄酮质量/莫氏兰根原料质量)*100%
1.2.8 莫氏兰根总黄酮的提取方法
超声波提取法:精密称取莫氏兰根干粉1.0 g,加入30 mL的体积分数为60%的乙醇,在恒温50℃,超声功率为144W的条件下,超声提取相应时间,过滤,滤液转移至50 mL容量瓶中,加60%的乙醇稀释至刻度,备用.
微波提取法:精密称取莫氏兰根干粉1.0 g,加入30 mL的体积分数为60%的乙醇,在恒温50℃,微波功率为600W的条件下,微波提取相应时间,过滤,滤液转移至50 mL容量瓶中,加60%的乙醇稀释至刻度,备用.
回流搅拌法:精密称取莫氏兰根干粉1.0 g,加入30 mL的体积分数为60%的乙醇,在恒温50℃,搅拌回流提取相应时间,过滤,滤液转移至50 mL容量瓶中,加60%的乙醇稀释至刻度,备用.
1.2.9 微波提取法的条件优化
精密称取莫氏兰根干粉1.0 g,以不同体积分数的乙醇溶液为提取溶剂,在确定最佳提取方法后,分别考察料液比、乙醇浓度、提取时间、提取温度、微波提取功率对莫氏兰根总黄酮得率的影响.
并在单因素实验基础上,以料液比、乙醇体积分数、提取时间、提取温度、微波提取功率为考察因素,设计五因素五水平的正交实验,用正交表L25(56)进行实验,以总黄酮得率为考察指标筛选出的最佳工艺条件,因素水平表见表1.

表1 因素水平表Tab.1Level factors
1.2.10 莫氏兰根提取物的抗氧化活性研究
1.2.1 0.1提取物的制备
取100.0 g莫氏兰根粉末于1000 mL圆底烧瓶中,按正交实验确定的总黄酮最佳工艺提取,提取液在80℃下减压蒸馏至浸膏,然后进行冷冻干燥得莫氏兰根提取物20 g.
1.2.1 0.2莫氏兰根提取物清除DPPH自由基实验
分别配制浓度为20、40、60、80、100、120、140 μg/ mL的莫氏兰根提取物溶液,考察其对DPPH自由基的清除作用.样品对DPPH自由基的清除作用,参照文献[7-9]的方法进行测定.
1.2.1 0.3莫氏兰根提取物清除羟自由基实验
分别配制浓度为60、80、100、120、150、200、250、300 μg/mL的莫氏兰根提取物溶液,考察其对·OH清除作用.
样品对Fenton反应产生·OH清除作用,参照文献[7-9]的方法进行测定.
2 结果与讨论
2.1 莫氏兰根总黄酮的提取工艺
2.1.1 芦丁标准曲线测定
在510 nm波长处测定吸光度,以芦丁标准品溶液浓度为横坐标,以吸光度值为纵坐标,进行线性回归,结果芦丁在0.008-0.08 mg/mL范围内线性关系良好.回归方程为:Y=0.03+11.825X,相关系数为0.9998.
2.1.2 稳定性试验
分别于0,2,4,6,8,24 h各取4.0 mL供试品溶液于25 mL容量瓶中,按照1.2.2节方法进行测定,结果表明,各溶液总黄酮含量相对标准偏差为1.02%,表明该方法在24 h内稳定.
2.1.3 精密度试验
取4.0 mL供试品溶液,按照1 2.2节的方法测定吸光度,连续测定6次.测得样品溶液中总黄酮的平均含量为1.46%,RSD为1.58%(n=6),表明该方法精密高.
2.1.4 重现性试验
准备同一批供试样品6份,按供试品溶液制备方法提取、测定,记录510 nm处测吸光度.测得样品溶液中总黄酮的平均含量为1.65%,RSD为1.35%(n=6),表明该方法重现性好.
2.1.5 回收率测定
精密量取7.0 mL已知浓度的样品6份,分别精密加入0.2 mg/mL的芦丁标准品1.0、1.0、2.0、2.0、3.0、3.0 mL置于10 mL容量瓶中,以60%乙醇定容至刻度,按1.2.1节方法测定溶液中总黄酮的含量,结果见表2,计算平均回收率为99.55%,RSD为1.92%,说明实验方法准确度较高,能用于莫氏兰根黄酮的检测.

表2 加标回收率实验结果Tab.2Results of recovery test of standard addition
2.2 不同提取方法的比较
不同提取方法比较,由图1和图2可见,三种提取方法的总黄酮提取率都是随着提取时间的延长逐渐升高,至一定时间达到平衡,表3列出了三种提取方法提取达到平衡时的提取时间和总黄酮得率,超声波法和微波法提取效果明显优于搅拌法,超声波法和微波法提取达到平衡时总黄酮得率比较接近,但微波提取用时较少,且总黄酮得率也较高,故选择微波提取法为最优的提取方法.
2.3 微波提取法单因素实验结果
2.3.1 不同料液比对莫氏兰根总黄酮得率的影响
在提取条件:75%乙醇、提取温度70℃、提取时间60 min,微波功率600W不变的情况下,考察不同料液比1∶30、1∶40、1∶50、1∶60、1∶70、1∶80(mg∶mL)对莫氏兰根总黄酮得率的影响.结果见图3,由图3可以看出,当料液比为1∶30~1∶50(mg∶mL)时,莫氏兰根总黄酮得率随提取溶剂的增加逐渐增加,当料液比为1∶50~1∶80(mg∶mL)时,莫氏兰根总黄酮得率出现下降的趋势,说明当乙醇用量增加时,可以充分地把提莫氏兰根总黄酮提取出来,但过量的乙醇溶液同样把莫氏兰根中其他组分提取出来,从而影响了总黄酮的溶解度,造成提取率下降,因此,本实验选择的适宜物料比为1∶50(mg∶mL).
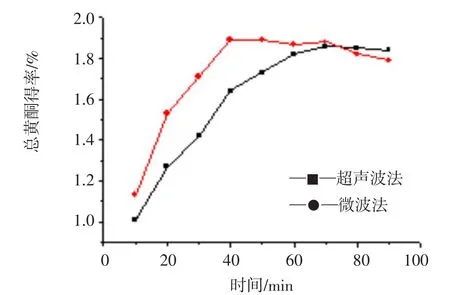
图1 超声波和微波法提取时间对总黄酮得率影响Fig.1The effect of extraction time on the yield of total flavonoids by ultrasonic and microwave
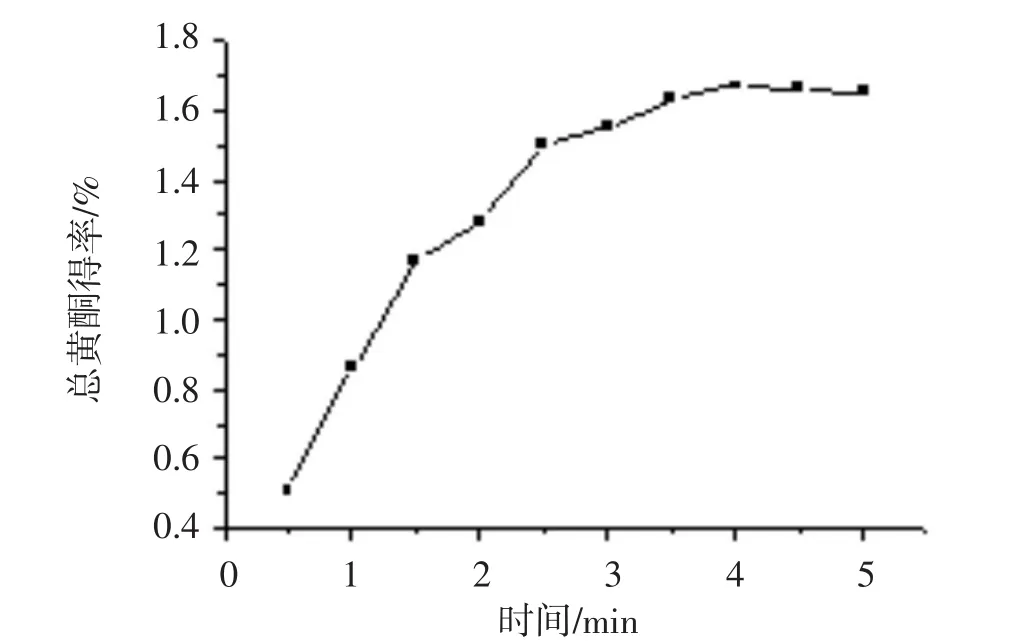
图2 搅拌提取时间对总黄酮得率影响Fig.2The effect of stirring duration on the yield of total flavonoids

表3 不同提取方法提取结果Tab.3The extraction results of different extraction method

图3 不同料液对总黄酮得率影响Fig.3The effect of ratio of sample to solution on the yield of total flavonoids
2.3.2 不同乙醇浓度对莫氏兰根总黄酮得率的影响
在提取条件为料液比1∶50(mg∶mL)、提取温度70℃、提取时间60 min,微波功率600W不变的情况下,考察不同乙醇体积分数为35%、45%、55%、65%、75%、85%、95%的乙醇溶液对莫氏兰根总黄酮得率的影响.结果见图4,由图4可以看出,当乙醇体积分数为为35%~75%,总黄酮得率随乙醇浓度的增加逐渐增加,当乙醇浓度为75%时,总黄酮得率最高.当乙醇浓度为75%~95%时,总黄酮得率随乙醇浓度的增加逐渐下降,说明乙醇浓度对总黄酮提取效果有较大的影响,低浓度的乙醇溶液对莫氏兰根组织细胞的破裂作用效果不理想,总黄酮提取的效果也受到影响,提高乙醇浓度有助于莫氏兰根总黄酮的提取,但乙醇浓度过高,提取液中杂质增加,从而影响了莫氏兰根总黄酮的溶出率,降低了莫氏兰根总黄酮的得率,故适宜的乙醇体积分数为75%.
2.3.3 不同时间对莫氏兰根总黄酮得率的影响
在提取条件为料液比1∶50(mg∶mL)、乙醇体积分数为75%、提取温度70℃、微波功率600W不变的情况下,考察10、20、30、40、50、60、70、80、90 min不同的提取时间对莫氏兰根总黄酮得率的影响.结果见图5.由图5看出,随着提取时间的延长,总黄酮得率逐渐增加,60 min时总黄酮得率最高;时间小于60 min,总黄酮提取不够充分,提取到60 min时,提取基本完成,再延长提取时间,莫氏兰根中其他成分同时被提取出,杂质增多,影响了提取效果.故适宜的提取时间为60 min.

图4 不同乙醇体积分数对总黄酮得率的影响Fig.4The effect of different ethanol volume fraction on the yield of total flavonoids

图6 不同提取温度对总黄酮得率的影响Fig.6The effect of extraction temperature on the yield of total flavonoids
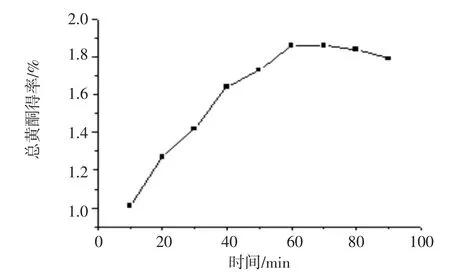
图5 不同提取时间对总黄酮得率的影响Fig.5The effect of extraction duration on the yield of total flavonoids
2.3.4 不同温度对莫氏兰根总黄酮得率的影响
在提取条件为料液比为1∶50(mg∶mL)、乙醇体积分数为75%、提取时间为60 min、超声波功率600W不变的情况下,考察不同的提取温度30、40、50、60、70、80℃对莫氏兰根总黄酮得率的影响.由图6可以看出,30℃时总黄酮得率很低,随着提取温度的升高,总黄酮得率增加,70℃时得率最高;温度低于30℃,莫氏兰根中黄酮溶解度小,提取效果受到影响,因此提取率不高;温度高于70℃时,随着温度的提高,黄酮氧化分解速度加快,总黄酮得率减小.故适宜的提取温度为70℃.
2.3.5 不同提取功率对莫氏兰根总黄酮得率的影响
在提取条件为料液比1∶50(mg∶mL)、乙醇体积分数为75%、提取温度70℃、提取时间60 min、考察微波功率为400、500、600、700、800W时对莫氏兰根总黄酮得率的影响.由图7看出,当微波提取功率为400~700W时,提高微波功率有助于莫氏兰根总黄酮的提取,但当微波提取功率为700~800W时,随着微波功率的提高总黄酮得率呈现出下降趋势,表明增大微波提取功率,提高了莫氏兰根细胞破裂的速度,使黄酮类物质迅速溶入到乙醇溶液中,从而提高了黄酮的提取效果.但当微波提取功率大于700W时,提取液中其他组分含量增加,影响了黄酮类物质的溶出,降低了总黄酮得率.故适宜的微波提取功率为700W.
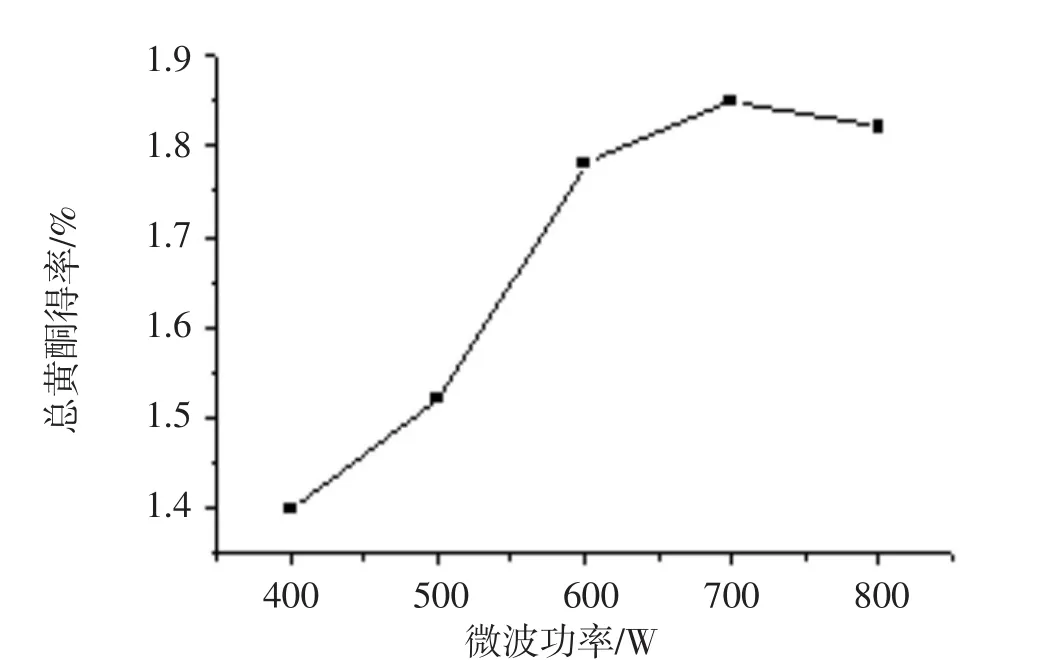
图7 不同微波功率对总黄酮得率的影响Fig.7The effect of Microwave power on the yield of total flavonoids
2.4 微波法提取莫氏兰根总黄酮正交实验结果
在单因素实验基础上,以料液比、乙醇体积分数、提取时间、提取温度、微波提取功率为考察因素,设计五因素五水平的正交实验,用正交表L25(56)进行实验,以总黄酮得率为考察指标筛选出最佳提取工艺条件,结果见表4.
根据表4所列的数据,由直观分析可知,用微波辅助提取莫氏兰根总黄酮,以总黄酮得率为评价指标,通过正交实验优化得到最佳提取工艺条件:乙醇体积分数为75%、料液比为1:50(g/mL)、温度为60℃、时间为40 min、微波功率为700 W,各因素对总黄酮得率影响依次为:料液比>提取时间>微波功率>乙醇浓度>提取温度,即料液比为主要影响因素.在此最佳条件下,取同一批次样品,进行3次验证性实验,测得总黄酮平均得率可达1.99%,RSD为1.02%,表明优化后得到的莫氏兰总黄酮提取工艺稳定可靠,实验重复性好.
2.5 提取物抗氧化活性研究
2.5.1 提取物对DPPH·的清除作用
参照文献[7-9]方法测得不同浓度的莫氏兰根提取物对DPPH·清除结果见表5和图8所示.

表4 微波法提取莫氏兰根总黄酮的结果与分析表Tab.4Results and analysis of ultrasonic assisted extraction of total flavonoids of RM

表5 提取物清除DPPH·的结果Tab.5The result of scavenging DPPH free radical

图8 不同浓度提取物对DPPH·清除率的影响Fig.8The effect of different concentrations onthe activity of scavenging DPPH free radical
从图8可看出:莫氏兰根的微波提取物对DPPH·有一定的清除能力,随着样品浓度的增加,对DPPH·的清除率也增加,有一定的量-效关系.可测出莫氏兰根的微波提取物清除DPPH·的半抑制率(IC50)为58.2 μg/mL,小于Vc(IC50=104.8μg/ mL)[9],因而莫氏兰根的微波提取物对DPPH·的清除能力强于Vc.
2.5.2 提取物对·OH清除作用
参照文献[7-9]方法测得不同浓度的莫氏兰根微波提取物对·OH清除结果,见表6所示.
从实验结果可看出:莫氏兰根的微波提取物对·OH有一定的清除能力,随着浓度的增加,对· OH的清除能力也增强,但达到一定浓度后,清除率的增长趋势随样品浓度增加而变缓.莫氏兰根微波提取物清除·OH的IC50的值为181.4 μg/mL.其IC50的值大于Vc(IC50=104.8 μg/mL),因而其对·OH的清除能力不及Vc好.

表6 提取物清除羟基自由基(·OH)的结果Tab.6The result of scavenging hydroxyl free radical

图9 不同浓度提取物对·OH清除率的影响Fig.9The effect of different concentrations on the activity of scavenging hydroxyl free radical
3 结论
通过实验结果可知,在莫氏兰根总黄酮提取过程中,微波辅助提取法优于超声波提取法和加热回流提取法,总黄酮提取得率达到了1.99%,且用时较少,操作简便,微波辅助提取法为最佳的提取方法,最佳提取条件为:φ(EtOH)=75%、m(莫氏兰根)∶V(EtOH)=1∶50、温度60℃、时间40 min、微波功率700 W.莫氏兰根微波提取物对DPPH·和·OH具有较好的清除活性,清除效果与其质量浓度有一定的量效关系,其IC50分别为58.2 μg/mL、181.4 μg/ mL.因此,莫氏兰根具有较大的开发价值,需要进一步研究.
[1]高锦萍.莫氏兰(Mokara)一种新型兰花在三亚的种植[J].宜春学院学报,2009,31(2):103-104.
[2]谯德惠.莫氏兰有望成为热带兰花新宠[J].中国花卉园艺,2009(21):35-36.
[3]黄少华,丁慎言,张仲伟,等.海南岛热带兰花生产的初步设想[J].热带作物研究,1991(3):26-29.
[4]关丹,熊基粦.大力发展海南热带兰花产业[J].热带农业科学,2003,23(2):46-48.
[5]郑媛媛,李辰,封士兰,等.油橄榄叶中总黄酮含量测定方法探讨[J].光谱学与光谱分析,2011,31(2):547-550.
[6]赵爽,严铭铭,赵大庆,等.小飞蓬总黄酮提取工艺优选及体外抗氧化活性研究[J].中成药,2011,23(2):348-350.
[7]王呈文,纪明慧,舒火明,等.牛大力总黄酮提取工艺及不同萃取物的抗氧化活性研究[J].化学研究与应用,2013, 25(5):713-717.
[8]崔金会,邢荣娥,李荣锋.扇贝边水解蛋白制备及其抗氧化活性测定[J].食品工业科技,2012,33(13):245-249.
[9]王呈文,纪明慧,陈光英,等.热带莫氏兰根提取物的抗氧化活性及稳定性研究[J].食品工业科技,2013,34(5): 209-211.
责任编辑:毕和平
Study on Extraction Process of Total Flavonoids and Antioxidant Activities of Extracts of Mokara Roots
DONG Liwei1,ZHAI Furong1,JI Minghui1*,CHEN Guangying1,SUN Chongge2,HUANG Xiaojuan1,WANG Youzhi1
(1.Key Laboratory of Tropical Medicinal Plant Chemistry of Ministry of Education,Hainan Normal University,Haikou 571158,China;2.Best Goldlines Tropical Orchid Industrial(Sanya)Co.,Ltd,Sanya 572000,China)
The extraction process of total flavonoids and antioxidant activities of extracts of Mokara roots were studied. By using the total yield of flavonoids as an evaluation standard,the optimum extraction conditions about total flavonoids were analyzed by orthogonal experiment;The antioxidant activities of the extraction of Mokara roots were studied by Microwave technology.The optimum extraction conditions of total flavonoids in Mokara roots was as follows:φ(EtOH)= 75%、m(Mokararoots)∶V(EtOH)=1∶50,60℃,40min,700W,the yield of flavonoids up to 1.99%.The median inhibitory concentration(IC50)of scavenging hydroxyl radical and DPPH radical were 58.2μg/mL and 181.4μg/mL,respectively.
Mokara roots;total flavonoids;antioxidant activities
X 784
A
1674-4942(2014)01-0042-07
2013-12-04
海南省重大科研项目(ZDZX20100007);海南省应用技术研究与开发项目(ZDXM20130020)
*通讯作者
