氯吡格雷预处理对脓毒症大鼠心肌损伤保护作用及机制的研究
2014-07-07李妮妮符基定陈威丞温汉春朱继金
李妮妮,符基定,陈威丞,芮 蕾,温汉春,朱继金
(广西医科大学第一附属医院1.心血管研究所;2.急诊科,广西 南宁 530021)
氯吡格雷预处理对脓毒症大鼠心肌损伤保护作用及机制的研究
李妮妮1,符基定1,陈威丞1,芮 蕾2,温汉春2,朱继金2
(广西医科大学第一附属医院1.心血管研究所;2.急诊科,广西 南宁 530021)
目的 探讨氯吡格雷干预对血小板聚集及脓毒症心肌损伤的影响及脓毒症时心肌损伤与血小板的聚集的关系。方法取Wistar雄性大鼠72只,随机分成3组:正常对照组(NC组),内毒素组(ET组),氯吡格雷+内毒素组(CL+ET组)。CL +ET组预先给予氯吡格雷3 d后,腹腔注射LPS(10 mg·kg-1)建立急性脓毒症心肌损伤模型。在0、6、12 h采血检测血小板聚集率、心肌肌钙蛋白I(cTnI);酶联免疫吸附测定法(ELISA)检测血清、心肌中 TNF-α的表达水平;检测心脏干湿重比;取心肌标本,行 HE染色,光镜观察大鼠心肌结构改变。结果 与 NC组相比,注射 LPS后 ET组血小板聚集率更高(P<0.05),且随时间延长而增加[(27.78±1.01)、(32.41±3.04)、(50.99±14.35)ohm];CL+ET组预先给予氯吡格雷处理后,血小板聚集率处于抑制状态(P<0.05)。CL+ET组较 ET组,在相应时点对内毒素诱导的 cTnI、血清及心肌 TNF-α水平升高有明显的抑制作用(P<0.05);心肌干湿重比有差异(P<0.05)。ET组 LPS注射6 h后心肌出现炎症细胞浸润、纤维肿胀、排列紊乱,12 h最显著;与ET组比较,CL+ET组在相应时点对心肌炎症细胞浸润和心肌纤维肿胀程度减轻。结论 LPS引起的心肌损伤过程中血小板聚集明显,氯吡格雷阻断血小板 P2Y12受体,抑制血小板聚集,对 LPS引起的心肌损伤具有一定的抑制作用。
脓毒症;心肌损伤;氯吡格雷;血小板;P2Y12受体
脓毒症(sepsis)是感染、严重创伤、烧伤、外科大手术后常见的并发症,病情进一步发展可导致脓毒性休克、多器官功能障碍综合征(MODS)、甚至死亡;若合并心肌损伤,病死率将显著增加[1]。在脓毒症心肌损伤的发生机制中,炎症反应及其中心介质TNF-α具有重要作用。此外,脓毒症存在炎症系统与凝血系统的交叉反应。脂多糖(lipopolysaccharide,LPS)引起血小板活化后,发生聚集、释放反应和血栓形成,可促进炎症反应进程,加重炎症反应。大量资料表明,脓毒症发病过程中的血小板活化普遍存在[2-3]。然而,通过抑制血小板活化,能否减低脓毒症心肌损伤研究报道较少,值得进一步探讨。本实验通过建立大鼠急性脓毒症心肌损伤模型[4],观察大鼠血小板聚集率、cTnI、血清及心肌组织TNF-α、心肌干湿重比的变化及光镜下 HE染色病理切片形态学改变,旨在研究氯吡格雷是否通过抑制血小板聚集发挥对脓毒症大鼠心肌损伤保护作用。
1 材料和方法
1.1 实验动物及主要仪器试剂 健康 Wistar雄性大鼠72只,体重(220±30)g,由广西医科大学实验动物中心提供,动物许可证号:SCXK桂2009-0002。LPS(Sigma公司,美国,批号:L 2880);氯吡格雷(商品名:波立维,赛诺菲公司,法国,批号:国药准字J20080090);大鼠肿瘤坏死因子 α(TNF-α)Elisa试剂盒(上海瑞齐生物科技有限公司,96T)。血小板聚集仪(全血发光血小板聚集系统,Chrono-Log公司,美国),全自动免疫分析仪(ARCHITECT-i2000SR,雅培公司,美国),荧光相差显微镜成像分析系统(日本OLYMPUS)。
1.2 实验方法及步骤 大鼠适应性饲养 1周,随机均分为3组:即正常对照组(NC组),内毒素组(ET组),氯吡格雷+内毒素组(CL+ET组)。每组再随机分为0、6、12 h 3个观察时间点,每个时间点8只大鼠。ET组和 CL+ET组分别腹腔注射LPS (10 mg·kg-1),建立急性脓毒症心肌损伤大鼠模型[4]。NC组腹腔注射生理盐水1 mL。CL+ET组于 LPS注射前 3 d胃灌注氯吡格雷(200 mg·kg-1·d-1)。3组分别于注射 0、6、12 h取血清及心脏组织送检。
1.2.1 血小板聚集率检测 分别于0、6及12 h用10%水合氯醛对大鼠进行腹腔内注射麻醉,无菌操作下打开腹腔,取腹主动脉内全血2 mL,抗凝,采用全血法检测内毒素注射后不同时间点大鼠的血小板聚集率。
1.2.2 血清cTnI和TNF-α检测 不同时间点大鼠麻醉、开腹后,经腹主静脉下取全血 4 mL,分装 2管,不抗凝。化学发光酶免疫分析法检测 cTnI;另一管进行低温高速离心处理(14 000 r·min-1)15 min,保留上清液,(TNF-α)ELISA试剂盒检测TNF-α表达水平。
1.2.3 光镜标本制作 打开大鼠胸腔,迅速取下心脏,以4℃冰生理盐水洗净,去除大血管及结缔组织,取0.5 cm×0.5 cm×0.5 cm透壁心肌组织置于10%多聚甲醛溶液中固定,石蜡包埋,HE染色,光镜下组织形态学观察。
1.2.4 心肌 TNF-α检测 取 100 mg心肌,以 4℃冰生理盐水洗净,用手术剪将组织剪碎,匀浆器匀浆,3 000 r·min-1离心 15 min,取上清液。根据试剂盒说明操作,(TNF-α)ELISA试剂盒检测TNF-α表达水平。
1.2.5 心肌干湿重比 取左心室用滤纸吸去表面水分,称重,即湿重。80℃烘箱干燥 12 h至恒重后取出称重,即干重。计算心肌干湿重比。心肌干湿重比=干重/湿重。
1.3 统计学分析 采用SPSS 16.0统计软件分析数据。所有计量资料用均数 ±标准差(±s)表示,组间均数比较采用单因素方差分析(One-way ANOVA),两两比较采用 LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠行为表现 NC组大鼠毛发光泽度好、活动力强、刺激反应灵敏。ET组 LPS注射20 min后,大鼠活力减弱、刺激反应减弱;1 h后,出现少动,群居,反应差;3 h后,毛发光泽度减弱、进食减少;12 h部分大鼠出现抽搐现象,对刺激反应弱。CL+ET组灌胃给予氯吡格雷后行为表现与 NC组无差异;LPS注射 6 h后,大鼠活动力减弱、刺激反应减弱;12 h进食减少。
2.2 光镜下心肌纤维改变 NC组:心肌纤维完整,排列整齐,纤维互联呈网状,细胞核清晰,核膜完整,见图1;ET组0 h、CL+ET组0 h、CL+ET组6 h的心肌形态与NC组基本相似;ET组 6 h心肌纤维肿胀,排列整齐度降低,见图2;ET组12 h心肌形态:心肌纤维肿胀,少量溶解,胞质淡染,出现炎症细胞,见图3;CL+ET组12 h心肌形态:心肌纤维稍肿胀,出现炎症细胞,见图4。
表1 不同时间点血清 cTnI水平变化的组间比较(±s,n=8,μg·L-1)
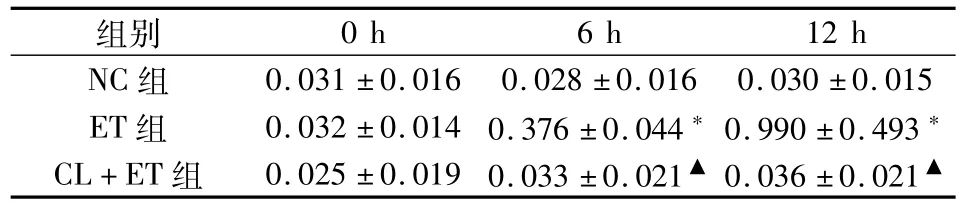
表1 不同时间点血清 cTnI水平变化的组间比较(±s,n=8,μg·L-1)
注:与NC组比较,*P<0.05;CL+ET组与ET组比较,▲P<0.05。
组别0.031±0.016 0.028±0.016 0.030±0.015 ET组 0.032±0.014 0.376±0.044*0.990±0.493*CL+ET组 0.025±0.019 0.033±0.021▲0.036±0.021 0 h 6 h 12 h NC组▲
2.3 各组血清 cTnI比较 0 h:3组 cTnI水平无统计学差异。6 h及12 h:ET组 cTnI水平显著增高于其他两组,差异有统计学意义(P<0.05);而NC组与 CL+ET组 cTnI水平差异无统计学意义(P>0.05)。详见表1。

注:图1 NC组大鼠心肌横纹肌 (HE染色,×400);图2 ET 组6h大鼠心肌横纹肌(HE染色,×400);图3 ET组12 h大鼠心肌横纹肌(HE染色,×400);图4 CL+ET组12 h大鼠心肌横纹肌(HE染色,×400);箭头指向炎症细胞。
2.4 各组大鼠心肌干湿重比较 0 h、6 h:3组心肌干湿重比无统计学差异(P>0.05)。12 h:ET组心肌干湿重比水平低于其他两组,差异有统计学意义(P<0.05);而NC组与CL+ET组心肌干湿重比差异无统计学意义(P>0.05)。详见表2。
表2 不同时间点心肌干湿重比水平变化的组间比较(±s,n=8)

表2 不同时间点心肌干湿重比水平变化的组间比较(±s,n=8)
注:与NC组比较,*P<0.05;CL+ET组与ET组比较,▲P<0.05。
0.218 8±.002 2 0.218 9±.002 2 0.219 3±.002 4 ET组 0.219 3±.001 8 0.218 3±.002 3 0.216 0±.001 5*CL+ET组 0.218 5±.001 4 0.219 0±.002 7 0.218 4±.0011 0 h 6 h 12 h NC组组别▲
表3 不同时间点血小板聚集率变化的组间比较(±s,n=8,ohm)

表3 不同时间点血小板聚集率变化的组间比较(±s,n=8,ohm)
注:与NC组比较,*P<0.05;CL+ET组与ET组比较,▲P<0.05。
27.53±1.56 27.83±2.29 27.28±1.57 ET组 27.78±1.01 32.41±3.04*50.99±14.35*CL+ET组 7.99±1.17*▲10.39±1.71*▲10.51±2.46 0 h 6 h 12 h NC组组别*▲
2.5 各组血小板聚集率比较 0 h的 CL+ET组血小板聚集率明显低于其他两组,差异有统计学意义(P<0.05);而 NC组与 ET组血小板聚集率差异无统计学意义(P>0.05)。6 h、12 h:3组血小板聚集率有统计学差异(P<0.05),且两两比较均有统计学差异(P<0.05)。详见表3。
2.6 各组血清及心肌 TNF-α水平比较 0 h的 3组血清及心肌 TNF-α表达水平无统计学差异(P>0.05)。6 h、12 h:3组血清及心肌 TNF-α表达水平有统计学差异(P<0.05),且两两比较均有统计学差异(P<0.05)。详见表4,5。
表4 不同时间点血清 TNF-α水平变化的组间比较(±s,n=8,ng·L-1)

表4 不同时间点血清 TNF-α水平变化的组间比较(±s,n=8,ng·L-1)
注:与 NC组比较,*P<0.05;CL+ET组与ET组比较,▲P<0.05。
34.47±12.47 37.62±17.60 37.13±11.74 ET组 39.46±17.50 277.97±12.01*449.08±31.28*CL+ET组 31.39±17.23 85.38±9.03*▲138.26±23.14 0 h 6 h 12 h NC组组别*▲
表5 不同时间点心肌 TNF-α水平变化的组间比较(±s,n=8,ng·L-1)

表5 不同时间点心肌 TNF-α水平变化的组间比较(±s,n=8,ng·L-1)
注:与NC组比较,*P<0.05;CL+ET组与ET组比较,▲P<0.05。
29.36±6.64 33.41±5.03 32.22±5.94 ET组 34.53±6.80 164.86±13.09*238.50±23.63*CL+ET组 32.87±7.67 65.07±14.42*▲111.82±7.69 0 h 6 h 12 h NC组组别*▲
3 讨论
脓毒症是指由感染或有高度可疑感染灶引起的全身炎症反应综合征 (SIRS),引起脓毒症最有代表性的毒素为革兰阴性细菌内毒素(主要成分为脂多糖即 LPS)。脓毒症合并心肌损伤常常导致脓毒症休克及多脏器功能衰竭,病情凶险,病死率高。本研究发现:ET组大鼠血清及心肌组织中 TNF-α水平升高,与血清 cTnI升高时间一致,提示 LPS可诱导炎症因子释放,导致炎症细胞浸润,最终引起心肌损伤。氯吡格雷预处理后可降低 TNF-α水平,能抑制心肌组织中炎症细胞的浸润,对 LPS引起的大鼠心肌损伤产生保护作用。
近年来,随着人们对脓毒症机制认识的加深,发现血小板活化在脓毒症炎症易化及进展中起关键作用。本实验结果显示,LPS刺激后ET组血小板聚集率显著升高,并且在相应的时点炎症因子TNF-α及心肌酶cTnI上升明显,心肌组织水肿,提示心肌损伤。国内外研究亦证实活化的血小板导致炎症的扩大。大量研究发现[3],活化的血小板可以诱导中性粒细胞过度活化,产生增强的前炎症因子 TNF-α释放,扩大炎症反应,导致心肌细胞损伤。另外,活化的血小板可以通过 CD40L与 CD40结合,诱导内皮细胞分泌某些细胞因子并表达多种黏附分子,对炎症部位有关填充与渗出的信号途径进行调节[5-6]。活化的血小板还可表达IL-1,胞分泌相关的趋化因子,最终导致白细胞向炎症区域游走[7]。P-选择素(CD 62)在活化的血小板表面表达,它可以作用于白细胞 CD 11b/CD 18(Mac-1)[8-9],促进后者与纤维蛋白原-GPⅡb/Ⅲa接合,增加白细胞与血小板的黏附。
LPS可以刺激 TNF-α、IL-1和 IL-6等炎症因子大量表达[10],引发失控的炎症反应,其中 TNF-α是炎症瀑布级联反应的关键。TNF-α可以通过多种途径损伤心肌:(1)TNF-α诱导心肌细胞程序性死亡;(2)TNF-α激活炎症细胞,使其黏附于心肌细胞和内皮细胞上,导致心肌受损;(3)TNF-α诱导NO产生,造成心肌损伤;(4)TNF-α负性肌力作用[11]。同时,受损的心肌是TNF-α生物合成场所,可以产生大量TNF-α,进一步加重心肌损害。实验结果发现,ET组6 h、12 h心血清和心肌中 TNF-α水平均明显升高,与血清 cTnI升高时间一致。研究资料提示,两者间存在高度相关性[12-13]。因此推断,大量TNF-α产生对心肌产生抑制作用。
本实验发现,氯吡格雷可以降低 LPS处理后血清及心肌升高的炎症因子TNF-α水平,减轻炎症反应。研究表明,血小板的活化程度不足,将难以引发进一步的白细胞活化和炎症因子增多,炎症反应程度减轻[14]。血小板聚集是其活化的重要组成部分,GPⅡb/Ⅲa作为纤维蛋白原受体,介导血小板聚集的最终途径。氯吡格雷是临床上常用的抑制血小板聚集药,其活性代谢产物可以与血小板表面二磷酸腺苷(ADP)受体 P2Y12不可逆地结合,使ADP结合位点大幅度减少,腺苷环化酶被抑制,依赖腺苷酸环化酶的磷酸蛋白的磷酸化加剧,阻碍纤维蛋白原与血小板糖蛋白 GPⅡb/Ⅲa受体结合及继发的ADP介导的糖蛋白 GPⅡb/Ⅲa复合物的活化,进而抑制血小板的聚集,控制血小板活化[15-16]。本实验结果表明,CL+ET组血小板聚集受抑制,在6、12 h的心肌和血清中TNF-α表达水平较ET组低,并且cTnI量亦减少。HE染色病理切片观察到,在相应时点CL+ET组较ET组心肌损伤程度减轻。提示氯吡格雷预处理后,抑制血小板聚集及活化,可以降低脓毒症大鼠心肌组织中炎症因子 TNF-α的水平,能明显抑制心肌组织中炎性细胞的大量浸润,产生心脏保护作用。
综上所述,血小板活化在炎症反应发生、发展中起关键作用,可导致心肌损伤进一步加重。氯吡格雷可以阻断ADP-P2Y12-GPⅡb/Ⅲa信号转导通路,抑制血小板活化,控制炎症反应扩大,减轻心肌损伤。这将为脓毒症的治疗提供重要的指导作用。
[1] Romero-Bermejo FJ,Ruiz-Bailen M,Gil-Cebrian J,et al.Sepsis-induced cardiomyopathy[J].Curr Cardiol Rev,2011,7(3):163-183.
[2] 丁 欢,曹相原,马希刚,等.脓毒症内皮细胞损伤与炎症、凝血相关性研究[J].中华急诊医学杂志,2013,22(5):482-486.
[3] 李金颖,邸顺祥,徐志英,等.小儿脓毒症 CD62P、CD63及CD64分子变化及临床意义探讨[J].中国小儿急救医学,2014,21(1):16-18.
[4] 林 靖,周丽华,陈 欣,等.应激性心肌损伤发病机制的实验研究[J].中国危重病急救医学,2012,24(4):207-210.
[5] Elgueta R,Benson MJ,De Vries VC,et al.Molecular mechanism and function of CD40/CD40L engagement in the immune system [J].Immunolological Reviews,2009,229(1):152-172.
[6] 谭 军,陈建国.类风湿性关节炎患者血清 CD40L及IL-6hs-CRP表达及临床意义[J].重庆医学,2013,42(36):4402-4404.
[7] 杨健鹰,方茂勇,徐周纬,等.血清 IL-1β、IL-6及 IL-10对急性胰腺炎预后判断的研究[J].安徽医药,2013,17(7):1185-1187.
[8] Blann AD,Kuzniatsova N,Lip GY.Vascular and platelet responses to aspirin in patients with coronary artery disease[J].European journal of clinical investigation,2013,43(1):91-99.
[9] Nagy B,Miszti-Blasius K,Kerenyi A,et al.Potential therapeutic targeting of platelet-mediated cellular interactions in atherosclerosis and inflammation[J].Current Medicinal Chemistry,2012,19(4):518-531.
[10]Cheng HW,Lee KC,Cheah KP,et al.Polygonum viviparum L.inhibits the lipopolysaccharide-induced inflammatory response in RAW264.7 macrophages through haem oxygenase-1 induction and activation of the Nrf2 pathway[J].J Sci Food Agric,2013,93 (3):491-497.
[11]蔡 辉,蔡佳玉,张 静,等.丹参酮II A对压力负荷增加的大鼠TNF-α表达的影响[J].安徽医药,2013,17(6):926-928.
[12]Qureshi A,Gurbuz Y,Niazi JH.Biosensors for cardiac biomarkers detection:A review[J].Sensors and Actuators B-Chemical,2012,171:62.
[13]Gilliam LL,Holbrook TC,Ownby CL,et al.Cardiotoxicity,Inflammation,and Immune Response after Rattlesnake Envenomation in the Horse[J].Journal of Veterinary Internal Medicine,2012,26 (6):1457-1463.
[14]Ghasemzadeh M,Hosseini E.Platelet-leukocyte crosstalk:Linking proinflammatory responses to procoagulant state[J].Thrombosis Research,2013,131(3):191-197.
[15]李晓利,范 利,王 强,等.血小板二磷酸腺苷受体H2单体型与阿司匹林抗血小板功能学监测关联的研究[J].中华老年心脑血管病杂志,2014,16(1):25-28.
[16]Gachet C.P2Y(12)receptors in platelets and other hematopoietic and non-hematopoietic cells[J].Purinergic Signal,2012,8(3):609-619.
Myocardial protective effects of clopidogrel preconditioning in septic rats
LI Ni-ni,FU Ji-ding,CHEN Wei-cheng,et al
(Institute of Cardiovascular Diseases,the First Affiliated Hospital,Guangxi Medical University,Nanning 530021,China)
Objective To explore the effect of clopidogrel preconditioning on platelet aggregation and myocardial injury,so as to investigate the relationship of platelet aggregation and myocardial injury in sepsis.Methods Seventy-two Wistar rats were randomly assigned into three groups:normal control group(NC,n=24),endotoxin group(ET,n=24),clopidogrel pretreatment and endotoxin group(CL +ET,n=24).Rats in ET group and CL+ET group were injected intraperitineally with LPS(10 mg·kg-1) to establish an acute cardiac injury model,then continuous intragastric administration of clopidogrel were administered for three days.Each group was observed at three time point(0,6,12 h,n=8).Platelet aggregation was tested with impedance platelet aggregometry;cTnI in blood was determined with che+luminescent technique;the expressions of TNF-α in blood and cardiac myocytes were measured with enzymelinked immunoadsorbent assay(ELISA)kits;myocardial tissues were determined with dry and wet weight;myocardial pathological damage was observed under the light at certain time(0h,6,12h).Results Compared with NC group,platelet aggregation was increased apparently in ET group(P<0.05)and gradually[(27.78±1.01),(32.41±3.04),(50.99±14.35)]ohm;platelet aggregation in CL+ET was lower(P<0.05).Compared with ET group,CL+ET group markedly inhibited the increasement of cTnI,TNF-αin blood and cardiac myocytes(P<0.05);the dry and wet weight of myocardial tissues had difference(P<0.05).The myocardial damage could be observed in 6h ET subgroup by light microscopy:the inflammatory cells were infiltrated,the fibrilla of myocardial cell were swelled,their cristae were disrupted,and the most severe myocardial damage could be observed with time going by.Conclusions Clopidogrel may inhibit platelet aggregation by blocking platelet P2Y12 receptor and then alleviate the LPS myocarditis.
sepsis;myocardial injury;clopidogrel;platelet;P2Y12 receptor
10.3969/j.issn.1009-6469.2014.05.006
:2014-02-20,
2014-03-10)
国家临床重点专科建设项目(卫办医政函[2012]649号);广西壮族自治区卫生厅医药卫生科研课题(No Z2002050)
朱继金,男,教授,硕士生导师,研究方向:高血压与冠心病的发病机理和防治及危重症诊治,E-mail:zhujijin63@vip.sina.com
