一种适合MSAP分析谷物干种子的DNA提取方法
2014-07-05许殊
许殊
重庆工贸职业技术学院生物化学工程系,重庆408000
一种适合MSAP分析谷物干种子的DNA提取方法
许殊
重庆工贸职业技术学院生物化学工程系,重庆408000
甲基化敏感扩增多态性(MSAP)是DNA甲基化的主要研究技术,获得高质量的DNA是MSAP分析的基础。针对玉米Zea mays(L.)等干种子富含多糖、蛋白质且与核酸结合紧密等特点,采用改良的CTAB-SDS法对其基因组总DNA进行提取,对DNA进行质量检测,使用限制性内切酶EoRI和HpaII酶切,进行MSAP分析。结果表明,改良CTAB法可从玉米等干种子中获得纯度高、完整性好的总DNA,其OD260 nm/OD280 nm处于1.86,OD260 nm/OD230大于2.00,产率达1.8 μg/mg,多糖、蛋白质和RNA等杂质被去除干净,无降解现象,所提取的DNA可被等限制性内切酶完全双酶切,进行MSAP分析得到大量清晰稳定的多态性条带。结果表明改进的CTAB-SDS法更适合于干玉米种子高质量总DNA的提取。
玉米种子;胚;DNA提取;MSAP
谷物干种子中含有大量的多糖和蛋白质,目前从谷物干种子中提取高质量的基因组DNA对于多数基因组实验分析成为一个瓶颈。例如,甲基化敏感扩增多态性(MSAP)技术已成为一个越来越受欢迎的用来识别一系列已知序列的基因的反向遗传学研究工具,MSAP技术是分析影响种子活力因素的最有效的方法之一[1,2]。由于干种子中多糖等物质和核酸具有相似的物理和化学性质,而蛋白质与核酸紧密结合形成复合物,基于种子幼胚基因组DNA进行高质量的提取具有一定的难度,为降低实验难度,大多数实验采用叶片基因组DNA[3]。因此,提取解决该问题关键则是有效去除与核酸紧密结合的多糖和蛋白质。目前为止,大量的实验方法见诸报端,例如CTAB法、SDS法和高低盐PH值法等已成为最常用的提取植物基因组DNA的方法[4]。另外,一些商业试剂盒也被推广使用。但是这些方法对于干燥的谷物种子样品存在或多或少的缺点。CTAB法能够有效去除多糖,SDS法则能够有效去除蛋白质,这两个方法的优势则为对方的缺点,单独使用均不能有效解决从谷物干种子中提取高质量的基因组DNA的问题。
为了从干种子中获得高质量的基因组DNA,我们结合传统的CTAB法和SDS法,采取二次沉淀的策略从干种子中获得DNA,从而避免了商业试剂盒在提取高质量DNA中所付出的昂贵代价,并且该方法不需要过滤和吸附装置。本实验在原有方法的基础上进行改良与比较,找到了一种能够从玉米种子胚中获得高质量DNA的方法,以期顺利开展MSAP分析等相关分子生物学实验。
1 材料与方法
1.1实验材料
实验中使用的郑单958种子购买于中国种子集团。其他谷物种子(大麦、小麦、水稻和高粱)均收集于农场试验田,干燥器室温储藏备用。
大约100 mg的成熟胚从干种子中剥离,分别用于提取基因组DNA。基因组DNA的产率用μg/mg(DNA/干样)表示。
1.2实验试剂及方法
1.2.1 实验试剂CTAB裂解液:3%CTBA;4%PVP;100 mMTris-HCl;20 mM EDTA(pH 8.0);1.4 M的NaCl。
SDS溶液:4%SDS;4%PVP;100 mMTris-HCl;20 mM EDTA(pH 8.0);1.4 M的NaCl。70%酒精;无水乙醇;平衡酚:氯仿:异戊醇=25:24:1(体积比);10 mg/mL RNase;ddH2O。
1.2.2 DNA提取方法取100 mg郑单958种胚,放置于-20℃冰箱保存,然后分别按以下方法进行DNA提取和纯化:
1.2.2.1 改良CTAB-SDS法1.将冷冻干燥的样品用液氮研磨成粉,转移到离心管,加入65℃预热的2 mL CTAB抽提液,65℃保温30 min,间或轻摇混匀。12000 r/min室温离心10 min,取上清液;2.加入1/5体积的酚:氯仿:异戊醇(25:24:1),轻轻混匀2 min,12000 r/min室温离心10 min,取上清液;3.加入等体积的-20℃预冷的异戊醇,轻轻摇动10 min,颠倒混匀至有白色絮状沉淀出现,然后在4℃条件下12000 r/min离心10 min,沉淀出DNA,去除上清液;4.向沉淀中加入2 mLSDS提取液,65℃保温30 min,直至沉淀不再溶解,12000 r/min室温离心10 min,取上清液;5.重复步骤2;6.加入等体积的-20℃预冷的异戊醇,轻轻摇动2 min,颠倒混匀,放入-20℃冰箱中30 min,4℃条件下12000 r/min离心10 min,沉淀出DNA,去除上清液;7.用70%乙醇洗涤2次,每次12000 r/min离心5 min。弃乙醇,自然晾干;加入50 μL去离子水,轻轻敲打使沉淀溶解;8.加入3 μL10 mg/mL Rnase 37℃水浴,保温1 h,去除RNA,DNA提取物于-20℃冰箱中贮存备用。
1.2.2.2 CTAB法参照Joseph等人的方法[5]。
1.2.2.3 SDS法参照Stephen.L等人的方法[6]。
1.2.2.4 高低盐pH法参照Pierre G等人的方法[7]。

图1 CTAB-SDS法提取DNA操作流程图Fig.1 The operation process of DNAextracted with CTAB-SDS method
1.3DNA质量检测
采用1%的琼脂糖凝胶电泳检测DNA完整度,使用Nanodrop(NP-2000)分光光度计检测DNA纯度及浓度。
1.4DNA的MSAP分析
MSAP分析参照Meng[8]的方法。基因组DNA分别使用限制性内切酶EcoRI/HpaII和EcoRI/MspI(TaKaRa,大连,中国)进行酶切。酶切-连接体系25 μL,包括模版DNA 250 ng,3 U EcoR I,3 U Hpa II(or Msp I),HpaII/MspI接头2 μL(5 μg/mL),EcoRⅠ接头0.2 μL(5 μg/mL),T4连接酶1.5 U,2.5µL 10×T4连接酶缓冲液。体系混匀37℃过夜,然后65℃孵育10 min。酶切、连接产物用于预扩增。
预扩增体系25 μL,包括5 μL的酶切-连接产物,40 ng的E+1和HM+1预扩增引物(表1),1 U的Taq DNA聚合酶1.0 μL的dNTPs(2 mmol/L),1.2 μL的MgCl2(2.5 mmol/L),和2 μL的10×PCR buffer。预扩增反应程序为94℃1 min;94℃30 s,56℃30 s,72℃1 min,共35个循环;72℃延伸10 min。
预扩增产物稀释20倍用于选择性扩增。选择性扩增体系25 μL,包括EcoRI和HpaII/MspI选择性扩增引物各2 μL(10 mmol/L)、2.5 μL的PCR缓冲液,Taq DNA聚合酶1 U、dNTP 1.6 μL(2 mmol/L)、稀释20倍的预扩增产物5 μL。选择性扩增反应程序为94℃1 min;94℃30 s,65℃30 s,72℃1 min,退火温度每循环一次降低0.7℃,13个循环;94℃30 s,56℃30 s,72℃1 min,23个循环;72℃延伸10 min。
预扩增产物与变性缓冲液1:1混合,95℃变性1 min,产物采用1%琼脂糖凝胶电泳预检测,6%的变性聚丙烯酰胺凝胶和银染法进行分离和检测。
表1 MSAP引物和接头序列Table 1 The sequence of joint and MSAP primer
2 结果与分析
提取基因组DNA的过程中所示流程图如图1所示。为了优化实验步骤,达到高质量、高产出,使用已报道过的三种方法分别进行了玉米种胚DNA的提取。如图2所示,传统的CTAB法和SDS法有相同的效果,在点样孔中均存在一定的蛋白质,高低盐PH值法提取的DNA完整性明显略低于前三者。而CTAB-SDS方法提取的DNA不含蛋白质,且完整性要高于高低盐pH值法。从表2可知,CTAB-SDS法提取的DNA产率略次于传统的CTAB法和SDS法,而高于高低盐pH值法。从OD260 nm/OD280 nm和OD260 nm/OD230 nm上可以看出CTAB-SDS法均高于其他三种方法,其中OD260 nm/OD280 nm处于1.80~2.00时,表示DNA样品蛋白质含量较低,DNA的纯度最高;OD260 nm/OD230 nm大于1.90时,说明DNA样品无有机小分子等杂质污染。由此可知,改良的CTAB-SDS法在玉米干种子高质量DNA提取方面优于其他三种方法。
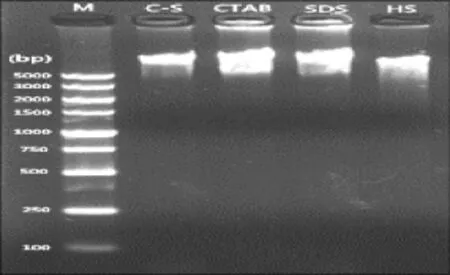
图2 不同DNA提取方法电泳图Fig.2 Electrophoresis of different DNA extraction

表2 玉米干种子种胚提取DNA的四种方法比较Table 2 Comparison between 4 methods DNA extracted from the embryo of maize dry seed
为了检验CTAB-SDS法是否适用于其他谷物干种子,我们挑选了小麦、大麦、水稻、玉米、和高粱5种谷物干种子进行DNA提取比较。从图3可以看到,除了条带亮度不一致之外,5种作物的DNA条带较为一致,且泳道内无弥散相信,表明DNA完整性较高。最上端的点样孔内无白色影像,表明各点样孔内均不存在蛋白质,100 bp以下区域不存在拖带现象,说明DNA样品不存在杂质污染。从表3可知,5种不同的谷物干种子提取DNA的产率均高于1 μg,且OD260 nm/OD280 nm和OD260 nm/OD230 nm值均处于合格范围之内,表明该方法适用于多种谷物干种子高质量DNA的提取。

图3 5种谷类作物种子DNA提取效果Fig.3 Effect of DNAextracted from 5 kinds of cereal crops
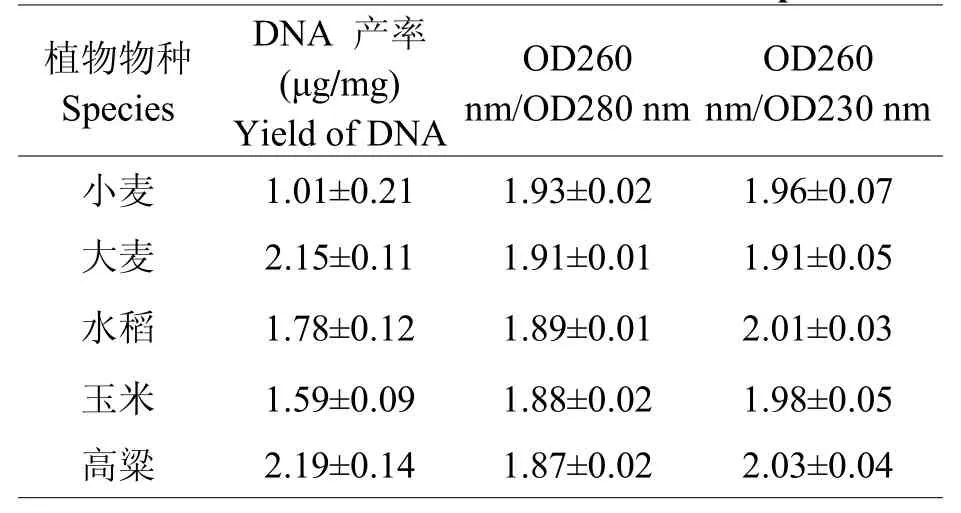
表3 5种作物使用CTAB-SDS法提取DNA质量比较Table 3 Comparison of DNAquality extracted with CTAB-SDS method from 5 kinds of crops
DNA质量的好坏决定着下游实验的顺利与否,通过MSAP分析,CTAB-SDS法提取的高质量DNA能够被限制性内切酶完全酶切,通过预扩增和选择性扩增,实现甲基化敏感多态性条带的分离。图4为DNA双酶切效果,与正向对照DNA相比较,酶切DNA泳道内呈现出弥散状,DNA的条带已经消失,表明DNA已经被完全酶切。MSAP聚丙烯酰胺凝胶电泳能够顺利完成,实现多态性片段分离,可以继续完成后续实验。表明使用该法提取的DNA能够胜任MSAP等对DNA质量要求较高的实验。
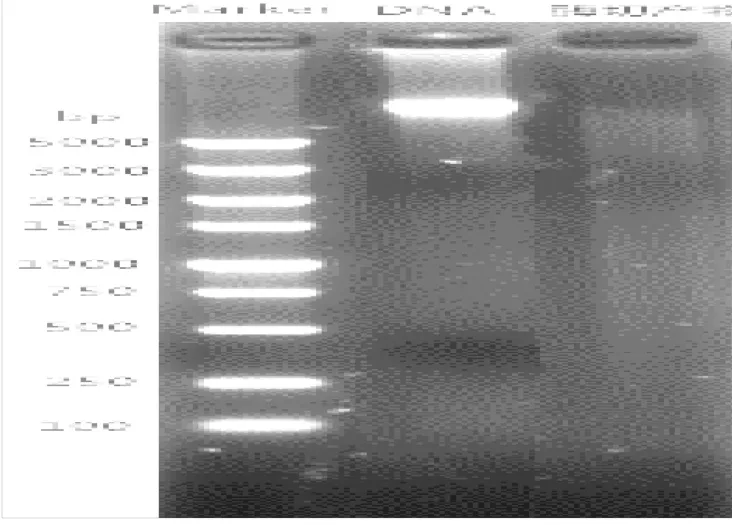
图4 DNA双酶切效果Fig.4 The effect of DNAcut with enzyme
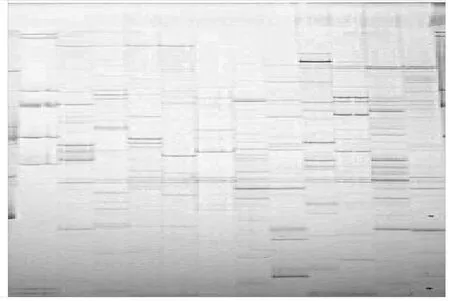
图5 选择性扩增敏感多态性条带Fig.5 Sensitive polymorphism bands by selective amplification
3 讨论
DNA提取种子分子生物学研究的最基础和最关键步骤的步骤之一,种子处于干燥状态时,由于DNA与组织蛋白等紧密结合形成复合物,在提取高质量DNA方面具有一定的难度,而当种子含有大量的蛋白质、多糖和次生代谢产物时则又加大了难度。和其他的生物分子一样,如酚类、丹宁酸、色素等,多糖和蛋白质干扰一些生物酶的活性,比如DNA聚合酶、连接酶和限制性内切酶等[9]。因此,这些复合物被认为是影响DNA消化的污染物,干扰后续实验的进行。比如本实验用到的玉米干种子就是这样的一种实验材料,其提取高质量DNA就显得较为困难。
聚乙烯吡咯烷酮(PVP)是一种能与多酚形成不溶物的络合物,可以降低DNA的酚类物质污染,此外,PVP还能够与多糖形成复合物并将其移除[10]。因此,PVP被应用于CTAB提取DNA的步骤中。本实验中,增加了PVP的浓度,起到了提高提取效率的作用。使用SDS裂解液可以有效地裂解细胞并释放出基因组DNA,但是由于多糖和蛋白质随着核酸一起沉淀,则使获得高质量DNA成为了难题。用于沉淀的蛋白质在SDS溶液中是不溶解的,而DNA则可以溶解,因此增加SDS二次溶解蛋白质和核酸复合物便成为了从干种子中获取高质量DNA的关键步骤。
近年来,基于不同的原理和几种改良的DNA提取方法,越来越多的植物DNA提取试剂盒被报道,但是,大多数试剂盒仍只是适用于新鲜的植物组织。但有时样品收集于特殊时期,植物材料处于干燥和半干燥状态,因此这些方法就很难完成从这些组织材料中提取高质量DNA的任务。另外,对于很多实验室而言,实验中所使用的试剂盒对于日常的DNA提取显得较为昂贵。种子分子生物学研究的热点之一是分子机理研究,然而对于干种子建立一种低廉且高效的DNA提取方法是很必要的。本实验中以成熟的玉米干种子进行高质量DNA的提取和后续的酶切、MSAP等实验表明,我们预期该方法能够适用于其他物种的高质量DNA的提取。
[1]Adiv A Johnson,Kemal Akman,Stuart R G,et al.The Role of DNA Methylation in Aging,Rejuvenation,and Age-Related Disease[J].Rejuvenat Research,2012,15(5):1324
[2]Yanli Lu,Ting zhao Rong,Moju Cao.Analysis of DNA methylation in different maize tissues[J].J.Genet. Genomics,2008,35:41-48
[3]Ayse Gul Ince,Fitnet Yildiz,Mehmet Karaca.The MAGi DNA extraction method for fresh tissues and dry seeds[J]. Journal of Medicinal Plants Research,2011,5(22):5458-5464
[4]Peterson D G,Boehm K S,Stack S M.Isolation of milligram quantities of nuclear DNA from tomato(Lycopersicon esculentum),a plant containing high levels of polyphenolic compounds[J].Plant Mol.Biol.Rep,1997,15:148-153
[5]Joseph Sambrook,David W Bussell.Molecular Cloning:A Lanoratory Manual[M].NewYork:Cold Sping Harber Laboratory Press,2001:898-915
[6]Stephen L Dellaporta,Jonathan Wood,James B Hicks.A Plant DNA Minipreparation:Version II[J].Plant Molecular Biology Reporter,1983,1:19-21
[7]Pierre Guillemaut,Laurence Mardchal-Drouard.Isolation of Plant DNA:A Fast,Inexpensive,and Reliable Method[J]. Plant Molecular Biology Reporter,1992,10(1):60-65
[8]F R MENG,Y C LI,J YIN,et al.Analysis of DNA methylation during the germination of wheat seeds[J].Biologia Plantarum,2012,56(2):269-275
[9]Zhanguo Xin,Junping Chen.A high throughput DNA extraction method with high yield and quality[J].Plant Methods, 2012,8:26
[10]Karaca M,Ince AG,Elmasulu S Y,et al.Coisolation of genomic and organelle DNAs from 15 genera and 31 species of plants[J].Anal.Biochem,2005(343):353-355
An Efficient DNA Extraction Method for MSAP Analysis on the Dry Cereal Seeds
XU Shu
Chongqing Industry&Trade Polytechnic College,Chongqing408000,China
Methylation sensitive amplification polymorphism(MSAP)is the main technology of DNA methylation and to obtain high quality DNA is the basis of the MSAP analysis.The dry embyos ofZea may(L.)seeds are rich in polysaccharides, protein and closely bind to nucleic acid preventing DNA extraction.The genomic DNA of maize seed was extracted by improved CTAB-SDS method and DNA quantity was checked.DNA samples were digested by restriction enzymesEcoR I andHpaII and MSAP analysis.The results showed that the genomic DNA was pure and integral without polysaccharides, protein,RNA and degradation.A260/A280of the obtained DNA solution was 1.86 and A260/A230ratios was greater than 2.00. The production rate was 1.8 μg/mg.The total DNA can be digested completely and MSAP fragments amplified with DNA template showed clear hands,and good polymorphic,stability and repetition.The results showed that the improved CTAB-SDS method was more suitable for high quality DNAextraction from dry corn seed.
Maize seed;embryo;DNAextraction;Methylation SensitiveAmplification Polymorphism(MSAP)
Q781
A
1000-2324(2014)05-0660-05
2013-03-11
2013-03-23
许殊(1973-),男,汉族,重庆垫江人,本科,高级讲师,研究方向:植物及植物生理.
